作者简介: 李晓佩, 女, 1984年生, 大连工业大学讲师 e-mail: li_xp@dlpu.edu.cn
酸性磷酸酶(ACP)是前列腺癌、 戈谢病、 肾病等疾病的重要生物标记物, 因此开发灵敏、 高选择性的ACP检测方法具有重要的意义。 目前, 已发展出多种ACP检测方法, 包括免疫法、 光谱法、 色谱法、 电化学法等; 其中, 荧光检测方法因灵敏度高、 选择性好、 快速、 准确等优点备受关注。 通过席夫碱反应, 利用2-氨基苯硼酸(2-APBA)二聚体和磷酸吡哆醛(PLP)合成了一种新型的ACP“Turn-on”型荧光底物APBA-PLP (ABPL)。 反应后, PLP的—CHO基团和2-APBA二聚体的—NH2基团的特征峰消失, 同时ABPL的—C=N—基团的特征峰出现; 此外,1H和1H—1H COSY核磁波谱的信号峰与ABPL的结构相对应。 以上表征结果证实了ABPL的成功合成。 进一步, 将ABPL应用于ACP检测。 我们发现向ABPL水溶液中加入ACP后, 体系的荧光强度增强, 机理为: 2-APBA二聚体为聚集诱导发光增强(AIEE)分子, 其AIEE特性源于2-APBA二聚体的高度有序堆积; 当2-APBA二聚体分子上引入PLP后(即合成ABPL), 分子的高度有序堆积结构被破坏; 加入ACP后, PLP水解为吡哆醛并从2-APBA二聚体分子上脱落, 2-APBA二聚体分子又可重新进行高度有序堆积, 表现为体系的荧光增强。 在0~5 U·L-1活性范围内, 376.5 nm处的相对荧光强度与ACP活性之间呈现出良好的线性关系( R2=0.99)。 此外, 当ACP、 果胶酶、 木瓜蛋白酶和脂肪酶的活性分别为4、 50 000、 80 000和10 000 U·L-1时, 四种酶对应的相对荧光强度分别为0.2、 -0.006、 0.03和0.05。 该结果表明ABPL对ACP具有高选择性。 ABPL分子易合成, 对ACP具有线性和高选择性响应, 为设计合成可用于ACP检测的新型高效荧光底物提供了新策略。
Acid phosphatase (ACP) is an important biomarker for several diseases, such as prostate cancer, Gaucher disease and kidney disease. Therefore, developing sensitive and highly selective assays for ACP is of great significance. To date, several assays for ACP have been reported, including immunoassay, spectrophotometry, chromatography and electrochemistry. Among these methods, fluorescence-based assays have gained prominence due to their high sensitivity, good selectivity, efficiency, and precision. In this study, a novel “turn-on” fluorescent substrate for ACP, named APBA-PLP (ABPL), was synthesized through the Schiff base reaction between 2-aminophenyl boronic acid (2-APBA) dimer and pyridoxal phosphate (PLP). After the reaction, the characteristic FTIR peaks associated with —CHO groups of PLP and —NH2 groups of 2-APBA dimer disappear, and a new FTIR band, originating from —C=N— vibrations of ABPL, appears. In addition, the1H and1H-1H COSY NMR spectra display all the ABPL signals. The FTIR and NMR results indicate the successful synthesis of ABPL. Furthermore, ABPL is applied to the detection of ACP. We observe an increase in fluorescence intensity of the ABPL solution upon adding ACP. This phenomenon is attributed to the aggregation-induced enhanced emission property of the 2-APBA dimer, which arises from its highly ordered stacking. The highly ordered stacking structure is disrupted upon the introduction of PLP onto the 2-APBA dimer (i.e., the synthesis of ABPL). Subsequent addition of ACP leads to the hydrolysis of PLP into pyridoxal, causing the detachment of PLP from the 2-APBA dimer molecule. The 2-APBA dimer molecules can then reassemble into a highly ordered structure, increasing the fluorescence intensity. The relative fluorescence intensity at 376.5 nm exhibits an excellent linear relationship ( R2=0.99) with ACP activity in the 0~5 U·L-1 range. Moreover, when ACP, pectinase, papain, and lipase activity were 4, 50 000, 80 000, and 10 000 U·L-1, respectively, the corresponding relative fluorescence intensities were 0.2, -0.006, 0.03, and 0.05. This result confirms the high selectivity of ABPL towards ACP. ABPL can be easily synthesized and exhibits a linear and highly selective response to ACP, presenting a new strategy for the design and synthesis of efficient fluorescent substrates for ACP detection.
酸性磷酸酶(acid phosphatase, ACP)是一类在弱酸性环境中(pH 4~6)高效地将磷酸单酯键水解为磷酸根和羟基的磷酸酯酶, 其广泛存在于动植物的体液和组织中[1, 2], 在生物磷代谢中发挥着重要的作用。 在人体中, ACP是一种重要的疾病标记物, 例如前列腺癌、 戈谢病、 肾病等会导致ACP浓度异常[3, 4], 因此开发灵敏、 高选择性的ACP检测方法具有重要的意义。 目前, ACP的检测方法有免疫法、 光谱法、 色谱法、 电化学法等[2, 5, 6], 其中荧光检测法因灵敏度高、 不需要复杂的样品前处理、 操作简单、 检测迅速、 成本低等优点备受关注[1, 7]。 Su等[8]以巯基丙酸修饰的CuInS2量子点为荧光探针, 报道了一种ACP荧光检测方法, 其原理为: 在Cu2+作用下, CuInS2量子点发生电子转移, 导致其荧光猝灭。 三磷酸腺苷(adenosine-5’ -triphosphate, ATP)可结合Cu2+, 体系中加入ATP后, CuInS2量子点的荧光恢复; 而ACP可水解ATP, 将Cu2+从结合物中释放出来, CuInS2量子点的荧光再次猝灭。 在6.4~192 nU· mL-1活性范围内, 相对荧光猝灭率与ACP活性之间呈现出良好的线性关系。 进一步, CuInS2量子点-Cu2+-ATP体系被成功应用于人类前列腺癌症细胞体外成像。 Zhang等[9]利用磷酸吡哆醛(pyridoxal phosphate, PLP)和铕配位聚合物纳米粒子, 设计了一种检测ACP的双荧光信号探针。 由于光诱导电子转移(photoinduced electron transfer, PET)效应, PLP猝灭铕配位聚合物纳米粒子614 nm处的荧光, 而ACP将PLP水解为吡哆醛(pyridoxal, PL), 消除PET效应, 使铕配位聚合物纳米粒子614 nm处的荧光恢复。 同时, PL在372 nm处发射荧光。 基于372和614 nm处的荧光双信号, 可实现ACP的高选择性检测, 线性范围分别为0.13~5.00和1.25~20.00 U· L-1。
聚集诱导发光增强(aggregation-induced enhanced emission, AIEE)效应是一种光物理现象, 是指分子聚集体表现出比单个分子更强的荧光发射[10]。 为阻碍荧光分子在聚集时产生导致荧光猝灭的π — π 堆积相互作用, AIEE分子通常具有较大的分子尺寸和高度扭曲的空间构象[11, 12]。 前期研究中[13], 我们发现2-氨基苯硼酸(2-aminophenylboronic acid, 2-APBA)并不是以单体形式存在, 而是通过脱去两分子水, 形成以动态共价B— N和B— O键相连接的二聚体(图1)。 2-APBA二聚体分子没有高度扭曲的空间构象, 分子中两个六元环所在平面之间的最大夹角为9.7° (2和3号六元环所在平面之间的夹角, 图1), 但固体状态时其荧光量子产率高达81.3%, 是目前文献报道中最小的芳香AIEE分子, 其AIEE机制为2-APBA二聚体分子通过分子间相互作用聚集, 产生不存在π — π 相互作用的高度有序分子堆积。
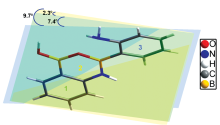 | 图1 2-APBA二聚体的晶体结构 1, 2和3号六元环所在平面的颜色分别为绿色、 黄色和蓝色Fig.1 Crystal structure of 2-APBA dimer The plane color of six-member rings 1, 2 and 3 are, respectively, green, yellow and blue |
本文中, 通过席夫碱反应, 利用2-APBA二聚体和PLP合成了一种新型的ACP“ Turn-on” 型荧光底物ABPL(图2), 用于ACP的检测。 其机理为: 2-APBA二聚体分子上引入PLP后(即合成ABPL), 分子的高度有序堆积结构被破坏; 当向ABPL水溶液中加入ACP后, PLP水解为PL并从ABPL上脱落下来, 2-APBA二聚体分子又可重新进行高度有序堆积, 表现为体系的荧光强度增强。
2-APBA二聚体(96%), PLP(98%)和ACP(≥ 0.15 U· mg-1)购于阿拉丁; 果胶酶(500 U· mg-1)和木瓜蛋白酶(800 U· mg-1), 购于源叶生物; 脂肪酶(100~500 U· mg-1), 购于Sigma。 FL6500荧光分光光度计, 珀金埃尔默, 入射和出射狭缝均为5 nm, 扫描速度240 nm· min-1, 光电倍增管电压400 V。 Spectrum two傅里叶变换红外光谱仪, 珀金埃尔默, 溴化钾压片法, 分辨率4 cm-1, 扫描次数16次。 Bruker-400核磁共振波谱仪, 测试采用内径为5 mm的BBO探头。
2-APBA二聚体(0.45 g)加入到25 mL甲醇中, 充分溶解后加入PLP(0.26 g)。 常温搅拌1 h后, 氮气保护下60 ℃反应5 h。 反应结束后离心, 产物多次用甲醇洗涤后在40 ℃真空干燥箱中干燥。
以50 mmol· L-1, pH 5.5的乙酸-乙酸钠缓冲溶液为溶剂, 配制40 U· L-1的ACP母液(基于ACP含量为0.15 U· mg-1计算得到)、 5× 105 U· L-1的果胶酶母液、 8× 105 U· L-1的木瓜蛋白酶母液、 1× 105 U· L-1的脂肪酶母液(基于脂肪酶含量为100 U· mg-1计算得到), 以上酶溶液现配现用。 用上述乙酸-乙酸钠缓冲溶液, 配制100 μ mol· L-1的ABPL母液。 取200 μ L ABPL母液, 不同体积酶母液于试管中, 最终用上述乙酸-乙酸钠缓冲溶液定容至2 mL, 37 ℃下, 振荡30 min后测试荧光光谱, 激发波长为300 nm。
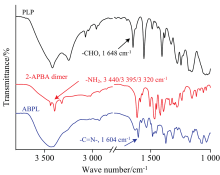
ABPL通过2-APBA二聚体与PLP的席夫碱反应制备而成(图2)。 首先, 利用傅里叶变换红外光谱(FTIR)对ABPL进行了表征。 如图3所示, 1 648 cm-1处的谱峰是PLP中— CHO的特征峰, 3 440、 3 395和3 320 cm-1处的谱峰是2-APBA二聚体中— NH2的特征峰, 当PLP和2-APBA二聚体发生反应后, 以上谱峰消失, 在1 604 cm-1处出现新峰, 对应ABPL中— C=N— 基团的伸缩振动。 FTIR结果表明ABPL制备成功。
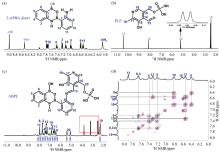
进一步, 对ABPL进行了核磁表征, 分别测试了2-APBA二聚体、 PLP、 ABPL的1H NMR谱及ABPL的1H— 1H COSY谱。 如图4(a, b)所示, 2-APBA二聚体和PLP的1H NMR谱中的信号峰与它们的结构相对应, 2-APBA二聚体1H NMR谱的信号归属源于我们前期的工作[13], 而PLP 1H NMR谱的信号归属基于核磁共振波谱基础知识。 1H— 1H COSY是一种常用的二维NMR技术, 可用于研究有机分子中质子间的耦合关系。 在1H— 1H COSY谱中, 当两质子间产生交叉峰时, 表明它们在有机分子结构中处于相邻的位置。 借助1H— 1H COSY谱[图4(d)], 对ABPL1H NMR谱的信号峰进行了归属, 其中红框中的谱峰为氘代试剂DMSO-d6和ABPL中残留的反应溶剂甲醇的峰[图4(c)]。 如图4(c)所示, 当PLP和2-APBA二聚体发生反应后, 2-APBA二聚体中— NH2的信号峰(5.9 ppm)及PLP中— CHO的信号峰(10.4 ppm)消失。 在7.9 ppm处出现归属于ABPL中— CH=N— 基团的信号峰。 此外, 图4(c)中各信号峰的积分面积与对应氢的个数相一致。 1H NMR谱表征结果进一步证实ABPL制备成功。
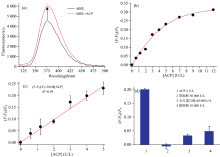
如图5(a)所示, ABPL溶液中加入ACP后, 体系荧光增强。 其机理为: 2-APBA二聚体为AIEE分子, 其AIEE特性源于2-APBA二聚体的高度有序堆积; 当2-APBA二聚体分子上引入PLP后(即合成ABPL), 分子的高度有序堆积结构被破坏; 加入ACP后, PLP发生水解, 其磷酸酯基团转变为羟基基团, 羟基基团进攻— C=N— 键, 使水解后的PLP(即PL)从2-APBA二聚体分子上脱落(图6), 2-APBA二聚体分子又可重新进行高度有序堆积, 表现为体系的荧光强度增强[14]。
 | 图6 以ABPL为底物的ACP活性检测原理图Fig.6 Schematic illustration of ACP activity detection using ABPL as the substrate |
如图5(b)所示, 随着ACP活性的增加, 376.5 nm处的相对荧光强度逐渐增强, 并最终趋向平缓。 在0~5 U· L-1活性范围内, 376.5 nm处的相对荧光强度与ACP活性之间呈现出良好的线性关系[图5(c)], 表明利用ABPL可实现ACP活性的定量检测。 进一步开展了选择性实验, 当果胶酶、 木瓜蛋白酶和脂肪酶的活性与ACP活性比值分别为12 500, 20 000和2 500时, 三种酶对应的相对荧光强度远低于ACP对应的相对荧光强度[图5(d)], 表明ABPL对ACP具有高选择性。 以上结果表明, 以ABPL为底物, 可实现ACP的高选择性定量检测。
与已报道的ACP荧光检测方法相比(表1), 本方法所使用的材料ABPL制备过程简单, 无需高温、 高压或强酸等条件, 不需要使用重金属; 其次, 本方法的检测过程简单, 将ABPL与ACP混合即可实现ACP的检测, 无需多种物质的共同参与; 再者, 本方法的线性检测范围与其他ACP荧光检测方法具有可比性。 然而, 受限于ABPL的发射波长, 本方法不能应用于ACP的胞内检测。 基于此, 我们将进一步对ABPL的分子结构进行优化, 以期合成出适用于ACP胞内检测的高性能荧光分子。
| 表1 不同ACP荧光检测方法比较 Table 1 Comparison of different fluorescent methods for ACP detection |
利用2-APBA二聚体和PLP合成了一种新型ACP“ Turn-on” 型荧光底物ABPL, 并对其结构进行了红外和核磁表征。 研究结果表明, 向ABPL溶液中加入ACP后, 体系的荧光增强, 且在0~5 U· L-1活性范围内, 相对荧光强度与ACP活性之间呈现良好的线性关系。 此外, 选择性实验结果表明当ACP活性远低于果胶酶、 木瓜蛋白酶和脂肪酶的活性时, 其对应的相对荧光强度显著高于三种酶对应的相对荧光强度。 ABPL分子易合成, 对ACP具有线性和高选择性响应, 为设计合成可用于ACP检测的新型高效荧光底物提供了新策略。 目前, 我们正在对ABPL的分子结构进行优化, 使ABPL的发射波长红移, 以期将ABPL应用于胞内的ACP检测。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|