作者简介: 梁文娟, 女, 1980年生, 山西大同大学化学与化工学院讲师 e-mail: wjliang1980@163.com
合成了4-(9H-咔唑-9-基)吡啶1-氧化物(CPNO)和4-(4-(9H-咔唑-9-基)苯基)吡啶1-氧化物(CPPNO)两种咔唑基-吡啶-N-氧化物内盐, 测定了它们在不同溶剂中的紫外-可见吸收和荧光光谱, 均表现出对溶剂极性较好的敏感性。 计算表明, 两个化合物都具有较大的激发态偶极矩, 是化合物溶剂极性敏感性的原因。 研究为开发新型的荧光极性探针提供了一种新思路。
This article synthesized two carbazole pyridine N-oxide internal salts, 4- (9H carbazole 9-yl) pyridine 1-oxide (CPNO) and 4-(4-(9H carbazole 9-yl) phenyl) pyridine 1-oxide (CPPNO). It measured their UV visible absorption and fluorescence spectra in different solvents, showing good sensitivity to solvent polarity. The calculation shows that both compounds have a sizeable excited state dipole moment, which is the reason for the solvent polarity sensitivity of the compound. The research results provide a new approach for developing novel fluorescent polarity probes.
溶质与溶剂的相互作用研究对于理解溶剂效应起控制作用的化学反应至关重要。 荧光分析法是目前非常重要的一个研究领域[1], 制备溶剂效应探针、 测定溶剂极性, 不仅在化学领域具有重要的意义, 在细胞水平探索生物化学反应、 生物物质的活性等方面均具有重要的意义[2, 3, 4, 5]。 在溶剂效应探针中, ET(30)类内盐型溶质变色探针是重要的一类, 但这类探针主要借助于吸收光谱获得溶剂效应, 如溶剂极性的ET(30)值。 这类探针通常具有两个吸光基团和一个拉电子基团的苯基衍生物组成, 在受到溶剂极性刺激时会发生颜色变化[6, 7]。 由于其具有独特的化学结构和光学特性, ET(30)类内盐型溶质变色探针已被广泛应用于生物和化学领域, 并在判断溶剂极性或生物微环境极性方面具有重要意义[8, 9, 10, 11, 12, 13]。 但是, ET(30)类内盐型溶质变色探针稳定性较差, 一些探针可能因为紫外光照而导致稳定性下降甚至失去活性。 ET(30)类内盐型溶质变色探针灵敏度可能受到探针本身特性的限制, 低浓度时不够敏感。 同时, ET(30)类内盐型溶质变色探针的制备过程复杂且成本较高, 从而限制了它在许多应用领域中的广泛使用[14]。 制备新型内盐型溶剂效应探针仍然具有挑战性。
本研究合成了两种新型咔唑基-吡啶-N-氧化物内盐, 利用其荧光特性研究溶剂极性, 由于其特殊的内盐结构, 使其具有较高的极性响应活性。 结果表明, 在不同极性有机溶剂中该化合物的荧光行为明显不同, 表现出对溶剂极性较好的敏感性, 为进一步开发新型荧光极性探针提供了新思路。
咔唑, N-甲基咔唑, 9-(吡啶-4-基)-9H-咔唑(9-PC)、 3-溴-9H-咔唑、 4-溴吡啶、 Pd2(dba)3、 叔丁醇钠, 二甲基氧杂蒽、 Cs2CO3、 1, 4-二恶烷、 mCPBA、 碳酸氢钠、 Na2SO4以及有机溶剂甲醇(MeOH, AR, 99.5%)、 乙醇(EthOH, AR, 99.7%)、 四氢呋喃(THF, AR, 99.9%)等均购自上海麦克林生化有限公司、 二氯甲烷(DCM, AR, 99.5%)购自天津市登峰化学试剂厂。
1.2.1 4-(9H-咔唑-9-基)吡啶1-氧化物(CPNO)的合成
自行设计合成方案, 将咔唑(16.7 g, 100 mmol), 4-溴吡啶(18.8 g, 120 mmol), 叔丁醇钠(19.2 g, 200 mmol), 2-(二环己基膦基)-2’ , 4’ , 4’ , 6’ -三异丙基-1, 1’ -联苯(4.7 g, 10 mmol)和3-(二亚苄基丙酮)-二钯(4.6 g, 5.0 mmol)混合, 反应完全后, 水洗, 用乙酸乙酯萃取水层, 再用饱和盐溶液洗涤有机层, 用硫酸钠干燥。 将干燥的有机提取物过滤并在减压下浓缩。 所得残留物用硅胶柱色谱法纯化, 得到9-(吡啶-4-基)-9H-咔唑 (14.6 g, 产率60%)。 LC-MS (ESI): 245.1(M+H)+。
在室温下, 9-(吡啶-4-基)-9H-咔唑(14.6 g, 60 mmol)的DCM(100 mL)溶液中加入3-氯过氧苯甲酸(18.2 g, 85%纯度, 90 mmol)。 将反应混合物在室温下搅拌2 h。 对混合物进行过滤, 浓缩过滤得到残留物。 残留物用硅胶柱色谱法纯化, 得到4-(9H-咔唑-9-基)吡啶1-氧化物(7.8 g, 30 mmol, 产率50%) LC-MS (ESI): 261.2 (M+H)+。
1H NMR (400 MHZ, DMSO) δ 8.44 (dd, J=2.4, 5.6 Hz, 2H), 8.27 (d, J=7.6 Hz, 2H), 7.77 (dd, J=2.4, 5.6 Hz, 2H), 7.55 (d, J=7.6 Hz, 2H), 7.50 (dt, J=7.2, 1.2 Hz, 2H), 7.36 (t, J=6.8 Hz, 2H)。
1.2.2 4-[4-(9H-咔唑-9-基)苯基]吡啶1-氧化物(CPPNO)的合成
(1) 9-[4-(吡啶-4-基)苯基]-9H-咔唑的合成
在N2下, 将4-(4-溴苯基)吡啶、 9H-咔唑、 Pd2(dba)3、 xphos和Cs2CO3在1, 4-二恶烷中的混合物, 在100 ℃加热18 h。 冷却反应混合物至室温, 用硅藻土垫过滤。 所得滤液减压浓缩, 得到粗产物, 用快速柱色谱法(硅胶, 用5% MeOH/DCM洗脱)纯化, 得到9-(4-(吡啶-4-基)苯基)-9H-咔唑, 为棕色固体。 HPLC/UV纯度: 100%; 液相色谱-质谱(电喷雾电离): 321.2 (M+1)+。
(2) 4-[4-(9H-咔唑基-9-基)苯基]吡啶1-氧化物的合成
在0 ℃和N2下, 向9-[4-(吡啶-4-基)苯基]-9H-咔唑在DCM中的溶液里分批加入3-氯过氧苯甲酸, 室温下将混合物搅拌18 h。 用冰水猝灭反应混合物, 用DCM萃取。 用NaHCO3水溶液, 水和盐水洗涤有机层, 用Na2SO4对其干燥、 浓缩, 并用快速柱色谱(硅胶, 用5%~8% MeOH/DCM洗脱)纯化, 得到4-(4-(9H-咔唑-9-基)苯基)吡啶1-氧化物, 为白色固体。 HPLC/UV纯度: 100%; 液相色谱-质谱(电喷雾电离): 337.2(M+1)+。
1H核磁共振(DMSO-d6): 8.32 (d, J=7.2 Hz, 2H), 8.26 (d, J=7.6 Hz, 6H), 8.08 (d, J=8.8 Hz, 2H), 7.9 (d, J=7.2 Hz, 2H), 7.76 (d, J=8.8 Hz, 2H), 7.45(d, J=3.6 Hz, 4H), 7.31~7.33 (m, 2H)。
紫外-可见吸收光谱采用PE LS-35紫外分光光度计(美国, PerkinElmer公司)完成。 荧光光谱采用F-2500荧光光谱仪(日本, 日立(HITACHI)公司)完成, 设定激发和发射单色器狭缝宽度2.5 nm(通带)。
光谱测量: 利用选定的溶剂将CPNO和CPPNO配置成0.01 mol· L-1的储备液, 使用的时候稀释至所需浓度的工作液。
可视溶致变色效应实验照片: 将适当体积的10 μ mol· L-1稀释液与1 mmol· L-1稀释液分别转移至干燥的西林瓶中, 在365 nm紫外灯照射下拍照。
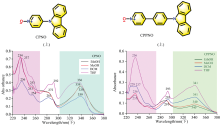
CPNO和CPPNO的分子结构如图1所示。 为了测试CPNO和CPPNO对溶剂极性的敏感性, 分别选择极性不同的二氯甲烷(DCM) 、 四氢呋喃(THF)、 乙醇(EthOH)和甲醇(MeOH)作为溶剂, 首先测量了紫外-可见吸收光谱, 在可见区并没有可观察的吸收特征, 其紫外吸收如图1[上、 下及(a, b)]所示。 CPNO产生三个较明显的吸收带, 具体峰值波长随溶剂极性而不同, 分别是234~254 nm带, 272~292 nm带和336~339 nm带。 CPPNO产生三个较明显的吸收带, 分别是235~237 nm带, 289~293 nm带和340~341 nm带。 这些吸收带的产生可能与n→ σ * 跃迁、 π → π * 跃迁和n→ π * 跃迁有关[19, 20, 21], 但具体归属还需要进一步确认。
为了进一步讨论CPNO和CPPNO吸收带的生色团来源, 分别测定了咔唑、 9-(吡啶-4-基)-9H-咔唑 (9-PC)、 N-甲基咔唑三个参考化合物的紫外吸收光谱, 结果表明, 这几种衍生物峰值在339~441 nm范围的吸收带大大减弱。 初步判断, 峰值位于339~341 nm的吸收带受到苯基吡啶基, 或者与— +N— O-基团的影响程度较大。 其吸收强度也受到溶剂较显著的影响。
注意到吸收光谱中包含一个对溶剂极性不敏感的吸收带, 一个对溶剂极性敏感的吸收带。 基于此, 如果考虑利用比率方法去探测溶剂极性标度应该是可行的。 因此, 分别考察了CPNO和CPPNO约290和340 nm处两个吸收带的吸光度的比值, 对不同溶剂极性参数介电常数, ET(30)值和溶剂受体数AN的相关性, 结果表明, 不同溶剂中两个吸收带峰值吸光度的比值, 与溶剂参数之间有一定的线性相关关系。 而且, THF、 DCM、 EthOH和MeOH这四种溶剂的极性对吸光度比值的影响趋势基本一致。 其中, 吸光度比值对介电常数ε 值相关性最好, 其次是ET(30), 相关参数见表1。
| 表1 在不同极性有机溶剂中CPNO和CPPNO光谱参数 Table 1 Spectral parameters of CPNO and CPPNO in different polar organic solvents |
2.2.1 CPNO
分别测定了探针CPNO在290和342 nm激发下的荧光发射光谱。 当激发波长为290 nm时, 其在甲醇(MeOH)、 乙醇(EthOH)、 二氯甲烷(DCM)、 四氢呋喃(THF)四种溶剂中发射峰最高峰波长分别为489、 466、 416和404 nm。 通过对比在不同溶剂中的发射波长, 甲醇溶液的发射波长最大, 乙醇溶液次之, 其次是二氯甲烷溶液, 四氢呋喃溶液的发射波长最小, 如图2(a, b)所示。
 | 图2 CPNO在有机溶剂中的荧光发射光谱[(a) 290, (b) 342 nm, Slits, 2.5/2.5 nm, 0.01 mmol· L-1]Fig.2 Fluorescence emission spectra [(a) 290, (b) 342 nm, Slits, 2.5/2.5 nm] of CPNO in organic solvent (0.01 mmol· L-1) |
而当激发波长为342 nm时, 其在甲醇、 乙醇、 二氯甲烷、 四氢呋喃四种溶剂中发射峰最高峰所对应的波长分别为492、 465、 417和402 nm, 四种溶剂中光谱红移的规律一致, 虽然红移的幅度有所差异。
根据实验数据发现, 激发波长对CPNO探针的发射波长的影响不很明显, 波长变化在1~3 nm之间。 激发波长对发射光谱带的位置影响不大, 说明激发波长不同时, 发射的起源是一致的。
随着四种溶剂极性的增大(MeOH> EthOH> DCM> THF), 发射光谱大幅度发生红移。 CPNO在四氢呋喃中的波长最小, 在甲醇中的波长最大。 二氯甲烷中的发射波长比四氢呋喃中的波长红移了59 nm, 乙醇中比四氢呋喃的发射波长红移了109 nm, 甲醇中比四氢呋喃中红移了132 nm。 由此可见, 甲醇的红移最大。 在极性溶剂中发生了较大程度的溶剂化效应, 而溶剂极性越大, 溶剂化效应也愈发明显, 溶剂化稳定能越大, 即发生谱带向长波移动的现象, 结果如表1所示。
2.2.2 CPPNO
分别测定了探针CPPNO在290和342 nm激发下的荧光发射光谱, 如图3(a, b)所示。 结果表明, 当激发波长为290 nm时, 其在四氢呋喃(THF) 、 二氯甲烷(DCM) 、 乙醇(EthOH)和甲醇四种溶剂中发射峰最高峰所对应的波长分别为426、 447、 496和508 nm; 而当激发波长为342 nm时, 在四种溶剂中发射峰最高峰所对应的波长分别为428、 446、 498和505 nm。 同样表明, 激发波长对发射波长变化不是很明显, 但是, 溶剂分子极性对发射波长变化影响较大。 随着四种有机溶剂极性的增大(MeOH> EthOH> DCM> THF), 发射光谱会发生大幅度红移。 其中, 无论激发波长为290 nm或是342 nm, 甲醇溶剂中的发射波长都达到了最大红移, 在四氢呋喃溶剂中红移最小。 在290 nm的激发波长下, 在甲醇中相比四氢呋喃红移了82 nm, 在乙醇中相比四氢呋喃红移了70 nm, 在二氯甲烷中相比四氢呋喃红移了21 nm; 在342 nm的激发波长下, 在甲醇中相比四氢呋喃红移了77 nm, 在乙醇中相比四氢呋喃红移了70 nm, 在二氯甲烷中相比四氢呋喃红移了18 nm。 这个结果可能归因于具有电荷转移特征的激发态。
 | 图3 CPPNO在有机溶剂中的荧光发射光谱[(a) 290, (b) 342 nm, Slits, 2.5/2.5 nm, 0.01 mmol· L-1]Fig.3 Fluorescence emission spectra [(a) 290, (b) 342 nm, Slits, 2.5/2.5 nm] of CPPNO in organic solvent (0.01 mmol· L-1) |
同一激发波长下, 随着溶剂极性的增大发射波长向长波方向移动更加明显, 而激发波长的改变对发射波长以及发射峰强度的影响较小。 激发波长对发射光谱带的位置影响不大, 同样说明激发波长不同时, 发射的起源是一致的。
进一步比较了咔唑和N-甲基咔唑在不同溶剂中的荧光光谱, 结果表明这两种化合物在波长大于400 nm区域都缺乏明显的发射带。 可以说明, 由于电荷转移作用, CPNO中氧化吡啶基, 使咔唑的荧光红移了40~130 nm(在不同溶剂中), 而CPPNO中苯基吡啶基, 使咔唑的荧光红移了50~150 nm, CPPNO的荧光发射红移程度较大。
根据以上结果, 按照式(1)计算了探针在不同溶剂中的斯托克斯位移Δ ν (cm-1), 计算结果见表1。
分别选择吸收光谱中290 nm(与激发波长290 nm对应)和340 nm附近的吸收带(与激发波长340 nm对应), 以及不同激发波长下的两个发射带, 分别计算约290和340 nm对应发射波长的斯托克斯位移。 CPNO和CPPNO在THF溶剂中的位移最小, 在甲醇溶剂中的位移最大。 同时考察了斯托克斯位移与不同溶剂极性参数, 如介电常数, ET(30)值和溶剂受体数AN的相关性[22, 23]。 结果表明, 所选这四种溶剂的极性对斯托克斯位移Δ ν 的影响趋势基本一致。 但是, 斯托克斯位移对ET(30)值相关性最好, 如图4(a, b)所示, 其次是Δ ν 对AN。 这表明, 第一, 斯托克斯位移与溶剂极性是相关的, 说明作为极性荧光探针CPNO和CPPNO是可行的。 第二, 两种探针具有与ET(30)相似的作用机制, 即电荷转移荧光具有主导作用。
为了进一步讨论两种探针溶剂效应的起源, 计算了探针分子基态和第一激发态的偶极矩[16], 结果如图5所示。 CPNO的基态和第一激发态偶极矩分别为2.83和13.6 D, 二者相差近10.7 D。 CPPNO的基态和第一激发态偶极矩分别为2.59和22.5 D, 二者相差近19.9 D。 一般认为, 基态偶极矩和激发态偶极矩相差越大, 溶剂效应越显著。 而且, 也说明激发态电荷转移作用较为显著。 所以结果表明CPPNO溶剂效应更明显。 同时, 两种探针分子的跃迁偶极矩取向如图5所示。 此外, 优化结构后, CPNO中的吡啶环相对于咔唑环之间的二面角为57.07° , CPPNO中的苯环相对于咔唑环之间的二面角为55.54° , 更有利于分子内电荷分离, 有益于荧光的发射过程。
为了进一步分析探针的发光机理, 计算了CPNO和CPPNO的前线轨道。 电子云密度的分布如图5(b)所示。 HOMO轨道中电子的离域较好, 但在LUMO轨道中, 电子集中在取代基吡啶环和苯基吡啶环基上, 咔唑母体对LUMO轨道的贡献不大, 因此, 当电子从HOMO激发到LUMO轨道时, 电子转移非常明显, 电子由咔唑环转移到苯环和吡啶环, 可能发生π * (LUMO)→ n(HOMO)的电子辐射跃迁, 即CT荧光起主导作用。
对前线分子轨道的能量分析, 如表2所示。 不同能隙Δ E可能对应于不同的吸收带, CPNO的HOMO-LUMO, HOMO-LUMO+1, HOMO-LUMO+2跃迁, 对应的吸收波长为303, 281和276 nm。 CPPNO的HOMO-LUMO, HOMO-LUMO+1, HOMO-LUMO+2跃迁, 对应的吸收波长为331、 277和272 nm, 结果与实验吻合程度比较好。
| 表2 CPNO和CPPNO的部分前线分子轨道能量 Table 2 Partial frontline molecular orbital energy of CPNO and CPPNO |
在两种浓度水平, 对四种溶剂的CPNO和CPPNO溶液, 比较了在365 nm紫外灯照射下颜色的变化情况。 如图6所示: 在紫外灯照射下CPPNO的甲醇溶液与乙醇溶液会发出蓝绿色的荧光(与荧光光谱对应, 490~500 nm), 二氯甲烷溶液和THF溶液会发出蓝色(420~460 nm)的光。 较低浓度下, 发光就很明显。 而CPNO的甲醇溶液与乙醇溶液会发出黄绿色的荧光, 二氯甲烷溶液和THF溶液会发出蓝色的光。 低浓度时, 发光颜色的差别不及CPPNO明显。 该实验很好地证明, CPNO和CPPNO探针的溶质变色探针行为, 随着溶剂极性的变化, 探针的颜色也在明显变化。
合成了两种新型的咔唑基-吡啶-N-氧化物内盐(CPNO和CPPNO), 通过测定该化合物在不同溶剂中的紫外吸收和荧光光谱, 随着溶剂极性的变化, 无论其光吸收过程还是荧光发射过程, 都可以观察到比较明显的颜色变化, 该探针对溶剂极性表现出较好的敏感性, 为进一步开发新型的荧光极性探针, 及其在生物医学、 环境监测和化学分析等领域的潜在的应用具有重要的意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|