作者简介: 程文轩, 1999年生, 成都理工大学核技术与自动化工程学院硕士研究生 e-mail: chengwenxuan23@163.com
禽蛋产业中抗生素残留超标问题作为重要的食品安全问题之一, 近些年来受到了广泛关注。 目前对畜禽产品抗生素残留的检测方法主要采用微生物检测法、 免疫分析法、 高效液相色谱法等方法, 但这些方法对于现场样品的快速检测还存在一定的不足。 应用具有高灵敏度、 高分辨率、 速度快等特点的激光诱导荧光分析技术, 开展鸡蛋中抗生素残留快速检测方法研究。 样品以蛋清为溶剂, 抗生素种类选用鸡蛋中可能残存的抗生素, 包括环丙沙星、 诺氟沙星、 氧氟沙星、 土霉素和庆大霉素, 通过加入抗生素试剂模拟鸡蛋中抗生素的残留, 测定了不同浓度下的抗生素荧光光谱。 采用欧氏距离及概率密度的方法进行定性分析, 定性分析的准确率在三倍标准差范围内达到了100%。 在对已有的几种不同浓度样品进行检测分析后, 建立了每种抗生素对应的c-S拟合曲线。 结果表明, 在有效检测范围内(环丙沙星: 0.000 1~1 mg·mL-1, 诺氟沙星: 0.000 2~1 mg·mL-1, 氧氟沙星: 0.000 05~1 mg·mL-1, 土霉素: 0.000 1~0.2 mg·mL-1, 庆大霉素: 0.01~1 mg·mL-1), 可以根据荧光峰的净峰面积比较准确地计算抗生素含量。 最后, 计算了抗生素定量曲线的准确度和检出限, 说明了该方法可以应用到鸡蛋中抗生素的残留量检测, 但目前还存在检出限较高的问题, 需要更进一步研究来降低检出限。
In recent years, the issue of excessive antibiotic residues in the poultry egg industry has drawn considerable attention as a serious food safety concern. Currently, immunoassay, high-performance liquid chromatography, and microbial detection are the three primary techniques used to detect antibiotic residues in livestock and poultry products. When it comes to quick on-site sample testing, these technologies do have certain drawbacks. This study established a quick, accurate, and fast approach for detecting antibiotic residues in eggs using laser-induced fluorescence analysis. The antibiotics that might be found in chicken eggs were chosen for the samples, including ciprofloxacin, norfloxacin, ofloxacin, tetracycline, and gentamicin. The samples were created using egg white as the solvent. Antibiotic reagents were applied to imitate antibiotic residues in eggs, and the fluorescence spectra of antibiotics at various doses were examined. Euclidean distance and probability density approaches were used for the qualitative analysis, which had a 100% accuracy rate within three standard deviations. After examining samples at different concentrations, each antibiotic's calibration curves (c-S curves) were created. The results showed that within the effective detection range (ciprofloxacin: 0.000 1 to 1 mg·mL-1, norfloxacin: 0.000 2 to 1 mg·mL-1, ofloxacin: 0.000 05 to 1 mg·mL-1, tetracycline: 0.000 1 to 0.2 mg·mL-1, chloramphenicol: 0.01 to 1 mg·mL-1), the antibiotic content could be calculated more accurately based on the net peak area of the fluorescence spectra. Ultimately, the precision and detection bound of the antibiotic quantitative curve were computed, suggesting that the technique is applicable to detect antibiotic residues in eggs; however, the high detection limit remains an issue, necessitating additional investigation to lower the detection limit.
抗生素由于其对病原微生物的抑制或杀灭作用, 广泛应用于临床医学、 农业种植[1]和畜牧养殖[2]等多个领域。 随着抗生素的广泛应用, 其带来的危害也开始出现。 近年来, 国家食品安全监管部门通报了多批次鸡蛋及蛋鸡组织中检出抗生素残留的情况[3, 4], 长期食用抗生素残留的鸡蛋可能会引起抗生素在体内累积, 对人体健康构成威胁[5]。
目前, 抗生素的检测方法主要有高效液相色谱法、 微生物检测法、 酶联免疫法、 分光光度法和电化学方法等。 但这些方法可能花费时间较长、 灵敏度较低, 只适用于实验室少量样品检测及样品的初筛查, 或者检测成本较其他方法高, 检测设备复杂[6]。 鸡蛋的生产和消费数量都非常庞大, 因此亟需要寻找一种能够高效、 快速地检测鸡蛋中抗生素残留的方法。 以激光作为激发光源的激光诱导荧光光谱技术, 具有高灵敏度、 高分辨率、 速度快等优点[7], 有利于实现样品“ 无损伤、 无污染” 检测, 适用于物质的痕量检测分析, 并且设备集成化程度高, 方便现场使用。
本文使用激光诱导荧光分析设备, 通过在鸡蛋中添加抗生素模拟不同种类及浓度的抗生素残留, 对鸡蛋进行了几种常见抗生素的种类和含量分析, 可为鸡蛋中抗生素残留的现场快速检测提供依据和参考。
物质分子受到紫外激光照射后, 吸收能量从稳定的基态发生跃迁到激发态, 而处于激发态的分子不稳定, 会通过释放能量的方式返回基态。 当物质中具有荧光基团时, 处于第一激发态最低能级上的电子以光子形式释放的能量, 就是分子荧光[8]。 由于不同种类的抗生素在分子结构、 荧光基团种类和数量、 自身的物理化学性质等方面存在差异, 这会导致荧光光谱也拥有其不同特征, 通过对这些特征的分析处理, 可以实现抗生素种类分辨。
根据朗格比尔定律[9], 荧光强度F的计算如式(1)表示
式(1)中, K为介质的吸收系数, I0为激发光强度, ε 为摩尔吸收系数, l为光通过样品的长度, c为样品浓度。
对于同一种样品, 在入射光强度不变时, 可将KI0看作为常数a, 当测量条件一致时, 可将ε l看作为常数b, 可得到式(2)
对同种抗生素在不同浓度条件下进行测量, 得到多组浓度和荧光强度的数据, 通过拟合可以得到式(2)中的常数a和b。 对于未知浓度的抗生素样品, 在测得荧光强度F后, 即可根据拟合得到的式(2)推算出浓度c, 以此实现抗生素浓度的测定。
测量系统核心采用405 nm激光器和海洋光学Maya2000pro光谱仪, 由上位机软件控制激光器功率及光谱仪的积分时间, 配合荧光探头模块等实现样品分析[10]。 在进行测量时, 激光器发射的激光通过光纤传输, 经光纤探头准直滤波后聚焦到样品上, 样品受激发后发射的荧光经光纤探头的收集后通过光纤传输至光谱仪。 光纤探头中有窄带滤波片和长通滤波片, 可以使入射激光的波长更精确, 并防止入射激光进入光谱仪中, 准直镜用来聚焦激光以及收集发射荧光。 系统结构和荧光光纤探头结构如图1所示, 激光器的参数列在表1中。
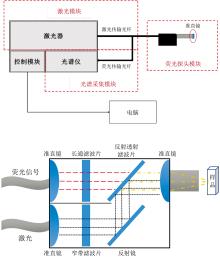 | 图1 便捷式405 nm激光诱导荧光光谱测量系统及荧光光纤探头结构示意图Fig.1 Schematic diagram of portable 405 nm laser-induced fluorescence spectroscopy measurement system and fluorescence fiber optic probe |
| 表1 激光器和光谱仪参数 Table 1 Parameters of the laser and spectroscope |
实验选用的鸡蛋采购于某超市, 并使用抗生素残留快速检测卡对鸡蛋做抗生素无扰检测。 结果表明, 所选用的鸡蛋样品中待检测抗生素浓度均低于检测卡检测限0.2 μ g· kg-1或无抗生素残留。 抗生素选用畜牧产品中常见种类, 包括环丙沙星、 诺氟沙星、 氧氟沙星、 土霉素和庆大霉素, 具体信息如表2所示。
| 表2 实验中使用的抗生素及其他试剂材料 Table 2 Antibiotics and other reagent materials used in the experiment |
考虑到溶液pH值改变可能会导致抗生素分子结构发生变化, 从而对荧光发射峰位造成影响[11]。 实验配置了pH 1~6的盐酸缓冲液, 用盐酸缓冲液和纯水溶解抗生素固体制备pH 1~7时五种抗生素1 mg· mL-1的标准样品, 并分别进行了测量, 获得了每种抗生素在不同pH环境下的荧光光谱。 对每种抗生素荧光峰强度做归一化处理, 对比结果如图2所示。 为了能够获得强度较高的荧光光谱, 并且排除不同pH环境对抗生素分子结构造成影响, 以及便于样品前期的批量处理, 本研究将检测时溶液的pH值设定为3。
 | 图2 pH值与抗生素荧光光谱归一化峰值的关系Fig.2 The relationship between pH value and the normalized peak value of the fluorescence spectrum of antibiotics |
在实验材料的选取方面, 由于蛋黄具有颜色, 澄清度低, 透光性差, 不利于光谱分析; 蛋清含水量高, 是一种近似透明的液体, 透光性好, 有利于光谱分析, 所以本文选取蛋清液作为实验基础材料, 所有实验样品的配制如图3所示。
蛋清溶剂由蛋清加入稀盐酸调节pH至3后得到, 使用蛋清溶剂溶解抗生素得到pH为3的蛋清抗生素1 mg· mL-1标准加标样品, 再加入蛋清溶剂稀释最终得到不同浓度的蛋清抗生素加标样品。 将配制好的样品溶液用移液器吸取3 mL, 装入石英皿, 再将石英皿放入测量用的暗室中, 避免环境光源对光谱检测的影响。 在软件中设置合适的激光功率和积分时间, 即可控制仪器发射激光并采集荧光光谱。
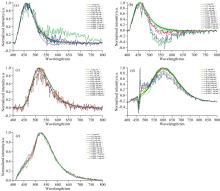
对不同浓度的抗生素加标样品进行激光诱导荧光检测, 扣除蛋清本底荧光并对荧光光谱做归一化处理, 结果如图4所示, 其中P代表激光功率, t代表积分时间。
为了对抗生素类型进行识别, 本文探讨不同种类抗生素加标样品荧光光谱做归一化后彼此间欧氏距离的特征, 以此作为聚类分析方法。 选取各类抗生素加标样品不同浓度下多次测量得到的荧光光谱各140条, 扣除蛋清本底并做归一化处理, 其中70条用于计算欧氏距离及其分布特征, 另70条用于方法验证。 五种抗生素的特征峰都在410~650 nm范围内, 选取该波段作为分析范围, 求取70个光谱向量的平均值作为每种抗生素的中心光谱, 再使用式(3)计算每种抗生素70个荧光光谱与五种抗生素中心光谱的欧氏距离。
式(3)中, a, b分别代表样品光谱和中心光谱, n为光谱向量的维度。
此时得到每种抗生素70个光谱分别与五个中心光谱的欧氏距离各五组, 使用式(4)对其中每一组计算均值和标准差, 结果列于表3中, 再利用式(5)计算得到每个欧氏距离的正态概率密度p
| 表3 五种抗生素与不同中心光谱欧氏距离的均值和标准差 Table 3 Means and standard deviations of Euclidean distances between five antibiotics and different central spectra |
式(4)和式(5)中,
以抗生素加标样品荧光光谱与中心光谱的欧式距离为横坐标, 欧式距离对应的正态概率密度为纵坐标, 分别绘制每种抗生素加标样品荧光光谱与五个抗生素中心光谱的欧式距离的分布特征, 结果如图5所示。
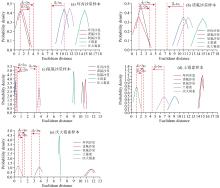 | 图5 五种抗生素归一化光谱与五个中心光谱的距离的正态分布Fig.5 Normal distribution of distances between normalized spectra of five antibiotics and five central spectra |
从图5(c)、 (d)和(e)中可以看出, 氧氟沙星、 土霉素和庆大霉素三种抗生素加标样品荧光光谱与其相同类型抗生素的中心光谱的欧式距离的概率分布, 比较明显地区别于与不相同类型的抗生素的中心光谱, 并且在欧式距离的大小上都表现为与相同类型抗生素中心光谱的更小, 即更接近。 分别在图中标识出与相同类型的抗生素的中心光谱欧式距离概率密度分布的均值
但是, 从图5(a)和(b)中可以看到, 分别代表环丙沙星和诺氟沙星与其两类抗生素中心光谱的欧氏距离的概率密度分布的黑色线和红色线, 两条线的线型相似且存在重叠, 因为两种抗生素加标样品荧光光谱形状相似且峰位相近, 分别位于457和453 nm附近, 影响了两种抗生素的准确分辨。 将两者用于计算欧氏距离的光谱范围缩小至410~480 nm, 再按照上述步骤重新计算环丙沙星和诺氟沙星的欧氏距离的正态概率密度, 结果如图6所示。 此时环丙沙星和诺氟沙星加标样品荧光光谱与两个中心光谱的欧氏距离有较为明显的差异, 可以进行两者的区分。
 | 图6 环丙沙星和诺氟沙星抗生素归一化光谱与两者中心光谱的距离的正态分布Fig.6 Normal distribution of the distances between the normalized spectra of Ciprofloxacin and Norfloxacin and their central spectra |
| 表4 环丙沙星和诺氟沙星与不同中心光谱欧氏距离的均值和标准差 Table 4 The mean and standard deviation of Euclidean distance between Ciprofloxacin and Norfloxacin and different central spectra |
计算用于方法验证的每种抗生素各70条加标样品荧光光谱与之前五个抗生素中心光谱的欧氏距离, 根据每条荧光光谱距离某一中心光谱的欧氏距离是否在一定范围内确定其所属类别。 其中, 判断条件分别为是否在与均值2倍标准差和3倍标准差的范围内, 最终结果列于表5中。
| 表5 以欧氏距离为判据对五种抗生素测试样本的识别率 Table 5 The recognition rate of the five antibiotic test samples based on the Euclidean distance as the criterion |
从表5中结果可以看出, 在均值两倍标准差的范围内, 除庆大霉素以外的四种抗生素均达到了100%识别率, 在三倍标准差范围内, 每种抗生素都能做到准确识别。 综上所述, 通过计算样品的光谱与已知抗生素的中心光谱的欧氏距离, 即可实现对环丙沙星、 诺氟沙星、 氧氟沙星、 土霉素和庆大霉素类型的识别。
为了增强检测结果的准确性, 减少本底影响, 荧光峰峰面积先做空白校正, 扣除本底, 得到净峰面积S, 再进行定量方程的拟合计算。
环丙沙星、 诺氟沙星和庆大霉素三种抗生素在不同浓度条件下使用405 nm激光激发获得的荧光光谱如图7所示。
 | 图7 不同浓度(a)环丙沙星、 (b)诺氟沙星和(c)庆大霉素加标样品的荧光光谱Fig.7 Fluorescence spectra of spiked samples with different concentrations of (a) Ciprofloxacin, (b) Norfloxacin and (c) Gentamicin |
从图7中可以看出, 三种抗生素的荧光光谱特征峰面积与加标浓度都呈正相关关系。 环丙沙星和诺氟沙星的特征荧光峰在410~600 nm, 因此选取此段波长计算两种抗生素的净峰面积S。 庆大霉素的荧光光谱在480~700 nm发射特征荧光峰, 所以选取该波段计算净峰面积S用于拟合c-S曲线。 但是在进行c-S曲线拟合时发现, 庆大霉素在浓度较低时的数据点无法达到较好的拟合效果, 这可能是由于样品配制时选择的pH条件对庆大霉素的荧光激发不是最有利的, 从图2中可以看出, 为了统一样品配制环境所选取的pH 3不能使庆大霉素的荧光强度达到最大化。 所以为了更准确的拟合结果, 舍弃了低浓度范围内的光谱数据。
以加标浓度为横坐标, 净峰面积为纵坐标, 绘制了三种抗生素特征荧光峰净峰面积随加标浓度的变化趋势图。 可以看出, 对于三种抗生素, 变量之间整体呈现指数增长的趋势。 在三种抗生素加标样品对应的检测范围内, 拟合c-S定量曲线函数关系, 结果如图8所示, 拟合关系式参数见表6。
 | 图8 (a)环丙沙星、 (b)诺氟沙星和(c)庆大霉素加标样品c-S拟合曲线Fig.8 c-S fitting curves of spiked samples of (a) Ciprofloxacin, (b) Norfloxacin and (c) Gentamicin |
| 表6 环丙沙星、 诺氟沙星和庆大霉素c-S拟合曲线参数, S=a(1-e-bc)+S0 Table 6 Parameters of c-S curve fitting of Ciprofloxacin, Norfloxacin and Gentamicin, S=a(1-e-bc)+S0 |
从拟合结果可以看出, 数据点与拟合曲线没有明显偏离, 相关系数R2都达到了非常可信的程度。 因此, 在环丙沙星和诺氟沙星抗生素加标样品对应的检测范围内, 建立的c-S定量曲线可以用于鸡蛋中环丙沙星和诺氟沙星抗生素的含量检测。 而在pH 3的溶液环境下, 使用405 nm激光诱导荧光方法检测鸡蛋中庆大霉素含量有局限性, 此时建立的c-S定量曲线只适用于浓度较高(c> 10 μ g· mL-1)的检测, 无法对鸡蛋中低浓度庆大霉素含量进行准确有效的检测。
氧氟沙星和土霉素两种抗生素在不同浓度条件下使用405 nm激光激发获得的荧光光谱如图9所示。 特征荧光峰分别在430~650和470~750 nm范围内, 选取这两段波长分别计算两种抗生素的净峰面积S。
 | 图9 不同浓度(a)氧氟沙星和(b)土霉素加标样品的荧光光谱Fig.9 Fluorescence spectra of spiked samples with different concentrations of (a) Ofloxacin and (b) Oxytetracycline |
观察图9(b)可以发现, 土霉素在浓度c=1 mg· mL-1时的荧光光谱强度反而低于浓度c=0.5 mg· mL-1和c=0.2 mg· mL-1时的荧光光谱强度, 这与加标样品浓度越大, 荧光光谱特征峰强度越强的基本关系相悖。 造成该现象的原因可能有两方面: 第一, 浓度较高时, 土霉素和溶剂发生碰撞作用的概率增大, 损失能量较大; 第二, 浓度较高时, 土霉素发生自吸收效应, 降低了量子产率, 导致荧光强度降低[12]。 因此, 在建立土霉素的c-S拟合曲线之前, 需要选择合适的浓度范围内的数据点, 较高浓度的数据可能会影响整体拟合曲线的准确性。
以加标浓度为横坐标, 净峰面积为纵坐标, 绘制抗生素特征荧光峰净峰面积随加标浓度的变化趋势图, 发现整体呈指数变化。 在两种抗生素加标样品对应的检测范围内, 拟合c-S定量曲线函数关系, 结果如图10所示, 相关参数列于表7中。
 | 图10 (a)氧氟沙星和(b)土霉素加标样品c-S拟合曲线Fig.10 c-S fitting curves of spiked samples of (a) Ofloxacin and (b) Oxytetracycline |
| 表7 氧氟沙星和土霉素c-S拟合曲线参数, S=a(1-e-bc)+S0 Table 7 Parameters of c-S fitting curves of Ofloxacin and Oxytetracycline, S=a(1-e-bc)+S0 |
如图10所示, 氧氟沙星和土霉素在已测得样品浓度范围内的c-S拟合都具有不错的效果, 拟合曲线的相关系数分别达到了0.999 7和0.994 1, 具有较高的可信度。 但与前面三种抗生素的c-S拟合曲线略有不同的是, 氧氟沙星和土霉素的c-S拟合曲线随着加标浓度增大, 末端逐渐趋向于平缓饱和的趋势。 这可能是因为在高浓度环境下, 抗生素上的荧光分子会紧密地聚集在一起并发生相互作用, 引起碰撞, 从而导致荧光猝灭[13, 14]。 除了分子间相互作用外, 诸如荧光分子的光漂白、 自吸收等因素也可能会导致荧光强度的饱和现象。 因此, 对氧氟沙星和土霉素浓度与荧光强度的分析不宜浓度过高, 以规避饱和问题。
为了验证c-S定量曲线的准确度, 按照相同标准配制了每种抗生素加标浓度c0分别为0.1、 1和5 μ g· mL-1的抗生素加标样品, 由于庆大霉素拟合曲线目前只适用于高浓度情况, 且国标中还没有对限值做出明确规定, 所以暂不对此类抗生素做准确性分析。 以30 min为时间间隔, 在t1, t2, t3时刻分别测量三次, 将测量得到的光谱数据扣除本底后得到净峰面积Si, 带入之前的得到的c-S定量曲线计算得到对应抗生素加标样品浓度ci, 利用式(6)计算出测量结果的相对误差(relative error, RE), 计算结果在表8中列出。
式(6)中, c0为已知加标浓度; ci为计算值。
| 表8 准确度测试结果 Table 8 Accuracy test results |
根据表8, 结果显示, 环丙沙星、 诺氟沙星、 氧氟沙星和土霉素在90 min中内连续测量三次的相对误差在-0.67%~1.67%之间, 说明建立的四种抗生素c-S定量曲线具有良好的准确度。
检测限代表仪器能够得到的区别于噪声的最小信号[10], 为了获得本系统能够检测出的抗生素最小浓度, 通过式(7)计算了405 nm激光诱导荧光系统的浓度检测限Dc
式(7)中, c为待测样品的浓度; M为激光仪器的置信因子, 一般取2~3, 本次实验M=2;
式(8)和式(9)中, n和m分别代表数据量和测量次数; Fi是待测样品和空白本底的特征荧光强度差值。
质量检测限Dm可以利用式(10)将浓度单位换算为质量单位
式(10)中, Dc加标浓度检测限; Cew是蛋清溶剂中蛋清的相对含量。 本文鸡蛋的密度按照1.1 g· mL-1, 根据蛋清溶剂的配置, 计算得到Cew=0.356 g· mL-1。
本文对五种抗生素的加标样品按照各自的测量参数分别进行三次测量, 利用式(8)和式(9)计算出样品的
| 表9 五种抗生素加标样品的浓度检测限Dc Table 9 Concentration detection limit, Dc of five antibiotics spiked samples |
本文的方法相较于国家标准GB/T 21312—2007和GB 31658.6—2021中所采用的液相色谱法和质谱法, 在样品前期处理流程和后期检测方面会更加简单, 单个样品的分析检测时间短, 仪器和试剂的检测成本也会更加低廉, 仪器的小体积也具有不错的便携性, 这些优点使得激光诱导荧光方法在生产现场进行快速的实时检测方面更具优势。 但是从目前的实验结果来看, 对比禽蛋食品中部分兽药国家限量标准(GB31650—2019/GB31650—2022)所要求的环丙沙星等喹诺酮类抗生素不得检出和土霉素等四环素类抗生素残留限量不超过400 μ g· kg-1的要求, 其检测限还存在较高的问题。 对于更低含量的残留检测, 还需要进行更多研究来降低检出限。
使用405 nm激光诱导荧光系统, 以超市采购的鸡蛋作为检测对象, 通过添加五种禽蛋中可能残留的抗生素模拟鸡蛋中抗生素残留的情况, 对鸡蛋清中不同浓度条件下的抗生素进行了类别识别分析和含量分析。 采用计算每种抗生素荧光光谱与五类抗生素荧光光谱中心光谱的欧氏距离, 计算欧氏距离的正态概率分布来划定抗生素识别范围, 依据待测样品与中心光谱的欧氏距离所属范围分辨不同种类抗生素。 结果表明, 在410~650 nm光谱范围内, 氧氟沙星、 土霉素和庆大霉素三种抗生素可以使用该方法进行分辨。 将光谱范围缩小至410~480 nm, 可以进一步实现对环丙沙星和诺氟沙星两种抗生素之间的分辨。 在含量检测方面, 对已有的几种不同浓度的样品进行检测分析后, 三种喹诺酮类抗生素的c-S拟合曲线在可用含量范围内可以很好的根据特征峰净峰面积计算对应含量。 土霉素和庆大霉素的特征荧光光谱强度受到其自身物理化学性质的影响, 在较广泛的浓度变化范围内无法建立比较准确的c-S拟合曲线, 需要根据实际情况缩小检测范围。 最后计算了该方法对几种抗生素检测的准确度和检出限, 结果表明, 建立的c-S定量曲线能够根据光谱信息基本准确地测量抗生素残留量, 说明该方法可以研究用来检测鸡蛋中的抗生素残留情况, 但相较于目前普遍采用的色谱和质谱法, 还存在检测限较高的问题, 需要更深一步的研究来降低检测限值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|