作者简介: 陈 鹏, 2000年生, 沈阳药科大学药学院硕士研究生 e-mail: chenpeng12431@163.com
卤酸脱卤酶能够降解对环境具有危害性的卤代羧酸类化合物, 并且其具有立体选择性, 可以拆分出纯手性的卤代羧酸, 在环境保护和化学合成领域具有潜在的应用价值。 建立卤酸脱卤酶活性的分析方法具有重要意义。 催化性能较好的卤酸脱卤酶DehE在弱碱性范围内(pH 8.00~9.50)能催化2-氯丙酸发生脱卤反应产生氢离子, 从而改变弱缓冲能力反应体系的pH, 而某些物质的荧光强度受溶液pH影响较大。 进行了荧光-pH指示剂的筛选, 并以此建立了基于荧光光谱法的卤酸脱卤酶活性全细胞检测方法。 结果表明: 筛选出的荧光-pH指示剂2-萘酚-6,8-二磺酸二钾能够灵敏地反映弱碱性范围内(pH 8.00~9.50)的pH变化。 所建方法在20 mmol·L-1的4-羟乙基哌嗪乙磺酸、 pH 8.50、 45 ℃、 45 mmol·L-1的2-氯丙酸条件下检测效果最好, 并且能避免假阳性结果的出现。 当被检测的菌液 OD600=2.0时, 15 min即可出现50%的荧光变化。 采用HPLC验证了方法的专属性。 该方法能够快速、 简单、 灵敏地在全细胞水平上检测卤酸脱卤酶活性。 当微生物含有卤酸脱卤酶的活性与DehE相当时, 所建立的方法对该微生物检测限为菌液 OD600=0.3, 具备对含有卤酸脱卤酶的微生物原位筛查分析潜力。
Haloacid dehalogenase can degrade halocarboxylic acids that are harmful to the environment. In addition, their stereoselectivity can produce pure chiral halocarboxylic acid. Therefore, haloacid dehalogenase has potential applications in environmental protection and chemical synthesis. It is of great significance to establish a method to detect the activity of haloacid dehalogenases. Haloacid dehalogenase DehE has good catalytic performance and can catalyze the dehalogenation of 2-chloropropionic acid to produce protons in the weak alkaline range (pH 8.00~9.50), changing the pH of the reaction system with weak buffering capacity. The HP of the solution greatly affects the fluorescence intensity of some substances. Based on this, the selected fluorescence pH indicator established an intact-cell detection method for haloacid dehalogenase activity. The results showed that the fluorescence pH indicator 2-naphthol-6,8-disulfonate could sensitively reflect the pH change in the weak alkaline range. The established method has the best detection effect under the condition of 20 mmol·L-1 HEPES, pH 8.50, 45 ℃ and 45 mmol·L-1 2-chloropropionic acid, avoiding the appearance of false positive results. A 50% fluorescence change was observed at 15 min with OD600 2.0 of the tested bacterial suspension. HPLC verified the specificity of method. The method can rapidly, and sensitively detect haloacid dehalogenase activity at the intact-cell level. In addition, when the activity of haloacid dehalogenases in the microbe is comparable to that of DehE, the detection limit of the established method for the microbe is OD600 0.3 of the bacterial suspension. In summary, this method has the potential for in situ qualitative screening and analysis of microorganisms containing haloacid dehalogenases.
卤代羧酸作为除草剂、 杀虫剂以及塑料制品的主要成分被广泛应用, 这类顽固污染物造成了严重的环境污染和生物体健康问题[1]。 卤酸脱卤酶作为脱卤酶家族中的一员, 可以低能耗、 高效率地催化卤代羧酸脱卤降解并产生质子, 在环境治理方面存在潜在价值。 卤酸脱卤酶具有立体选择性, 可从卤代羧酸中拆分出纯手性化合物[2, 3]。 该类纯手性卤代羧酸又可作为化学药品的合成中间体, 如纯手性的2-氯丙酸可用于合成心血管治疗药物左西孟旦[4], 故卤酸脱卤酶对于化学合成领域也具有应用价值[5]。 建立卤酸脱卤酶活性的检测方法具有重要意义。
传统的卤酸脱卤酶活性检测方法是采用色谱法检测底物或产物的变化, 费时费力; 随着光谱学的发展, 也有采用比色法检测卤离子的生成, 检测时间相对减少, 但仍较为耗时, 并且灵敏度不高, 所用试剂具有毒性[5]。 荧光光谱法具有较高的灵敏度、 较低的检测限[6]以及较强的抗干扰能力, 比较适合复杂样品的直接分析检测, 在酶活性检测和细胞分析领域应用广泛[7, 8], 目前已有采用荧光光谱法检测卤代烷脱卤酶活性的相关报道[10]。
已知的卤酸脱卤酶绝大部分是2-卤代羧酸脱卤酶系, 本研究以该酶系中催化性能较好的卤酸脱卤酶(DehE)为研究对象, 以通用底物2-氯丙酸为实验底物。 DehE能催化2-氯丙酸脱卤生成相应的乳酸并改变弱缓冲能力的反应体系的pH[11], 某些荧光物质的荧光强度受溶液pH影响。 本研究建立了基于荧光光谱法的卤酸脱卤酶活性全细胞检测方法, 并采用高效液相色谱(high performance liquid chromatography, HPLC)验证了方法的专属性。 该方法能够简单、 快速、 灵敏地在全细胞水平上检测卤酸脱卤酶活性, 为后续卤酸脱卤酶的分析研究以及从环境样品中原位分析含有卤酸脱卤酶的微生物、 发现新型卤酸脱卤酶提供了方法及思路。
卤酸脱卤酶DehE的重组大肠杆菌E.coli BL21(Pet22b+DehE), 委托生工生物工程股份有限公司进行全基因合成、 载体构建并成功表达, 由本实验室保藏; 正常大肠杆菌E.coli BL21, 由本实验室保藏。
2-萘酚-6, 8-二磺酸二钾(2-Naphthol-6, 8-disulfonate dipotassium, NDSDP)、 8-羟基芘-1, 3, 6-三磺酸三钠盐(8-Hydroxypyrene-1, 3, 6-trisulfonate sodium, HPTS), 4-羟乙基哌嗪乙磺酸(2-[4-(2-Hydroxyethyl)-1-piperazinyl] ethane sulfonic acid, HEPES)、 氢氧化钠、 2-氯丙酸(2-Chloropropionic acid, 2-CP)、 乳酸(Lactic acid, HL)、 磷酸二氢钾、 氯化钠均为分析纯试剂, 甲醇、 磷酸为色谱级试剂, 酵母提取物, 胰蛋白胨, 均购于上海泰坦科技股份有限公司; 实验用水为自制去离子水。
实验室pH计FE20, 梅特勒-托利多仪器有限公司; 恒温孵育摇床ES-60, 杭州米欧仪器有限公司; 电子天平ISO 9001, 北京赛多利斯仪器系统有限公司; 高速离心机TG16-WS, 上海卢湘仪离心机仪器有限公司; 恒温混匀仪VS-100C, 无锡沃信仪器制造有限公司; 立式高压蒸汽灭菌器LDZF-50L-Ⅱ , 上海申安医疗器械厂; 超微量紫外分光光度计NanoDrop one, 赛默飞世尔科技有限公司; 荧光分光光度计FL6500, 珀金埃尔默股份有限公司; 高效液相色谱仪Agilent 1260 Infinity Ⅱ , 安捷伦科技有限公司。
1.2.1 溶液配制
HEPES缓冲液: 称取HEPES固体2.3831 g溶于5 mL去离子水中, 配制终浓度为2 mol· L-1的HEPES储备液, 再取适量加入去离子水稀释, 并用4 mol· L-1的氢氧化钠溶液调节pH, 配制成不同pH(6.00~10.50)、 浓度为所需浓度的系列HEPES缓冲液。
2-CP溶液: 量取2-CP液体适量, 用HEPES缓冲液8 mL稀释, 并用4 mol· L-1的NaOH溶液调pH, 配制成pH与稀释用HEPES缓冲液的pH相同、 浓度为所需浓度的2-CP溶液。
LB培养基: 称取酵母提取物0.5 g, 氯化钠1.0 g, 胰蛋白胨1.0 g, 溶解于100 mL去离子水中, 用4 mol· L-1的氢氧化钠溶液调pH至中性, 在立式高压蒸汽灭菌器里以121 ℃高压蒸汽灭菌30 min后, 冷却备用。
1.2.2 全细胞菌体的培养及制备
从冻存管中取DehE重组大肠杆菌的甘油菌液100 μ L接种于含氨苄西林50 mg· L-1的5 mL LB培养基中, 置于恒温孵育摇床中在37 ℃、 200 r· min-1条件下培养过夜。 取该培养液以体积分数2%(v/v)接种于含氨苄西林50 mg· L-1的100 mL LB培养基, 在37 ℃、 200 r· min-1条件下培养至OD600(optical density at 600 nm)为0.6~1.0(大致培养2.5 h。 OD600为细菌混悬液在600 nm处的光密度, 由超微量紫外分光光度计测定, 一般表示细菌混悬液的细胞浓度)。 向培养基中加入诱导剂异丙基-β -D-硫代吡喃半乳糖苷0.011 9 g(终浓度为0.5 mmol· L-1), 在27 ℃、 200 r· min-1条件下诱导过夜, 在高速离心机中5 000 g离心5 min, 收集菌体, 用生理盐水重悬洗涤, 5 000 g离心5 min, 洗涤两次, 收集菌体, 于-20 ℃储存, 备用。
正常大肠杆菌E.coli BL21于LB培养基中培养, 除不加诱导剂外, 其余同法操作。
1.2.3 荧光-pH指示剂的pH敏感性测定
称取0.019 0 g的NDSDP固体(λ ex=365 nm, λ em=460 nm)和0.026 2 g的HPTS固体(λ ex=375 nm, λ em=512 nm)分别溶于10 mL去离子水中, 配制成终浓度均为5 mmol· L-1的储备液。 再分别取适量NDSDP、 HPTS储备液用不同pH的HEPES浓度为20 mmol· L-1的系列HEPES缓冲液稀释成终浓度分别为10和1 μmol· L-1的pH梯度溶液。 取各自的pH梯度溶液60 μ L, 用光路长为1 mm的石英比色皿在荧光分光光度计中进行荧光光谱扫描。
1.2.4 方法的可行性分析
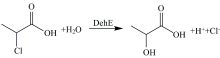
根据DehE能催化2-氯丙酸脱卤生成相应的乳酸并改变反应体系pH(图1)这一催化原理, 进行荧光检测。
分别取足量的DehE重组大肠杆菌和BL21正常大肠杆菌湿菌体, 用pH 8.25[9]、 20 mmol· L-1的HEPES缓冲液稀释至菌液OD600=2.0。 按表1添加试剂构建反应体系, 进行催化反应活性检测(菌体反应液OD600为1.0, NDSDP和2-CP的终浓度分别为10 μmol· L-1和30 mmol· L-1), 在恒温混匀仪中进行, 在30 ℃[4]、 800 r· min-1条件下反应, 按时取样60 μ L, 用光路长为1 mm的石英比色皿进行荧光光谱扫描(λ ex=365 nm, λ em=460 nm)。
| 表1 反应体系中的试剂用量 Table 1 The amount of reagent used in the reaction system |
1.2.5 荧光检测方法的条件优化
采用正交实验法, 根据可能影响荧光强度变化的条件, 选取反应体系中的HEPES浓度(A)、 pH(B)、 温度(C)、 2-CP浓度(D)为考察因素, 每因素4水平(表2)。 菌体反应液OD600恒定为1.0, 以15 min时DehE组与BL21组的荧光变化率ω 之差Δ ω 为考察指标, 以15 min时的BL21菌反应液的荧光变化率ω 为假阳性控制指标。 计算公式如式(1)和式(2)
式(1)和式(2)中, I0为0 min时荧光强度, It为15 min时的荧光强度。
| 表2 正交试验因素水平设计 Table 2 Factor level design of orthogonal experiment |
1.2.6 方法的专属性验证
根据反应前后底物2-CP以及产物HL量的变化, 采用HPLC对所建卤酸脱卤酶活性全细胞荧光检测方法的专属性进行验证。
色谱条件[11]: 色谱柱喆分Acutfex PW-C18(250× 4.6 mm, 5 μm); 流动相0.04 mol· L-1 KH2PO4-H3PO4缓冲液(pH 2.4)∶ 甲醇=95∶ 5; 流速0.8 mL· min-1; 柱温30 ℃; 检测波长214 nm。
对照品溶液的制备与检测: 吸取10 μ L的 HEPES储备液、 4.13 μ L的2-CP、 3.35 μ L的HL分别溶于1 mL的0.04 mol· L-1 KH2PO4-H3PO4缓冲液(pH 2.40), 制成各自的对照品溶液。 再取10 μ L的 HEPES储备液、 4.13 μ L的2-CP、 3.35 μ L的HL溶于1 mL的0.04 mol· L-1 KH2PO4-H3PO4缓冲一(pH 2.40), 制备混合对照品溶液。 均取适量溶液过0.22 μm的尼龙滤膜后进行HPLC检测。
菌体反应液的检测: 在反应体系中菌体OD600为1.0、 HEPES浓度20 mmol· L-1、 pH 8.50、 45 ℃、 2-CP浓度45 mmol· L-1条件下, 不加NDSDP反应1 h后以5 000 r· min-1离心5 min, 取上清液500 μ L, 加入甲醇500 μ L, 混合均匀后以5 010 r· min-1离心5 min, 取适量上清液过0.22 μm的尼龙滤膜后进行HPLC检测。
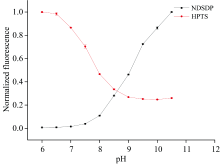
某些荧光物质分子、 离子间的平衡状态随溶液pH值发生改变, 进而导致其荧光强度亦发生变化, 可用作pH指示剂。 Nevolova等[9]筛选出了具有较强pH敏感性的荧光-pH指示剂HPTS。 本研究根据HPTS的化学结构, 选择了一种结构相似的荧光物质NDSDP。 二者的pH梯度荧光光谱如图2(a, b)所示, pH敏感性测定结果如图3所示。 NDSDP在卤酸脱卤酶活性良好的弱碱性范围(pH 8.0~9.5)内具有更强的pH敏感性, 并且容易获取, 成本低, 故选择NDSDP作为荧光-pH指示剂进行后续实验。
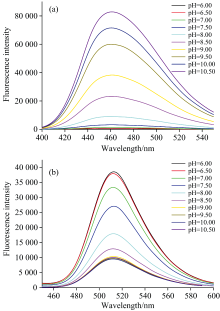 | 图2 (a) NDSDP的pH梯度荧光光谱(n=3); (b): HPTS的pH梯度荧光光谱(n=3)Fig.2 (a) pH gradient fluorescence spectra of NDSDP (n=3); (b) pH gradient fluorescence spectra of HPTS (n=3) |
选择2-卤代羧酸脱卤酶中研究较为广泛的DehE脱卤酶作为实验对象, 以通用底物2-CP为实验底物, 以无细胞毒性的HEPES溶液为缓冲体系进行实验。 由于2-CP为羧酸类化合物, 显酸性, 直接投入反应液中会影响反应, 所以在反应前先将2-CP经HEPES缓冲液稀释并调节pH。 将等pH值的HEPES缓冲液和2-CP溶液等量混合后pH值无变化, 故采取等量混合的方式进行实验。
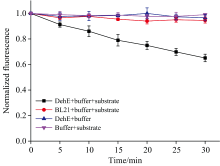
荧光检测结果如图4所示, 当反应体系仅有底物2-CP、 HEPES缓冲液以及NDSDP存在时, NDSDP的荧光值无明显变化, 表明底物自发反应引起的指示剂荧光强度减小可忽略不计, 反应体系保持稳定; 当反应体系仅有菌体、 HEPES缓冲液以及NDSDP存在时, NDSDP的荧光值无明显变化, 表明只有菌体存在时反应体系保持稳定; 当BL21菌体、 底物2-CP、 HEPES缓冲液以及NDSDP都存在时(BL21组), NDSDP的荧光值无明显变化, 表明没有DehE时, 该方法在此反应条件下不易出现假阳性结果对实验产生干扰; 当DehE菌体、 底物2-CP、 HEPES缓冲液以及NDSDP都存在时(DehE组), NDSDP的荧光值出现显著下降, 表明反应体系的pH降低, 发生了由卤酸脱卤酶DehE催化的2-CP脱卤反应。 因此, 建立的卤酸脱卤酶酶活性全细胞荧光检测方法是可行的。
由图4可知, 反应进行15 min时的DehE组的荧光强度降低了20%, 发生了明显变化, 因此以15 min时的DehE组和BL21组的荧光变化率ω 之差Δ ω 为考察指标; 同时为防止假阳性结果的出现, 设置15 min时的BL21组的荧光变化率ω 为假阳性控制指标。
正交试验的直观分析结果见表3。 Δ ω 的直观分析表明, 各因素作用的主次顺序为A> C> B> D, 即HEPES浓度为主要影响因素。 根据16组实验中ω BL21的计算结果, 并考虑到测量误差, 规定ω BL21高于5%± 1%, 即高于6%时, 为假阳性结果。 又因为16组实验中ω BL21> 6%的频率为25%, 所以规定某一水平下ω BL21> 6%的频率超过25%时, 认定为易出现假阳性结果, 须舍弃该水平。 在HEPES浓度因素里, k1> k2> k3> k4, 表明HEPES浓度越高, 缓冲能力越强, pH变化也就越困难, 但在A1水平下ω BL21> 6%的频率为75%, 即在A1水平下, 反应体系弱缓冲能力过弱, 易出现假阳性结果, 而在A2水平下ω BL21> 6%的频率为25%, 故舍弃A1, 最优水平为A2。 同理, pH最优水平为B3, 温度最优水平为C4, 2-CP浓度最优水平为D3。 综上所述, 所建方法最优条件为反应体系中HEPES浓度20 mmol· L-1、 pH 8.50、 2-CP浓度45 mmol· L-1, 温度有待进一步优化。
| 表3 条件优化的正交试验设计及结果(n=3) Table 3 Orthogonal experimental design and results of conditions optimization (n=3) |
在反应体系中菌体OD600=1.0、 20 mmol· L-1 HEPES、 pH 8.50、 45 mmol· L-1 2-CP条件下反应, 对温度因素设置40、 45和50 ℃三个水平分别进行荧光检测。 结果见表4, 表明温度越高, Δ ω 值越大, 但在50 ℃条件下ω BL21> 6%, 即易出现假阳性结果, 而45 ℃条件下ω BL21=6%, 故最优温度为45 ℃。
| 表4 温度因素优化结果(n=3) Table 4 Temperature optimization results (n=3) |
按照筛选出的最优条件, 在稀释菌液OD600=2.0(反应体系中菌体OD600=1.0)的条件下进行反应后检测, 结果如图5。 可以看出15 min时DehE组的荧光强度就下降了50%, 且BL21组的荧光强度无明显变化。
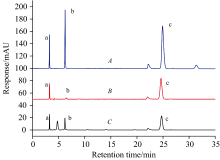
按照优化后的条件反应, 取样进行HPLC检测, 结果如图6所示。 可以看出: BL21组中, 由于底物自发的脱卤反应, 有极少量HL生成; DehE组中, 经DehE的催化, 有大量的HL生成, 同时对比BL21组, 也可以看出2-CP的减少。 因此, 经过HPLC的验证, 采用荧光光谱法的卤酸脱卤酶活性全细胞检测方法是可行的。
在优化后的条件下进行荧光检测, 设置稀释菌液OD600值为2.0、 1.0、 0.5、 0.4、 0.3分别进行反应, 以15 min时的荧光变化率ω 为考察指标, 结果见表5。
| 表5 检测限的测定结果(n=3) Table 5 The determination for limit of detection (n=3) |
将ω DehE作为检测信号, ω BL21作为噪音, 按照信噪比为3∶ 1计算检测限。 虽然OD600=0.3时信噪比为3.7, 仍大于3, 但考虑到检测误差, 将检测限设定偏高, 即该方法对DehE菌体检测限为菌液OD600=0.3。 由此可以推出结论: 当微生物含有的卤酸脱卤酶活性与DehE相当时, 所建立的方法对该微生物的检测限为菌液OD600=0.3。
研究建立的荧光分析法可快速、 简单、 灵敏地在全细胞水平上检测卤酸脱卤酶活性, 不仅可以定性评估酶活性, 在一定基础上还可以定量评估, 具有高通量筛选的潜力。 该方法在反应体系中HEPES浓度20 mmol· L-1、 pH 8.50、 45℃、 2-CP浓度45 mmol· L-1这一条件下检测效果最好, 可在15 min内完成检测, 并且能避免假阳性结果的出现。 同时, 该方法还可用于含有卤酸脱卤酶的微生物的发现及鉴定, 对于含有活性与DehE相当的卤酸脱卤酶的微生物, 该方法对其的检测限为菌液OD600=0.3, 可利用此方法开发出卤酸脱卤酶的原位分析方法, 直接从环境样品中原位筛查含卤酸脱卤酶的微生物。 该方法的研究思路也适用于在催化反应中引起质子形成或消耗的其他生物酶的活性分析。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|