作者简介: 刘 恒, 女, 1991年生, 浙江大学控制科学与工程学院博士研究生 e-mail: 12232037@zju.edu.cn;沈莉然, 女, 2001年生, 浙江大学控制科学与工程学院博士研究生 e-mail: 12332085@zju.edu.cn;刘 恒, 沈莉然: 并列第一作者
肿瘤的诊断与治疗一直以来都是医学界的热点研究领域。 太赫兹技术因其光子低能性、 无需标记、 高时间分辨率等特点, 在生物医学领域具有巨大的应用前景。 文章围绕太赫兹技术在肿瘤诊断与治疗领域的应用研究开展介绍, 在太赫兹肿瘤诊断方面, 主要基于太赫兹光谱技术和成像技术, 利用太赫兹光谱技术获取光谱特征信息, 并结合先进的模式识别和机器学习算法, 进行高维特征的提取与分析, 完成对肿瘤的检测与诊断, 太赫兹成像技术主要利用肿瘤细胞与组织之间的组分差异来实现对肿瘤的区分与鉴别。 首先从太赫兹技术在肿瘤诊断方面的研究进行介绍, 包括生物大分子、 细胞和组织三个维度。 生物大分子的研究重点是蛋白质、 核酸和糖类等肿瘤标志物。 细胞检测的研究进展重点针对肿瘤细胞的识别和血细胞的检测方面进行阐述。 在组织检测与诊断方面, 主要从成像与太赫兹时域光谱技术两个维度对多种癌症组织的检测与诊断进行了介绍。 基于太赫兹技术的肿瘤治疗研究方面, 主要从生物效应对肿瘤细胞进行消融和调控基因表达以改善人体机能的积极作用上实现对肿瘤的治疗。 最后讨论了太赫兹技术目前在生物医学应用中的局限性和未来展望, 为之后太赫兹在相关领域的研究提供思路。
LIU Heng and SHEN Li-ran: joint first authors
The diagnosis and treatment of tumors have been a hot medical research area for a long time. Terahertz technology has great potential for application in the biomedical field due to its low photon energy, label-free, and high temporal resolution. This paper introduces the application of terahertz technology in tumor diagnosis and treatment. Terahertz tumor diagnosis is mainly based on terahertz spectroscopy and imaging technology. By using terahertz spectroscopy to obtain spectral feature information, with the combination of advanced pattern recognition and machine learning algorithms to extract high-dimensional features, tumors can be detected and diagnosed. The imaging technique mostly utilizes the differences in components between tumor cells and tissues to distinguish and identify tumors. The research on terahertz technology in tumor diagnosis is first introduced in three dimensions: biomolecules, cells, and tissues. The research on biomolecules focuses on tumor markers such as proteins, nucleic acids, amino acids, and glycans. Advanced research in cellular detection focuses on identifying tumor cells and detecting blood cells. Regarding tissue, the detection and diagnosis of cancer tissues with different types is presented in two main dimensions: imaging and terahertz time-domain spectroscopy. The research on tumor therapy based on terahertz technology emphasizes the positive effects, including biological effects on ablation of tumor cells and modulation of gene expression to improve body functions. Finally, the current limitations and prospects of terahertz technology in biomedical applications are discussed to provide insights for future research on terahertz in related fields.
近年来, 癌症成为了我国居民死亡的主要原因之一[1, 2]。 早期诊断对于治疗癌症至关重要, 因为在癌症发展的早期阶段, 治疗的成功率更高。 大多数临床肿瘤诊断方法, 例如组织活检、 影像学检查等, 存在损伤较大、 耗时较长、 操作复杂的局限性。
太赫兹(Terahertz, THz)波位于毫米波和红外光之间, 频率位于0.1~10 THz。 由于太赫兹波光子能量低, 具有指纹特性、 无需标记等特点[1, 2, 3], 太赫兹技术在药品质量检测[3, 4, 5]、 公共安全[6]、 生物医学[6, 7]等方面均有应用, 特别在癌症检测诊断[8]领域具有非常广阔的前景。 目前, 太赫兹技术在肿瘤诊断与治疗领域的应用主要分为以下两个方面。 第一种是通过太赫兹光谱技术获得太赫兹特征光谱, 利用光谱信息对肿瘤标记物相关的生物分子、 细胞等进行检测。 同时可以通过太赫兹成像技术获取组织图像, 用以检测或鉴定正常组织和肿瘤组织之间的区别, 在临床医学上的应用具有巨大的潜力。 第二种是对太赫兹生物效应的应用研究, 主要研究太赫兹辐照下对生物系统的潜在危害, 同时探索并挖掘太赫兹在肿瘤治疗领域的巨大潜力。 本文主要综述了近五年太赫兹技术在肿瘤诊断与治疗方面的最新研究, 在肿瘤诊断方面, 结合太赫兹光谱和成像技术, 从与肿瘤标记物相关的生物大分子、 细胞以及生物组织三个方面展开介绍。 在肿瘤治疗方面, 结合太赫兹的生物效应与基因调控机理, 探索对肿瘤治疗的潜在应用, 为之后太赫兹在相关领域的研究提供思路。 文章结构如图1所示。
肿瘤标志物主要为蛋白质、 核酸和糖类等生物大分子[9], 由于大多数生物分子的骨架旋转与振动等低频运动在太赫兹频段, 可利用肿瘤标志物的独特光谱指纹特性对生物大分子进行检测与定量分析, 从而实现肿瘤的诊断。 因此, 基于上述特性, 太赫兹光谱技术在检测生物大分子方面具有独特的优势。
蛋白质(protein)是维持生物正常生命活动的重要基础, 许多与肿瘤相关的标志物如激素、 抗体等都是蛋白质[10], 因此, 国内外学者基于太赫兹技术对蛋白质展开了深入的研究, 而对蛋白质的检测与分析主要采用太赫兹时域光谱技术。
Huang等[11]应用太赫兹时域衰减全反射(THz-ATR)技术检测不同浓度梯度下的糖蛋白溶液, 并结合复合多尺度熵(CMSE)方法通过K-means算法进行聚类, 发现吸收系数与浓度之间存在显著的非线性关系, 该研究表明, CMSE方法对糖蛋白太赫兹光谱分析具有重要的指导意义, 在医学应用中使用太赫兹技术识别相关肿瘤标记物具有一定的潜力。 Lin等[12]设计了一种由四个开口谐振环组成的超材料生物传感器, 用于检测高度糖基化的蛋白质— 癌胚抗原(CEA), 这项研究为太赫兹在对生物分子、 癌症生物标志物的高灵敏检测以及免疫反应上的应用开辟了一条新途径。 Zeng等[13]设计了一种适配体修饰的太赫兹超材料生物传感器来检测人类表皮生长因子受体HER2(糖蛋白)的特异性, 该传感器是由两个金属开口谐振环组成的阵列结构, 通过太赫兹时域光谱技术对其进行表征, 形成了两个灵敏度为108 GHz· RIU-1的谐振峰, 在对HER2的检测中具有更高的灵敏度和更低的检测限, 这为太赫兹在癌症生物标志物和其他生物分子的特异性检测方面奠定了基础, 并可应用于各类癌症的早期诊断。 Lin等[14]提出了一种与金纳米颗粒(AuNP)耦合的太赫兹(THz)电磁超材料免疫传感器, 通过高比表面积提供更多的生物标志物反应位点的同时增加了材料的生物相容性, 并利用太赫兹时域光谱系统对不同浓度的癌症生物标志物— 糖类抗原CA199和CA125进行了检测, 实验结果表明共振峰的频移与CA125和CA199的浓度呈线性关系, 为提高癌症生物标志物的敏感性和特异性提供了重要的设计思路, 可用于生物标志物浓度检测和疾病的早期诊断。 Li等[15]提出了一种使用太赫兹超材料生物传感器诊断肝硬化和肝细胞癌(HCC)的方法, 该生物传感器具有约0.801 THz的共振频率, 并且可以测量血清中甲胎蛋白(AFP)的浓度。 实验结果表明, 在肝癌患者中, 生物传感器的频率偏移和AFP的血清水平之间存在正相关关系, 这开拓了太赫兹在肝硬化和肝癌的快速诊断与预测方向上的全新应用。 Xue等[16]利用太赫兹时域光谱实现了对尿蛋白的定性检测, 且不受pH值的影响, 该结果表明太赫兹光谱技术对肾脏疾病的诊断具有重要意义。
肿瘤的发生与发展与核酸关系密切[17], 核酸由脱氧核糖核酸(DNA)与核糖核酸(RNA)组成, 利用太赫兹光谱技术能够灵敏地检测核酸中的配对氢键与非共价键之间的作用。
 | 图2 血清透射光谱 (a): 四种AFP浓度小于7 ng· mL-1健康血清样品的透射光谱; (b): 9种AFP浓度超过7 ng· mL-1 的透射光谱[15]Fig.2 Transmission spectra of serum samples (a): Transmission spectra of four healthy serum samples with AFP concentration less than 7 ng· mL-1; (b): Transmission spectra of nine patient′s serum samples with AFP concentration more than 7 ng· mL-1[15] |
Cheon及其同事[18]使用太赫兹光谱技术观测到了癌症细胞系基因组DNA水溶液的分子共振现象, 并在血癌细胞系中检测DNA甲基化程度, 发现甲基化DNA在1.7 THz的频率下发生共振, 这为太赫兹对不同类型癌细胞的DNA甲基化程度的识别奠定了基础, 证明太赫兹在癌症的早期筛选方面具有巨大的应用前景。 而Yu等[19]利用太赫兹时域光谱技术将五个典型的DNA/RNA核碱基的有效太赫兹吸收光谱进行表征, 建立了这些核碱基的指纹图谱, 有助于进一步分析DNA/RNA生物大分子内部的振动行为, 并为太赫兹在DNA/RNA的识别方面奠定了基础。 汤明杰等[20]采用太赫兹时域光谱技术(THz-TDS)检测了DNA、 RNA碱基和稀有碱基的太赫兹光谱, 这7种碱基在0.2~2.0 THz频段内的特征吸收峰和吸收强度差异显著, 但这些碱基在拉曼光谱中的特征峰杂而多, 不能实现多种碱基的识别, 同时其吸收强度受粉末厚度、 粒度和光聚焦深度等多种因素的影响。 这说明THz-TDS技术在核酸识别与检测方面有优于拉曼光谱的优势。 Zhan等[21]设计了一种由环形凹槽围绕的金(Au)盘阵列组成的太赫兹超材料生物传感器, 实现了对胰腺癌和正常的临床血浆样本中外泌体microRNA的高特异性和高灵敏度检测, 这说明太赫兹超材料的生物传感器平台在早期癌症诊断和监测上应用的可能性。 Fang等[22]发现通过特殊的指数扩增反应可以增强循环肿瘤DNA在太赫兹光谱下的特异性并提高灵敏度, 实验结果表明这种方法在快速诊断和监测各种恶性肿瘤方面具有巨大潜力。
 | 图3 太赫兹时域光谱下的反射系数 (a)不同样品的THz测量; 空白超材料: 仅含超材料; 链霉亲和素功能化超材料: 链霉亲和素功能化超材料; 空白对照: 不含miRNA的缓冲液; (b): 不同浓度miRNA检测的THz反射[21]Fig.3 Reflection coefficient in terahertz time-domain spectrum (a): THz measurements of different samples; Bare MM: bare metamaterials; SA-functionalized MM: SA-functionalized metamaterials; Blank Control: buffer without miR-21; (b): THz reflections for miR-21 detection of different concentrations[20] |
快速生长的恶性肿瘤细胞的葡萄糖摄取和糖酵解速率通常高于其来源的正常组织, 所以对糖类的研究有着重要意义。 Chen等[23]通过对不同人体血液的葡萄糖含量进行定量分析, 研究结果表明血液中葡萄糖的吸收系数在太赫兹波段具有高度敏感性, 进一步证明在临床实践中太赫兹技术应用于诊断血糖水平方面有很大的潜力。 陈涛等[24]应用太赫兹时域光谱(THz-TDS)技术结合密度泛函理论(DFT)对结构相似的单糖与二糖物质在太赫兹波段的吸收光谱进行了实验与理论模拟研究, 虽然这两种糖类分子结构非常相似, 但太赫兹波对它们之间的结构差异十分敏感, 这为THz-TDS技术结合DFT方法对糖类物质进行检测识别以及研究糖类分子间的相互作用提供了有价值的实验和理论参考。 Zhou等[25]利用THz衰减全反射(THz-ATR)光谱, 用以探测无标记智能水凝胶的葡萄糖诱导水合状态变化以及选择性检测葡萄糖水溶液, 实验结果表明葡萄糖水溶液的吸收系数随着含水率的增加而明显增加, 这为智能水凝胶的水合状态提供了一种高灵敏度、 强选择性和可重复性的有效检测方法。
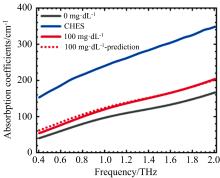 | 图4 基于双组分模型的智能水凝胶在100 mg· dL-1葡萄糖水溶液下的预测吸收曲线(红色虚线)与CHES缓冲液(蓝色实线)和智能水凝胶在0 mg· dL-1(黑色实线)和100 mg· dL-1(红色实线)葡萄糖水溶液时的测量吸收曲线之间的比较[25]Fig.4 Comparison between the predicted absorption curves (red dotted line) of the smart hydrogel at 100 mg· dL-1 aqueous glucose based on the two-component model and the measured absorption curves of CHES buffer (blue solid line) and the smart hydrogel at 0 mg· dL-1 (black solid line) and 100 mg· dL-1 (red solid line) aqueous glucose[25] |
由于太赫兹的非侵入、 无标记等特性, 其在细胞检测和鉴定方面的应用显示出巨大的潜力。 在细胞检测中, 太赫兹技术主要应用于肿瘤诊断, 并在肿瘤细胞的鉴定和血细胞的检测两个方面有了较大发展[26], 且在细胞检测中多采用太赫兹时域光谱技术。
Hassan等[27]在有血液和血清干扰的基础上以诱导体作为配体, 利用太赫兹(THz)化学显微镜(TCM)实现了对转移性乳腺癌细胞的高灵敏度检测, 证明太赫兹技术可以成为检测转移性乳腺癌细胞的有力工具。 Yoshida团队[28]使用阿维菌素-生物素反应测量溶液中的肺癌细胞, 结合在传感板上的高密度固定, 并通过太赫兹化学显微镜中太赫兹信号强度来检测肺癌细胞的浓度, 结果表明太赫兹技术有望成为癌症诊断中液体活检的最佳选择。 Zhu等[29]设计了一种能将循环肿瘤细胞(CTC)与红细胞分离的微流控装置, 并结合捕获区的开口谐振环形成共振实现对循环肿瘤细胞的高灵敏度检测, 这项工作为太赫兹超材料用于癌症诊断和治疗奠定了基础。 Shi等[30]开发了基于倾斜的波前光栅脉冲技术, 用于微量活体宫颈癌细胞的太赫兹检测, 实现了对活体Hela细胞的瞬时检测, 结果表明宫颈癌细胞的吸光度与细胞浓度成正比, 这也进一步证明了太赫兹技术在细胞浓度定量分析方面具有一定的优势。 Yang等[31]利用太赫兹与微流控技术结合, 研发了单细胞层的微流控装置, 并利用基于径向基核函数的主成分分析(PCA)-支持向量机(SVM)模型识别不同宫颈癌类型的活细胞, 实验结果表明在太赫兹波段可以区分健康人和癌症患者的样本, 在诊断早期宫颈癌方面有很大的潜力。 Nourinovin团队[32]通过培养口腔鳞状癌细胞(OSCC)的3D器官模型, 研究肿瘤在各个阶段的太赫兹光谱以及抗癌药物AG1478对其太赫兹光谱的影响。 结果表明, 虽然AG1478使太赫兹光谱向正常组织方向移动, 但在相同情况下对侵袭性OSCC没有影响, 这些发现有助于太赫兹技术应用于早期肿瘤诊断和检测。
在早期癌症中, 血液中的血细胞成分会发生阶段性显著变化, 因此血细胞检测对于包括血液肿瘤、 甲状腺肿瘤等癌症在内的综合诊断具有非常重要的意义。 Smolyanskaya等[33]根据现阶段动物和人类全血的太赫兹光谱以及获得的数据, 发现红细胞和血小板等形成的血液元素对血液吸收起主要作用, 这为太赫兹光谱在血细胞定性检测奠定了基础。 Konnikova等[34]利用太赫兹光谱技术对健康个体、 良性和恶性肿瘤患者的血浆样本进行检测, 以此检测恶性甲状腺结节, 试验结果表明THz-TDS对血液细胞的成分变化较敏感, 可依此诊断甲状腺结节的恶性程度。 Kruchinina团队[35]通过探索太赫兹光谱与介电电泳特性之间的联系, 对弥漫性肝病患者的红细胞进行研究, 以对肝脏纤维化程度进行诊断与区分, 发掘了太赫兹光谱技术在血液及细胞成分定量分析方面具有一定的优势。 而Kumar团队[36]结合太赫兹与光子晶体光纤技术, 实现了对葡萄糖、 血浆、 白细胞和红细胞的高灵敏度检测, 为太赫兹在人体血液成分检测提供了新的思路与方法。
 | 图5 (a)空白玻片和在盖玻片上生长的不同浓度HeLa活细胞的太赫兹时域波形; (b)空白玻片和在盖玻片上生长的不同浓度HeLa活细胞的太赫兹频域波形[30]Fig.5 (a) Terahertz Time-domain waveforms of empty slides and different concentrations of HeLa living cells grow on cover glass; (b) Terahertz Frequency-domain waveforms of empuy slides and different concentrations of living HeLa cells grow on cover glass[30] |
由于太赫兹对极性分子的吸收比较敏感, 生物组织的吸收系数和折射率等光学特征参数随着其含水量的不同也有所区分, 因此通过太赫兹技术检测正常组织和肿瘤组织之间的组成成分区别, 对于生物组织的检测具有重要的发展潜力[37]。
在太赫兹时域光谱技术方面, Li等[38]采用透射式太赫兹时域光谱系统对含有黑色素瘤的BALB/c小鼠皮肤组织切片进行成像。 如图7(a)和(b)所示, 由于黑色素瘤具有比皮肤组织正常区域更高的折射率和吸收系数, 因此在0.6~1.8 THz的频率范围内黑色素瘤能被识别出来。 Grigorev等[39]在反射模式下使用太赫兹时域光谱技术对各种正常和癌症新鲜胃组织进行研究, 在0.2~1 THz频率范围内, 可清楚地观察到癌症组织和正常组织之间的差异。 Liu等[40]研究了一种基于透射式太赫兹光谱技术和机器学习分类器的乳腺浸润性导管癌(IDC)太赫兹脉冲信号自动识别策略, 提出了区分不同组织的能量香农熵比指标(ESER), 并采用主成分分析法和机器学习分类器对乳腺IDC的太赫兹信号进行分类。 结果表明, 集成分类器具有最佳的乳腺IDC识别性能, 结合机器学习方法可提高太赫兹识别性能, 准确率可达到92.85%。 Cassar等[41]研究了将折射率和形态学膨胀相结合, 以提高保乳手术中乳腺肿瘤边缘勾画的性能, 采用形态学膨胀法结合屈光度阈值将组织区域分为恶性和良性。 该研究采用形态学膨胀法结合折射率法进行组织分类, 相比于其他构型, 宽结构元素和高折射率的组合, 提高了组织分类的正确性。 Chen等[42]使用小鼠模型探索了太赫兹技术进行快速组织病理学诊断, 该研究表明, 太赫兹光谱法可有效地将结肠炎相关癌症与正常组织区分开来。
 | 图7 正常区域(黑色曲线)和黑色素瘤区域(红色曲线)在0.6~1.8 THz频率范围内的(a)折射率和(b)吸收系数[38]Fig.7 (a) The refractive index and (b) the absorption coefficient for the normal region (black curve) and the melanoma region (red curve) in the frequency range of 0.6~1.8 THz[38] |
在太赫兹成像技术方面, Doradla等[43]开发了一种柔性太赫兹内窥镜, 作为辅助结直肠癌筛查的潜在工具, 包括构建单通道太赫兹内窥镜, 分析结直肠组织的太赫兹响应, 并在反射模式成像时显示正常和病变组织之间的内源性对比度。 Cassar等[44]研究太赫兹成像在300~600 GHz范围内用于乳腺组织识别的潜力, 并且证明含有恶性细胞的组织基质比含有健康组织的组织基质具有更高的平均折射率趋势, 在图像上确定的肿瘤区域与组织学切片具有很好的一致性。 El-Shenawee等[45]表明了利用太赫兹成像和光谱技术可在切除的乳腺肿瘤中检测癌变组织, 脱水组织和新鲜切除组织的太赫兹图像在健康组织和癌变组织之间都显示出良好的对比度。 Wu等[46]研究了一种水平扫描太赫兹连续波ATR成像系统, 通过优化ATR棱镜, 可以很好地避免二次反射的影响。 该成像系统可以清晰地从正常脑组织中区分出不同大小的小鼠脑组织U87-胶质瘤区域和相对较大的大鼠脑组织C6 -胶质瘤区域。 如图8所示, 在太赫兹图像中, 肿瘤区域与正常区域可以明显区分, 且癌变脑组织的太赫兹信号强度低于正常脑组织, 并且THz图像中的肿瘤区域, 与对应的肉眼观察以及H& E染色图像中的肿瘤区域相似。 Yang等[47]研制了一种无标记实时高分辨率近场太赫兹光谱成像系统, 实验结果表明, 该系统不仅可以清晰地检测和识别不同成分的生物组织, 还可以清晰地检测和识别正常和癌变组织, 以及组成相同但切片方向不同的组织, 这项工作为太赫兹光谱成像在术中快速无标记诊断中的应用奠定了实验基础。
太赫兹的生物效应可导致肿瘤细胞凋亡或肿瘤组织消融, 主要包括热效应和非热效应。 热效应可以引起局部的温度升高, 对肿瘤组织产生热损伤, 从而达到治疗效果。 而非热效应通过影响细胞膜的改变、 离子通道的打开或关闭、 诱导肿瘤细胞凋亡以及影响其迁移和侵袭能力, 最终影响肿瘤细胞的生存和增殖。 因此国内外许多学者探索太赫兹技术在肿瘤治疗方面的潜在应用[48]。 Borovkova等[49]使用连续波太赫兹辐射源产生的热效应实现了白鼠肿瘤组织的消融。 实验结果表明, 白鼠的肿瘤组织在THz辐射下渐渐变小, 直至消失。 周俊团队[50]基于自由电子激光装置产生的太赫兹辐射源研究了非热效应对肿瘤的消融效果。 实验过程中避免因温度上升的热效应对肿瘤产生的影响, 控制其辐射的脉冲重复周期为1 s, 结果表明强场的脉冲太赫兹可对肿瘤细胞实现非热效应的消融效果。
太赫兹可以对分子, 特别是在脱氧核糖核酸(DNA)中氢键产生线性或非线性的共振效应进一步导致基因表达的改变[51]。 由于血液癌细胞的甲基化DNA共振效应位于THz频率范围, 而一定能量的太赫兹可以破环分子中的DNA键从而降低其甲基化程度, 通过基因调控实现对肿瘤的治疗[52]。 因此, Cheon等[18]利用高能量的太赫兹波对血液癌细胞进行一定时间的辐照, 通过激发共振实现了一定程度的DNA去甲基化。 在随后的研究中, 而Cheon等[53]使用同样频率的高能量太赫兹波对黑色素瘤细胞进行辐照实现了其10%~15%的去甲基化, 证明了太赫兹辐射可能作为表观遗传抑制剂在癌症治疗中具有潜在的应用价值。 Angelina[54]发现高功率的太赫兹脉冲对人类皮肤组织基因的表达水平产生一定程度的积极影响, 这表明通过THz调节细胞活性治疗皮肤相关癌症具有一定的可行性。 胡卓瑶等[55]利用不同功率的太赫兹波实现了对脑神经受损害的大鼠进行干预治疗, 通过观察实验组与对照组的行为差异, 从海马神经元损害程度、 血管内皮生长因子蛋白表达水平和微血管密度等多个方面对其治疗效果进行评估, 实验表明太赫兹辐照可通过调控基因表达改善脑神经的修复, 并且可以通过对蛋白质表达实现对神经系统方面的肿瘤治疗。 Sitnikov等[56]获得了高强度太赫兹辐射影响人类直接重编程神经祖细胞和神经母细胞瘤细胞的数据, 建立了化疗药物和其他辐照参数对神经瘤细胞基因调控的关系, 未来可将其融入到抗肿瘤临床实践和提高现有疗效的应用中。
尽管近年来太赫兹技术在生物医学检测领域取得了很大进展, 但针对临床肿瘤诊断与治疗应用还存在局限。 (1)首先, 由于极性分子在太赫兹辐射的强吸收性, 太赫兹技术在生物检测方面具有优势。 但同时, 由于生物组织中往往含水量高, THz信号衰减明显。 为减少水对检测的干扰, 可以通过微流控和纳米流控装置来减小水分对信号的衰减和吸收, 同时ATR模式的太赫兹光谱也可以减少极性分子带来的干扰[57]。 (2)目前研究多集中于利用太赫兹技术进行癌变组织的识别, 但是对于早期炎症组织研究的报道不多。 未来在肿瘤检测中太赫兹技术不仅能够识别癌变和正常组织, 并且可以对慢性炎症进行检测与识别, 为癌症早筛提供高灵敏度的检测方法与手段。 (3)考虑到太赫兹检测在生物医学方面的应用存在环境、 仪器的背景噪声干扰以及复杂生物组织的影响, 需要引入先进信号处理方法如深度学习[58]来提高检测的准确性和可靠性。 (4)太赫兹光谱和成像技术在肿瘤诊断应用中存在包括穿透深度、 对比度和灵敏度在内的缺陷, 通过设计合理的超材料结构与选择合适的材料, 并与不同分析物形成精确的频率共振峰, 以增强太赫兹信号的敏感度和分辨率, 从而提高太赫兹在肿瘤检测方面的灵敏度和特异性。 (5)太赫兹系统的成本较高, 是影响太赫兹实际应用的一个关键问题, 随着进一步的开发研究以及物理学、 材料学的发展, 硬件成本将进一步降低。 此外, 随着太赫兹的应用领域的拓展, 太赫兹系统的需求自然会增加, 使得太赫兹系统的成本降低[59, 60] 。 (6)目前大部分太赫兹技术的应用仍处于实验阶段, 未来需要建立系列化的太赫兹技术标准, 并需要更多的临床验证来证明其在实际肿瘤诊断与治疗中的有效性和安全性。
近十几年来, 生物医学方向太赫兹研究的发文量显著增加, 国内外研究团队开展了大量相关领域研究。 本文介绍了太赫兹技术目前在肿瘤诊断与治疗方面的研究进展: 利用太赫兹技术对肿瘤标志物蛋白质、 DNA等生物大分子进行检测和识别, 并在肿瘤组织的分类和鉴定中起重要作用, 有望在未来可以作为临床癌症诊断的一种重要的有效手段。 此外, 太赫兹技术在肿瘤治疗领域也具有潜在的应用前景。 尽管太赫兹成像和光谱学在生物医学中的应用很有吸引力, 但该技术仍有一些需要考虑的缺陷。 随着太赫兹技术的发展, 其在肿瘤诊断与治疗方面的应用必将取得巨大突破, 为人类健康做出更大贡献。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|







