作者简介: 唐 妍, 女, 1999年生, 西南科技大学环境友好能源材料国家重点实验室硕士研究生 e-mail: 1668415858@qq.com;吴 佳, 女, 1999年生, 西南科技大学环境友好能源材料国家重点实验室硕士研究生 e-mail: 1797809956@qq.com;唐 妍, 吴 佳: 并列第一作者
氨基酸作为组成蛋白质的基本结构单元在生物体中起着重要作用。 不同的基团组成和手性结构所代表的功能均有差异, 因此甄别其基本化学结构和分子振动信息将为构建基础生物分子光谱与结构相关性模型提供重要的理论依据。 近红外光谱主要展示各类含氢基团(如O—H、 N—H和C—H等) 的倍频和合频振动信息; 振动信息比较复杂, 加上常规红外光谱仪器分辨率限制等原因, 导致实验测得的谱带变宽, 无法准确对其振动模式进行指认, 分析较为困难。 理论计算可以对每个振动模式进行独立计算, 能够提供更清晰的光谱信息, 进而对实验得到的宽谱带进行解析, 使其更易甄别和分析不同分子体系的各类基团的结构振动信息。 采用非谐振DFT方法对氨基酸(谷氨酸、 半胱氨酸、 甘氨酸)及由此三种氨基酸组成的多肽(谷胱甘肽)进行结构优化和非谐振振动分析, 计算得到四种分子7 500~4 500 cm-1波段内的高精度NIR光谱, 并对它们的谱图进行了详细的振动峰位指认。 以振动强度作为标准, 将整个近红外波段分为三个光谱区探究分子结构和组成基团对光谱特征的影响, 对计算光谱进行了详细的分析并且建立了光谱与结构间的对应关系。 该研究为更深的理解氨基酸及多肽的结构性质提供了思路。
TANG Yan and WU Jia: joint first authors
Amino acids play an important role in organisms as the basic building blocks of proteins. The functions of amino acids with different group compositions and chiral structures are different, showing an urgent requirement to identify the basic chemical structure and molecular vibration information. This will provide an important theoretical basis for constructing basic biomolecule spectra and structural correlation models. NIR spectrum mainly shows the first overtone and binary combination vibration information of various hydrogen-containing groups (such as O—H, N—H, C—H, etc.). The vibration information is relatively complex, coupled with the resolution limitations of conventional infrared spectroscopy instruments and other reasons, resulting in a spectrum of experimental results. The band becomes wider, and its vibration mode cannot be accurately identified, making analysis more difficult. The theoretical calculation can independently calculate each vibration mode, providing clearer spectral information, and then analyze the wide absorption band obtained experimentally. This makes it easier to identify and analyze the structural vibration information of various groups in different molecular systems. In this work, the DFT calculation method carried out the structure optimization and anharmonic vibration analysis of three amino acids (glutamic acid, cysteine, glycine) and polypeptide (glutathione) composed of these three amino acids. The high-precision NIR spectrum of the four molecules in the band of 7 500~4 500 cm-1 was calculated, and detailed band assignments were made, dividing the entire near-infrared band into three spectral regions dependent on the vibration intensity. Furthermore, the influence of structure and constituent groups on the spectral characteristics was explored, and the corresponding relationships between the spectra and the structure were established. Our research would provide ideas for a deeper understanding of the structural properties of amino acids and peptides.
常见的生物分子中, 氨基酸[1, 2]作为组成蛋白质的基本结构单元, 不同的基团组成和手性结构所代表的功能均有差异。 生物分子大多数骨架振动信息复杂, 相互重叠, 目前主要采用近中红外光谱对其结构和振动信息进行甄别和分析[3, 4, 5, 6]。 中红外光谱(MIR)[7, 8]范围内各光谱峰存在大量重叠现象, 难以准确分析氨基酸的振动信息。 近红外光谱(NIR)[9, 10, 11]是指12 500~4 000 cm-1范围内的低能振动光谱, 主要展示各类含氢的基团(如O— H、 N— H和C— H等) 的倍频和合频振动信息。 实验观察到的特征振动峰相互重叠严重, 以及由于仪器分辨率等原因导致谱带变宽, 无法准确辨认, 分析起来较为困难。 理论计算可以对每个振动模式进行独立计算, 提供更清晰的光谱信息, 进而对实验看到的宽吸收带进行解析, 使其更易甄别和分析不同分子体系的各类基团的结构振动信息。 因此在分析带有含氢基团的各类生物有机体系时, NIR光谱技术作为展现此类分子的结构信息[12, 13, 14]和物理化学性质[15, 16]的重要手段, 在探究生物分子光谱与结构相关性的研究领域有着广泛的应用前景。
随着量子化学计算方法的发展, 越来越多的研究人员开始利用理论计算方法对振动光谱进行仿真研究。 通过这些方法, 可以计算分子的振动频率、 振动模式和红外光谱等信息, 从而提供了一种高效且准确的手段来解释和理解实验观测到的光谱数据。 Kumar和Ramkumaar[17, 18]等使用密度泛函理论(DFT)方法, 对甘氨酸二聚体和谷氨酸等物质的振动光谱(包括红外光谱和拉曼光谱)以及氢键对振动频率的影响进行了理论研究, 并通过量子化学方法对实验结果进行了振动模式解析。 近年来随着研究者们对NIR理论的深入研究和近红外光谱仪的发展, NIR广泛应用于医药[19, 20, 21]、 环境[22, 23]和食品[19, 24, 25]等领域。 然而由于实验条件和仪器的限制, 以及某些基团的振动信息受环境因素影响较大, 实验测得某些体系的NIR谱图精度较差, 无法准确的给出测定对象的所有振动信息。 因此, 通过量子化学方法进行NIR光谱的理论研究变得尤为重要。 随着DFT[26, 27, 28, 29, 30]理论的发展, 对计算有机体系的能量和分析各类分子物理化学性质方面的应用越来越广泛。 对NIR的理论研究呈指数增长, 氢键效应[31, 32, 33]、 溶剂效应[34-35]、 构象异构[31, 36, 37, 38]及不同样品状态[39]等各类因素对分子近红外光谱的影响进行了广泛且深入的研究。 在计算方法选择上, 广义二阶微扰理论(GVPT2)[40]在计算分子非谐振动合频和倍频的频率和强度方面具有高效性和精度的特点。 Grabska、 Bec[39, 41, 42]等利用GVPT2方法对饱和及不饱和脂肪酸、 醇类、 酚类等物质进行了NIR区域的非谐振动研究, 验证了该方法的准确性。 通过NIR的理论模拟计算可以得到更精准的基团振动一级倍频和二元合频信息, 从而更深入地探索分子结构变化对各基团吸收峰产生偏移的原因。
以谷氨酸、 半胱氨酸、 甘氨酸和谷胱甘肽为研究对象, 三种氨基酸主体结构相似, 属于同一类型的化合物。 通过GVPT2进行非简谐振动分析, 得到其NIR光谱。 四种化合物在大多数生物体中都存在, 是光谱研究的重点。 通过比较它们NIR光谱的差异, 可以探究组成氨基酸的其余基团对NIR光谱的吸收峰产生偏移的原因, 以及分析氨基酸整体结构差异对NIR光谱的影响。 比较氨基酸与谷胱甘肽的NIR光谱, 可以分析缩合过程如何影响生物分子的振动模式。 通过对三种氨基酸和谷胱甘肽的NIR光谱的研究, 有利于更深入地了解生物分子, 并且进一步探究如蛋白质类生物大分子的结构信息, 为复杂生物大分子的研究提供了新的思路和方法。
谷氨酸、 半胱氨酸、 甘氨酸和谷胱甘肽的初始结构信息取自pubchem数据库, 采用DFT对四种分子进行结构优化和(非)谐振动分析。 DFT的计算是通过B3LYP/def2-TZVP[43, 44]和带有BeckE-Johnson阻尼的Grimme's D3经验色散函数(GD3BJ)[45]来实现的。 优化后的各收敛限度为: 力的最大值(Maximum Force)≤ 0.000 45 hartrees· bohr-1; 均方根(RMS Force)≤ 0.000 3 hartrees· bohr-1; 最大位移(Max. Displacement)≤ 0.001 8 hartrees· bohr-1; 均方根位移(RMS Displacement)≤ 0.001 2 hartrees· bohr-1, 最终结果无虚频表示此结构为分子的稳定态。 在此基础上引入GVPT2对研究对象进行NIR区域的低能振动计算, 获得NIR区域的非谐振光谱。 双电子积分及其导数计算方法积分网格的设置为超细网格。 所有量子化学计算都在Gaussian 16 Rev. A. 03软件[46]中进行。 对计算结果进行波函数分析[47], 绘制分子前线轨道和弱相互作用等值面图[48, 49]。
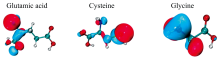
三种氨基酸经DFT进行优化, 结构如图2所示, 结构优化后的理论键长和键角与实验值[50, 51, 52, 53]在表1— 表4中给出。 计算了均方根偏差(RMSD), 键长值为0.012 8~0.035 4 Å , 最大键角为5.231 6° , 结果表明理论结构与实验值吻合。 三种氨基酸都是极性α -氨基酸。 谷氨酸被用作必要氨基酸的重要来源, 含有两个羧基(— COOH)一个氨基(— NH2), 在三种氨基酸中拥有最多碳原子, 两个亚甲基(— CH2)和一个次甲基(— CH); 半胱氨酸有助于减少黑色素的生成, 除了— COOH和— NH2外还有一个巯基(— SH), 此外比谷氨酸少一个— CH2; 甘氨酸在中枢神经系统中起着递质的作用, 分子链最短, 除— COOH和— NH2外只有一个— CH2; 谷胱甘肽可作抗氧化剂, 在组成谷胱甘肽时, 半胱氨酸的— NH2和谷氨酸未与α 碳原子相连的— COOH脱去一分子H2O形成酰胺键(肽键), — COOH与甘氨酸的— NH2以同样的方式脱水缩合, 肽键将三种氨基酸连接起来。
 | 图2 谷氨酸、 半胱氨酸、 甘氨酸和谷胱甘肽采用DFT优化的结构图 青色为碳, 红色为氧, 蓝色为氮, 白色为氢Fig.2 Optimized structures of glutamate, cysteine, glycine, and glutathione using DFT |
| 表1 谷氨酸的近红外光谱谱带及主要基团振动模式 Table 1 NIR spectral bands and main group vibration modes of glutamic acid |
| 表2 半胱氨酸的近红外光谱谱带及主要基团振动模式 Table 2 NIR spectral bands and major group vibration modes of cysteine |
| 表3 甘氨酸的近红外光谱谱带及主要基团振动模式 Table 3 NIR spectral bands and main group vibration modes of glycine |
| 表4 谷胱甘肽的近红外光谱谱带及主要基团振动模式 Table 4 NIR spectral bands and major group vibration modes of glutathione |
由图3所示可将三种氨基酸和谷胱甘肽的实验与理论计算近红外光谱图按照振动形式大致划分为三个光谱区: (1) 7 300~6 500 cm-1范围, 为O— H伸缩振动一级倍频及NH、 NH2基团的伸缩振动一级倍频与合频; 在该区域内可以看出, 实验结果为一很宽的振动谱带(6 500~7 100 cm-1区间), 理论计算是在理想条件下进行的且每个振动模式通常被认为是独立的。 理论计算结果呈现出多个振动峰, 而实验中由于仪器检测器分辨率问题和不同振动模式的相互作用及耦合导致一个很宽振动谱带。 (2) 6 000~5 300 cm-1范围, 主要是CH、 CH2振动的合频吸收带, 振动模式相对简单, 没有产生宽吸收带; (3) 5 200~4 600 cm-1范围, 主要是NH2不同振动模式的合频、 NH2、 OH、 CH等振动模式的合频导致振动图谱图谱复杂, 振动峰重叠严重, 也形成了一个宽的吸收带(4 700 cm-1附近); 实验结果不能体现出每个振动情况。 四种物质的NIR实验中可以看出在5 280 cm-1附近有一个很强的吸收峰, 该位置的振动是由分子间的相互作用引起的, 理论计算模型中是没有考虑分子间的相互作用的。 半胱氨酸在此范围还有SH伸缩振动的一级倍频吸收峰。 下面以这三个光谱区分析氨基酸和肽的NIR光谱, 讨论氨基酸及合成肽后结构的差异对NIR光谱的影响。
 | 图3 谷氨酸(a)、 半胱氨酸(b)、 甘氨酸(c)和谷胱甘肽(d)的近红外光谱图Fig.3 NIR spectra of (a) glutamic acid (b) cysteine (c) glycine and (d) glutathione |
由谷氨酸的近红外光谱[图3(a), 表1], 可以发现光谱区1中, 两个O— H伸缩振动的叠加使得7 085~6 984 cm-1范围出现了一个强度最高的O— H伸缩振动的一级倍频吸收峰, 最高峰位置在7 035 cm-1; 6 760~6 540 cm-1是NH2的振动吸收带, NH2非对称伸缩振动的一级倍频和NH2伸缩振动的合频为该区域内的主要贡献模式。 光谱区2中6 000~5 300 cm-1由于CH2和CH伸缩振动模式的出现, 谱峰明显变宽, CH2伸缩振动合频吸收峰与CH一级倍频吸收峰在5 800 cm-1; 在5 410 cm-1处有较弱的C=O与O— H基团伸缩振动的合频吸收峰, 与CH伸缩振动的一级倍频峰(5 343 cm-1)展宽后重叠。 光谱区3中, 5 024 cm-1处的尖峰是NH2剪式振动与非对称伸缩振动的二元合频吸收峰, 峰形窄, 峰位置相对独立; 4 874~4 600 cm-1范围的图谱是OH伸缩振动和CH2、 NH2伸缩与变形(剪式、 扭曲、 摇摆)的合频, 因此靠近中红外范围, 是最复杂的一段区域。
半胱氨酸近红外光谱[图3(b), 表2]在第一、 第二个光谱区的各峰位置与强度(OH振动的一级倍频峰除外)与谷氨酸相似, OH振动的一级倍频峰为7 015 cm-1处的中等强度峰; 但由于CH2基团的减少, 在5 500~5 300 cm-1范围只有C=O与OH伸缩振动的单独弱峰。 在低波数范围的第三光谱区, 4 996 cm-1左右有NH2伸缩振动与剪式振动的合频吸收峰, 同时还有SH伸缩振动一级倍频峰的贡献, 但是贡献极小, 后面不讨论— SH基团对近红外光谱的影响; 在此范围的合频振动吸收峰也受到CH2基团减少的影响而分离得更好。
甘氨酸近红外光谱[图3(c), 表3]在光谱区1中的O— H伸缩振动一级倍频峰与半胱氨酸在强度及频率上相似度高; 6 578和6 747 cm-1处由于NH2对称伸缩和反对称伸缩振动的一级倍频吸收峰与NH2合频吸收峰相互独立, 因此出现了三个互相独立的特征吸收峰。 甘氨酸分子中只含有一个— CH2基团, 光谱区2中特征吸收峰主要来源于CH2伸缩振动的合频。 光谱区3中在5 100~4 900 cm-1范围的NH2伸缩振动与剪式振动合频峰依旧存在; 4 900~4 600 cm-1出现了大量主要由NH2与CH2以及OH引起的合频振动, 振动模式复杂, 实验所得光谱呈现一个很宽的吸收带。
谷胱甘肽的近红外光谱[图3(d), 表4]吸收峰普遍比氨基酸强度更高。 光谱区1中, 两个O— H伸缩振动一级倍频的频率相差38 cm-1, 因此在6 920 cm-1左右出现双峰; 谷胱甘肽的NH与NH2合频吸收峰模式与谷氨酸、 半胱氨酸相似, 但在6 797 cm-1处NH与NH2的一级倍频峰相差波数较小, 此处出现的是一个峰形较宽的肩峰。 光谱区2与氨基酸差别较大, 氨基酸在此范围几乎被合频模式占据, 而谷胱甘肽在5 731、 5 625和5 371 cm-1处存在CH2与CH的一级倍频吸收峰。 光谱区3中, 三种氨基酸脱水缩合组成的谷胱甘肽拥有最多的— CH2基团, 导致CH2与NH2的合频数量大幅度增加, 实验中可以看到一个较宽吸收带。
2.2.1 7 300~6 500 cm-1区域内非谐振动光谱
在近红外光谱(图4)中, 7 000 cm-1左右出现的O— H伸缩振动一级倍频吸收峰强度最高, 且与其他吸收峰分离较好。 半胱氨酸和甘氨酸的O— H伸缩振动一级倍频吸收峰强度相差不大, 而谷氨酸在此处的O— H伸缩振动特征峰强度大于其他两个氨基酸, 且约为另外两种氨基酸O— H吸收峰强度的二倍, 振动强度出现较大差异的主要原因是由于谷氨酸的组成基团中相较于另外两种氨基酸多一个羧基, 谷氨酸上两个羧基的O— H振动叠加导致振动增强; 三种氨基酸的O— H伸缩一级倍频峰频率很相近, 所以此处的峰可以作为鉴定分子中是否含有羧基或羟基的结构标记, 其吸收峰强度与分子中含有O— H键的基团数量可能存在(正相关)关系。
 | 图4 谷氨酸、 半胱氨酸、 甘氨酸、 谷胱甘肽7 300~6 500 cm-1范围计算近红外光谱图Fig.4 Calculated NIR spectra of glutamate, cysteine, glycine, and glutathione in the range of 7 300~6 500 cm-1 |
不同分子的键长(表5)、 键级(表6)、 原子电荷差异会影响同一振动模式在NIR光谱上的振动频率, 各种因素对振动模式的影响程度不同。 谷胱甘肽的O— H伸缩振动的一级倍频峰与三种氨基酸相比存在明显红移现象。 通过分析发现, 键长是影响O— H特征吸收峰的频率的主要因素。 键长与吸收峰波数存在明显线性关系。 我们通过比较计算数据中的三种氨基酸和肽的O— H键长验证了这一关系, 结果如表5所示, 键长由小到大排列为: 谷氨酸、 半胱氨酸、 甘氨酸、 谷胱甘肽, 这与图3中O— H伸缩振动特征吸收峰的位置由高波数到低波数很好地对应。
| 表5 谷氨酸、 半胱氨酸、 甘氨酸、 谷胱甘肽的O— H键长 Table 5 O— H bond length of glutamic acid, cysteine, glycine, and glutathione |
| 表6 谷氨酸、 半胱氨酸、 甘氨酸、 谷胱甘肽的O— H键级 Table 6 O— H bond order of glutamic acid, cysteine, glycine, glutathione |
6 800~6 500 cm-1范围内的吸收峰主要是三种氨基酸关于NH2对称伸缩振动的一级倍频、 非对称伸缩振动的一级倍频、 对称伸缩振动和非对称伸缩振动二者组成的合频。 三种氨基酸在该范围内的吸收峰位置相似, 但结构的不同使得其峰形及振动频率存在一定差异, 甘氨酸在此范围内的吸收峰与另外两个氨基酸相比差异极为明显。 三种氨基酸在6 730 cm-1处的NH2非对称伸缩的一级倍频峰频率与强度相差不大; 在6 600 cm-1处谷氨酸与半胱氨酸的NH2的合频峰都与NH2对称伸缩的一级倍频峰重合, 甘氨酸的合频峰与NH2对称伸缩的一级倍频峰展宽后并未重叠, 而是相互分离形成了两个吸收峰。 甘氨酸的合频峰产生了蓝移现象, 主要的原因可能为甘氨酸结构中的氨基产生了共轭效应, 导致振动峰位发生了移动。 通过计算三种氨基酸的分子前线轨道并观察验证了这一点。 观察三种氨基酸的HOMO轨道图(图5), 发现甘氨酸的NH2上形成了π 型共轭轨道使其发生了共轭效应。 而谷胱甘肽由于氨基酸的— COOH与— NH2脱水缩合形成了酰胺键影响了氨基的振动模式, 在其NIR光谱中出现了N— H伸缩振动的一级倍频峰。
2.2.2 6 000~5 300 cm-1区域内非谐振动光谱
在此范围主要是C— H键的近红外吸收, 含有丰富的结构信息, 展宽后重叠程度明显更高。 甘氨酸在此范围依旧与谷氨酸和半胱氨酸有较大差异, 其吸收峰不仅数量较少且强度差异也较为明显, 推测与C— H键的数目有关。 甘氨酸分子中只有一个CH2, 单个CH2基团各种模式的振动峰展宽后重显著重叠, 因此振动峰最少。 这种差异同样体现在了谷氨酸与半胱氨酸中。 这两个氨基酸中都含有CH2与CH, 各峰振动模式、 频率及强度都有很高的相似度, 但谷氨酸的CH2数量比半胱氨酸多, 所以在5 343 cm-1处多一个振动吸收峰。 谷胱甘肽的NIR光谱在该范围内的吸收峰可能是受到肽键影响, CH2与CH振动合频峰与氨基酸的同类吸收峰相比强度更高, 且5 750~5 350 cm-1范围都是CH2或CH振动的一级倍频单峰, 谷胱甘肽与氨基酸相比在这一范围内的各吸收峰分离程度更高, 更容易进行分辨。
 | 图6 谷氨酸、 半胱氨酸、 甘氨酸、 谷胱甘肽6 000~5300 cm-1范围计算近红外光谱图Fig.6 Calculated NIR spectra of glutamate, cysteine, glycine, and glutathione in the range of 6 000~5 300 cm-1 |
三种氨基酸在5 400 cm-1左右都存在C=O与O— H伸缩振动的合频峰, 此峰可以很好地被用来识别分子的组成基团中是否存在羧基, 在探究饱和与不饱和短链[31]、 中链[41]、 长链脂肪酸[54]的近红外光谱中都有此峰出现。 近红外光谱主要反映含氢基团的振动信息, C=O振动峰的特殊性让人们对其表现出极大的研究兴趣。 谷氨酸由于有两个羧基, 此处合频峰强度也高于另外两个氨基酸, 这一现象同样也证明了某一吸收峰的强度与分子中含有相应基团的数量存在(正相关)关系。 谷胱甘肽的C=O与OH伸缩振动的合频峰位置在5 333 cm-1处, 与氨基酸的同类振动峰相比有红移现象, 且强度更高, 这或许表明分子的C=O与O— H伸缩振动合频峰对氨基酸和肽的结构差异敏感。
2.2.3 5 200~4 600 cm-1区域内非谐振动光谱
三种氨基酸和肽在此区域由于有较多的C— H和N— H二元合频峰导致了强烈的吸收峰展宽后重叠(图7)。 采用RDG方法分析并可视化研究对象分子内的弱相互作用。 5 000 cm-1左右的峰由NH2振动产生, 根据绘制出的氨基酸与肽的弱相互作用图(图8), 图中原子间等值面的不同颜色代表了不同弱相互作用, 蓝色代表氢键强卤键等; 绿色代表范德华力; 红色代表较强位阻效应, 颜色越深弱相互作用越强。 明显观察到羧基的双键氧会与相邻原子间产生弱相互作用而改变吸收峰的位置; 不仅此处NH2振动峰受到影响, 在4 840 cm-1左右NH2与CHO基团振动的合频为该范围吸收峰的主要贡献模式, 其强度与频率也因此产生了一定差异。 甘氨酸与另外的三种分子相比, 在此范围总体振动峰的数目更多, 大多是CH2和NH2的合频吸收峰, 这与上述的由于CH2数目少而吸收峰少的结论正好相反, 推测是由于— NH2与— CH2连接在同一个C原子上, 基团空间位置更加靠近导致的。
 | 图7 谷氨酸、 半胱氨酸、 甘氨酸、 谷胱甘肽5 200~4 600 cm-1范围计算近红外光谱图Fig.7 Calculated NIR spectra of glutamate, cysteine, glycine, and glutathione in the range of 5 200~4 600 cm-1 |
随着非谐性量子化学理论方法的发展, 如今近红外光谱在各领域的应用越来越广泛。 生物类分子由于结构复杂, NIR光谱范围内存在大量的振动模式导致谱线展宽和重叠严重, 很难从实验光谱中准确指认NIR的所有振动信息。 通过量子化学方法建立生物类分子NIR光谱的理论计算模型可以解决以上技术难题, 对研究生物类分子的精细结构信息至关重要。
以三种氨基酸(谷氨酸、 半胱氨酸、 甘氨酸)和谷胱甘肽为研究对象, 采用DFT方法计算这四种分子7 500~4 500 cm-1波段内的高精度NIR光谱, 并对其谱图进行了详细的谱带分配并且建立了光谱与结构间的对应关系, 结论如下: (1)7 000 cm-1左右为O— H伸缩振动一级倍频吸收峰, 由于较高的强度且和其他峰分离较好可以作为分子中是否有羟基或羧基的判断依据; (2)6 800~6 500 cm-1范围的NH与NH2吸收峰在受到诱导效应影响时峰位置会发生偏移; (3)6 000~5 300 cm-1范围CH与CH2吸收峰差异与相关基团的数量有很大关系; (4)5 200~4 600 cm-1这段复杂区域以NH2与CH2的合频为主, 基团间的空间位置对近红外光谱有显著影响。 通过将NIR光谱的各吸收峰与分子振动模式一一对应, 可以得到生物分子大量的高度特异性结构信息。 本文分析方法具有普适性, 可以广泛应用于生物分子体系中, 并用于指导生物分子体系NIR光谱的相关实验研究。
此工作将生物分子的结构与近红外光谱联系起来, 也帮助我们对蛋白质等一系列生物大分子有更好的了解。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|