作者简介: 刘荣祥, 1991年生, 内蒙古科技大学矿业与煤炭学院博士研究生 e-mail: 2842014603@qq.com
独居石浮选体系中往往有方解石、 萤石、 白云石等大量的伴生矿, 而这些伴生矿在独居石矿中会解离出大量的Ca2+, 而Ca2+往往会影响矿浆浮选环境。 为此, 通过Ca2+的溶液化学计算、 独居石浮选试验, 以及浮选条件下作用的独居石表面红外光谱分析(FTIR)和X射线光电子能谱(XPS), 分析研究Ca2+的影响。 Ca2+的溶液化学计算显示, 在水溶液中, 随着pH值的升高, Ca2+分别以离子态、 羟基络合物和氢氧化合物的形式存在, 当pH值在7~8之间, 优势组分为Ca2+和Ca(OH)+。 独居石浮选结果表明, 不添加Ca2+时, 捕收剂OHA不能充分的浮选独居石, 回收率为75.37%; 而在pH为8±0.5, 加入3×10-4 mol·L-1的Ca2+剂量, 可显著的提高OHA对独居石的浮选性能, 回收率达到96.48%。 由溶液化学计算可知, Ca(OH)+是活化独居石的优势组分; Ca2+剂量大于3×10-4 mol·L-1时浮选回收率下降幅度较大, 说明Ca2+剂量的进一步增加, 反而抑制独居石浮选, 只有一定剂量的Ca2+有效的促进独居石浮选, 这可能归因于Ca2+剂量消耗了OHA的浓度, 进而影响独居石的浮选。 红外光谱分析表明, 在Ca2+的作用下, 光谱中出现两个关键性的新峰, 其一为1 454 cm-1处的N—O—H弯曲振动峰, 其二为880 cm-1处的O—N拉伸振动峰, 而在2 974和2 928 cm-1的有机峰—CH3和—CH2—峰明显增强, 这些基团的出现表明发生了化学吸附且吸附强度大于纯独居石吸附OHA的效果。 XPS分析表明, 仅使用OHA吸附独居石, 独居石表面的N元素相对含量较低, 为0.61%, 而Ca2+处理后的独居石, OHA吸附独居石时, 独居石表面的N元素相对含量较高, 达到2.36, 由此可以得出, Ca2+会促进OHA吸附到独居石表面。 从分峰拟合中可以看出, 添加Ca2+在独居石的解理面上氧原子与Ca(OH)+反应形成O—Ca—OH基团, 可以作为吸附OHA的新吸附位点, 同时独居石的铈原子与OHA上的两个氧原子形成五元螯合物也作吸附位点, 得出独居石表面可以有两个吸附位点, 独居石表面的Ca和Ce原子的活性位点都能吸附OHA, 有利于OHA在独居石表面吸附, 形成更均匀更致密的OHA疏水吸附层, 这就是Ca2+在OHA浮选独居石的性能得到改善的原因。 这项研究有助于丰富矿浆中金属离子的活化理论, 也证实了有效的矿物浮选分离不仅仅依赖于捕收剂-矿物相互作用的强度, 而在很大程度上依赖于浮选溶液的化学性质。 利用或者控制表面反应是开发一种更高效、 更经济的浮选工艺的主要技术手段。
The monazite flotation system often has many associated minerals such as calcite, fluorite, and dolomite. These associated minerals will dissociate a large amount of Ca2+ in the monazite ore, and Ca2+ often affects the pulp flotation environment. In this paper, the surface properties of monazite were studied by FTIR and XPS when Ca2+ affected the flotation of monazite by octyl hydroxamic acid. The research method is mainly through the solution chemical calculation of Ca2+, the flotation test of monazite, and the surface infrared spectroscopy ( FTIR ) and X-ray photoelectron spectroscopy ( XPS ) of monazite under flotation conditions. The solution chemical calculation of Ca2+ shows that an aqueous solution with increased pH value, Ca2+ exists in an ionic state, hydroxyl complex, and hydroxide compound, respectively. At the same time, the dominant components are Ca2+ and Ca(OH)+ at pH between 7 and 8. The results of monazite flotation showed that OHA could not fully float monazite without adding Ca2+, and the recovery rate was 75.37%. When the pH is (8±0.5), and the dosage of Ca Ca2+ is 3×10-4 mol·L-1, the flotation performance of OHA on monazite can be significantly improved, and the recovery rate reaches 96.48%. According to the solution chemistry calculation, Ca(OH)+ is the dominant component of activated monazite. When the Ca2+ dose is greater than 3×10-4 mol·L-1, the flotation recovery rate decreases greatly, indicating that the further increase of Ca2+ dose inhibits the flotation of monazite. Only a certain dose of Ca2+ effectively promotes the flotation of monazite, which may be attributed to the consumption of OHA concentration by Ca2+ dose, which in turn affects the flotation of monazite. Infrared spectroscopy analysis showed that under the action of Ca2+, two key new peaks appeared in the spectrum, one was the N—O—H bending vibration peak at 1 454 cm-1, the other was the O—N stretching vibration peak at 880 cm-1, and the organic peaks at 2 974 and 2 928 cm-1. The —CH3 and —CH2— peaks were significantly enhanced, and these groups appeared to indicate that chemical adsorption occurred and the adsorption intensity was greater than that of pure monazite adsorption of OHA. XPS analysis showed that the relative content of N element on the surface of monazite was 0.61 % when only OHA was used to adsorb monazite. In comparison, the relative content of N element on the surface of monazite was 2.36% when OHA was used to adsorb monazite after Ca2+ treatment. It can be concluded that Ca2+ will promote the adsorption of OHA on the surface of monazite. It can be seen from the peak fitting that the addition of Ca2+ reacts with Ca(OH)+ to form O—Ca—OH groups on the cleavage surface of monazite to form O—Ca—OH groups, which can be used as a new adsorption site for adsorbing OHA. At the same time, the cerium atom of monazite and the two oxygen atoms on OHA form a five-membered chelate, which also acts as an adsorption site. It is concluded that there can be two adsorption sites on the surface of monazite. The active sites of Ca and Ce atoms on the surface of monazite can adsorb OHA, which is beneficial to the adsorption of OHA on the surface of monazite and forms a more uniform and dense OHA hydrophobic adsorption layer. This is why the performance of Ca2+ in OHA flotation of monazite is improved. This study helps to enrich the activation theory of metal ions in pulp and also confirms that effective mineral flotation separation depends not only on the strength of collector-mineral interaction but also on the chemical properties of the flotation solution to a large extent. Utilizing or controlling the surface reaction should be the main goal of developing a more efficient and economical flotation process.
稀土金属是许多绿色高科技产品开发和制造的重要资源。 稀土元素(REE)具有重要的战略价值, 被称为“ 新材料之母” [1]。 世界稀土矿床的开采仍然不大, 只有少数中国和美国的矿床在进行大规模开采。 这些矿床的矿石类型主要是氟碳铈矿和独居石[2]。 据报道, 砂矿床中发现的独居石的选矿可通过重力、 磁力和静电分离实现[3, 4, 5, 6, 7]。 然而, 独居石源于氧化物或碳酸盐岩矿床, 如白云鄂博(中国内蒙古)、 Niobec稀土矿床(加拿大魁北克)和Mt Weld(澳大利亚西澳州), 与许多不同的矿物有关, 因此, 矿石的细磨对于独居石的充分释放是不可避免的[8, 9]。 因此, 通过泡沫浮选生产高稀土氧化物(REO)品位精矿, 这是回收细粒有价值矿物的最有效技术[10, 11, 12, 13, 14]。
在实际生产过程中, 由于磨矿、 化学品的加入和矿物的溶解, 金属离子不可避免的存在于矿浆中。 根据金属离子和捕收剂的不同性质, 金属离子可以促进或者阻断捕收剂在矿物表面的吸附, 进而影响目标矿物的回收率[28, 29, 30, 31]。 在众多金属离子中, 伴生矿中普遍存在的Ca2+, 一直受到众多研究者的关注, 例如, 对方解石中溶解的Ca2+, 使用羟肟酸捕收剂研究独居石的浮选性能[18, 19]。 它可以通过矿物表面的金属离子和分子中的两个O原子之间的化学吸附吸附到矿物上, 形成强大的五元环螯合吸附[15]。 Wang等[16, 17]使用油酸钠浮选氟碳铈矿, 以研究重晶石和萤石等脉石矿物中溶解离子的影响。 从脉石矿物中溶解的Ba2+降低了氟碳铈矿的回收率, 这可能是由于与金属离子形成不溶性油酸盐产物。 金属离子在独居石矿浮选中的作用研究[20]发现, 由于氢氧化钙在独居石表面的优先吸附, 溶液中的Ca2+不利于独居石的回收, 导致浮选回收率较低。 Espiritu等[32]用DFT模拟研究了白云石中溶解离子对独居石浮选的影响, 发现Ca2+和Mg2+降低了独居石的可浮性, 这是由于碳酸钙或氢氧化镁在独居石上的吸附以及油酸钙或镁的沉淀。 Zhang等[13]研究了方解石表面Ca2+溶解对独居石-方解石体系浮选性能的影响。 结果表明, Ca(OH)+在独居石上静电吸附, 通过螯合作用增加了羟肟酸的吸附密度。 在较高的钙和羟肟酸剂量下, 独居石-钙-羟肟酸体系中发生了表面大量的羟肟酸钙沉淀。
目前, 对Ca2+与独居石表面的相互作用已有一些研究, 然而结论不同, 一种说法是Ca2+抑制独居石的浮选[32], 另一种是说法是Ca2+有利于独居石浮选[13]。 因此, 我们在捕收剂辛基异羟肟酸体系中, 添加Ca2+到独居石矿浆中, 通过溶液化学计算、 浮选试验、 红外光谱(FTIR)、 X射线光电子能谱(XPS)试验, 观测对独居石表面的影响。 创新点在于无需使用复杂的工艺(团聚浮选和载体浮选), 而是使用简单的试剂方案(Ca2+仅添加)用于细小的独居石矿物颗粒中。 最后, 建立了Ca2+存在下独居石吸附辛基异羟肟酸的相互作用模型。
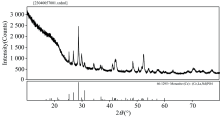
独居石来自福建泉州市, 经显微镜下手选得到38~74 m粒径的独居石纯矿物, XRD分析结果见图1, 纯度满足浮选试验和红外光谱、 XPS分析。
盐酸和氢氧化钠用作pH值调整剂, 来自西安(中国)。 氯化钙(CaCl2)在浮选试验中用作表面改性剂, 来自连云港(中国)。 辛基异羟肟酸(OHA)用作浮选试验中的捕收剂, 纯度为99.9%, 来自天津(中国)。 使用的化学品均为分析纯, 所有试验均采用mil-9水系统制备的Ⅰ 型去离子水, 电阻率为18.2 M· m。
1.2.1 浮选试验
在XFGⅡ 中对单一矿物进行了浮选试验。 5型进气吊槽式浮选机(中国吉林省长春勘探机械厂)。 60 mL浮选槽中加入2.0 g独居石颗粒和大约40 mL水来制备矿物悬浮液。 然后, 通过加入NaOH和HCl, 将悬浮液pH值调整为所需值2 min。 pH调整后, 加入一定浓度的Ca2+离子, 加入捕收剂(OHA), 调节时间6 min, 收集漂浮矿物颗粒4 min。 对漂浮和未漂浮的矿物颗粒分别进行过滤、 干燥和称重。 根据两种产品的重量分布计算回收率。 每个实验重复3次, 报告值为平均值及其标准差。
1.2.2 FTIR光谱测量
采用傅里叶变换红外光谱对药剂作用前后的矿物进行分析, 样品KBr压片, 测量范围4 000~400 cm-1。 红外分析样品的制备: 1 g矿样经过玛瑙研磨至小于5 m, 置于浮选槽中添加35 mL去离子水, 并按浮选试验条件搅拌、 加药、 调浆pH值至8, 充分作用后固液分离, 采用相同pH值的去离子水洗涤3次, 所得矿样经过40 ℃烘干, 进行红外光谱测定。
1.2.3 XPS测量及分析
XPS检测装置为Kratos AXIS Ultra XPS系统, 配备单色Al X射线源(工作在150 W, 能量分辨率为0.48 eV (Ag 3d5/2), 误差值为0.05 eV。 C(1s)峰作为284.8 eV时未带电荷烃结合能(BE)的参考。 样品的所有其他光谱中的BE针对此偏移进行了校正。 为了制备用于XPS分析的样品, 将样品用玛瑙研钵研磨至粒径小于5 μ m。 然后将1 g样品放入烧杯中, 加入去离子水35 mL, 搅拌、 加药、 调浆pH值至8。 随后, 固体样品从悬浮液中离心分离, 用与反应处理相同pH值的去离子水洗涤三次。 最后, 样品在真空下40 ℃干燥, 然后进行XPS分析。 每个样品的XPS测试均重复多次, 以确保数据误差在± 0.005 eV内。
实验条件为: 每次测量从0~1 350 eV开始, 停留时间为8 s, 带通能量为150 eV, 步长为1 eV。 对于高分辨率扫描, 增加扫描次数, 将停留时间降低到0.5 s, 将带通能量调整到30 eV。 最后所得数据利用Advantage 4.15软件拟合和分离峰。
根据Ca2+水解的溶液平衡关系式, 可绘制溶液中各组分浓度与pH值的关系(lgC-pH)图, 如图2所示, 结合浮选试验结果, 确定起活化作用的优势组分。
 | 图2 Ca2+水解的lg C-pH图 Ca2+=2× 10-4 mol· L-1Fig.2 lg C-pH diagram of Ca2+ hydrolysis Ca2+=2× 10-4 mol· L-1 |
由图2可知, 在水溶液中, 随着pH值的升高, Ca2+分别以离子态、 羟基络合物和氢氧化合物的形式存在。 当pH值小于10时, 主要以Ca2+、 Ca(OH)+形式存在。 当10< pH< 12.5时, 主要以Ca2+、 Ca(OH)+和水溶性的Ca(OH)2(aq)存在, 且随着pH值增加, Ca2+浓度减小, Ca(OH)+和水溶性的Ca(OH)2(aq)浓度增加; pH值> 12.5, 溶液中Ca2+、 Ca(OH)+减少, 而Ca(OH)2(s)沉淀增加。
为了确定添加与不添加Ca2+对独居石的浮选影响, 通过浮选测试pH和Ca2+用量对浮选独居石回收率来确定, 以辛基异羟肟酸用量为5× 10-4 mol· L-1作为捕收剂, 结果对应于pH和Ca2+的影响独居石回收率的用量分别如图3(a, b)所示。
 | 图3 独居石的浮选回收率 (a): pH的影响; (b): Ca2+用量的影响Fig.3 Flotation recovery of monazite (a): Effect of pH; (b): Effect of Ca2+ dosage |
由图3(a)所示, 如果Ca2+没有添加到矿浆中, 采用OHA浮选独居石的最高回收率在pH为7左右, 回收率为75.37%, 而Ca2+添加到矿浆中, 采用OHA浮选独居石时, 矿浆pH为8时最佳, 为93.29%, 提高了17.92个百分点, 由此可见Ca2+的添加, 促进了OHA浮选独居石, 而pH在其他范围时, 浮选独居石效果不佳, 这是矿浆pH值影响了Ca2+的水解作用。 从Ca2+的溶液化学计算图可知, Ca2+水解的组分为Ca2+和Ca(OH)+, 可能这是两种组分影响独居石表面, 而Ca(OH)+随着pH值的变大, Ca(OH)+浓度增大, 这可能是Ca(OH)+起到主要作用, 这与以往的文献研究是一致的[13]。 这些结果清楚的表明, Ca2+的添加, 对使用OHA作为捕收剂, 浮选独居石产生有利的效果。
图3(b)显示了OHA浮选独居石的回收率与Ca2+用量的函数关系。 增加Ca2+剂量使独居石的回收率从73.75%增加到96.48%, Ca2+剂量从3× 10-4 ~4× 10-4 mol· L-1时浮选回收率下降幅度较大。 说明Ca2+剂量的进一步增加, 反而抑制独居石浮选, 只有一定剂量的Ca2+才有效的促进独居石浮选, 这可能归因于Ca2+剂量消耗了OHA的浓度, 进而影响独居石的浮选。 结果显示3× 10-4 mol· L-1的Ca2+可以最大程度的促进OHA浮选独居石, 回收率达到96.48%。
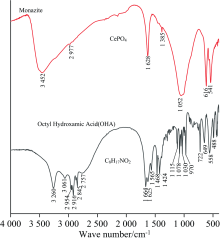
通过红外光谱分析评价添加与不添加Ca2+到独居石矿浆中, 独居石吸附OHA前后的表面的官能团的变化。 试验条件: 调整剂Ca2+用量为3× 10-4 mol· L-1, 捕收剂OHA浓度为5× 10-4 mol· L-1, 在此条件下独居在添加Ca2+前后的红外光谱如图4和图5所示。
 | 图5 Ca2+和OHA与独居石作用前后的红外光谱图Fig.5 Infrared spectra of Ca2+ and OHA before and after interaction with monazite |
图4显示了辛基异羟肟酸(OHA)和独居石的光谱。 OHA的FTIR波段见表1所示。 独居石在616和541 cm-1处显示
图5显示了Ca2+作用前后的独居石吸附OHA的红外光谱。 矿浆中不添加Ca2+时的独居石吸附OHA后, 在2 927、 2 852和1 457 cm-1处出现新峰, 而纯独居石谱图中1 385 cm-1处的H2
通过Ca2+的溶液化学计算、 浮选试验和FTIR光谱测量证实了添加适量的Ca2+用量可大大提高OHA在独居石表面的吸附性能, 从而增加矿物可浮性。 然而, Ca2+提高了OHA在独居石表面吸附的机理还有待进一步研究。 对Ca2+处理前后的独居石吸附OHA进行了XPS分析。 因为它是分析矿物浮选系统中界面相互作用机制的一种行之有效的手段。 通过XPS分析确定实验条件, 即pH值为8± 0.5, OHA浓度为5× 10-4 mol· L-1, Ca2+剂量为3× 10-4 mol· L-1。 独居石表面化学物质的变化, 独居石在不同条件下的全谱扫描结果如图6所示。
 | 图6 独居石与Ca2+和OHA作用前后的XPS光谱图Fig.6 XPS spectra of monazite before and after interaction with Ca2+ and OHA |
如图6所示在Ca2+处理前的独居石的XPS全谱, 在285.25、 531.09、 885.55和133.12 eV处观察到的峰分属为独居石的C(1s)、 O(1s)、 Ce(3d)和P(2p)轨道峰。 经加入OHA作用后的独居石在399.66 eV处出现了新的N(1s)峰, 表明OHA的元素吸附在了独居石表面, 改变了其化学成分, 加入Ca2+和OHA后, 可以检测到两个新峰为Ca(2p)和N(1s)峰, 说明Ca2+和OHA都已经吸附在了独居石表面, 改变了其化学成分。
当研究了不同处理方法对独居石表面元素相对含量的影响, 如表2所示。 由表2可知, 独居石经Ca2+和OHA处理后, N(1s)相对含量较单独OHA处理增加了1.75%(0.61%~2.36%), 表明Ca2+对独居石表面吸附OHA有促进作用。 进一步分析独居石表面矿物元素结合能如表3, 可以看出经OHA处理的独居石表面Ce(3d5)轨道峰的位移量为0.39 eV。 明显大于XPS仪器0.2 eV的分辨率, 说明OHA与独居石的Ce原子发生了化学键合, 而经Ca2+和OHA处理后, Ce(3d5)轨道峰的位移量为0.88 eV, 明显大于单独使用OHA处理独居石的位移量, 说明Ca2+的优势组分Ca(OH)+起到活化独居石的吸附位点, 从而Ca(OH)+吸附在独居石表面与原本存在Ce原子与OHA共同作用形成化学键合。
| 表2 独居石矿物表面元素的相对含量 Table 2 Relative content of surface elements of monazite minerals |
| 表3 独居石表面矿物元素结合能 Table 3 Binding energy of mineral elements on the surface of monazite |
虽然从全谱中看出其吸附特性, 但是矿物表面元素的复杂性, 致使矿浆中矿物表面反应复杂, 因此, 需要对Ce(3d)、 O(1s)、 N(1s)、 Ca(2p)窄扫描光谱轨道峰进一步分峰拟合, 以鉴定特定的吸附物质和化学构型, 如图7— 图9所示。
如图7所示为独居石与Ca2+和OHA作用前后的Ce(3d)轨道峰的分峰拟合, 图7(a)是未经处理的独居石表面, Ce的XPS窄谱中显示出904.69、 900.90、 897.40、 886.30和882.60 eV五个子峰, 这归因于独居石晶格中Ce3+, 是由Ce(3d)光谱分别由高(904.69、 900.90和897.40 eV)和低(886.30、 882.60 eV)的两组谱组成分别属于自旋-轨道分裂Ce(3d3)和Ce(3d5)核心层。 Ce(3d3)和Ce(3d5)之间的分裂能约为18.17 eV。 Ce三维光谱的每个自旋-轨道分量由两个特征峰主导。 Ce3+氧化物的Ce(3d)光谱中可以识别出5个对应于自旋轨道双态对的峰。 这与以往的研究一致[24, 25]。 OHA处理独居石后[图7(b)], 其五个子峰的峰移分别为0.15、 0.28、 0.81、 0.1和0.2 eV, 而根据文献研究, 如果存在化学键合, 则会发现XPS峰有明显的峰移, 但只在Ce(3d3)核心层化学键合。 而同时用Ca2+和OHA处理独居石时[图7(c)], 相对于单独OHA处理的矿物表面, Ce(3d)的峰移值更大, 峰移值分别为0.86、 1.1、 0.9、 0.86和1 eV, 说明经Ca2+和OHA作用的独居石表面作用在Ce(3d3)和Ce(3d5)核心层化学键合, 因此比单独OHA处理独居石的化学键合能力更强。
图8所示为O(1s)拟合窄谱, 该峰拟合为532.80和530.97 eV两个子峰[图8(a)], O(1s)对应于独居石表面的桥接氧原子, 当用OHA处理独居石时[图8(b)]O(1s)的两峰峰移为0.11和0.03 eV, 没有发生明显的峰移, 说明OHA没有在O原子上发生化学键合。 当用Ca2+和OHA同时处理独居石时[图8(c)], O(1s)的两峰峰移为0.30和0.03 eV, 发生明显峰移, 说明在Ca2+的作用下, OHA在独居石上的O(1s)发生化学键合。 这在一些文献中也有证实[20, 32], 这可能是Ca2+中的Ca(OH)+吸附在独居石表面而发生峰移, 说明— O— Ca— OH基团和OHA之间的化学键合。
图9(a)所示为OHA于独居石作用的N(1s)轨道拟合峰, 图9(b, c)为Ca2+和OHA共同作用于独居石后的N(1s)、 Ca(2p)轨道拟合峰, 这些峰都是独居石表面新形成的峰, 比较图9(a)与图9(b)中N(1s)轨道峰的结合能相差0.62 eV, 超出误差值, 说明N(1s)发生了化学键合。 而图9(c)为Ca(2p)的轨道拟合峰, 分为Ca(2p1)和Ca(2p3)轨道, 结合能为347.40和350.93 eV。
独居石(1 0 0)晶面为明显解理[26], 在磨矿过程中大量的优势解理面暴露出来, 而这些优势解理面是浮选药剂的主要吸附面。 大量文献研究表明[27]独居石(1 0 0)晶面中磷酸根与铈原子交替排列, 由于是额外的悬空键, 它们通常是活跃的。
当独居石矿浆中不存在Ca2+时, OHA捕收剂主要是通过两个氧原子与铈原子作用形成五元螯合物吸附在独居石表面, 如图10所示。 表面的磷酸根中的氧原子没有作为吸附位点, 从而导致捕收剂不能均匀的吸附在独居石表面。 这一点可以通过红外光谱分析可以看出, 吸附的官能团种类单一; XPS表明, 吸附在独居石表面的N原子相对含量较小, 只有0.61%。
 | 图10 独居石浮选吸附OHA的吸附构型示意图Fig.10 The adsorption configuration diagram of OHA adsorbed by monazite flotation |
而独居石矿浆中加入Ca2+和OHA后, 通过红外光谱分析, 光谱中出现两个关键性的新峰, 其一是1 454 cm-1处的N— O— H弯曲振动峰, 其二为880 cm-1处的O— N拉伸振动峰, 而在2 974和2 928 cm-1的有机峰— CH3和— CH2— 峰明显增强。 通过XPS分析表2可知, 在Ca2+和OHA作用后的独居石表面C元素、 O元素的相对含量最大, 分别为15.32%和28.76%, Ce元素的相对含量降低为8.75%; 而在Ce(3d)分峰拟合过程中Ce(3d3)和Ce(3d5)峰移都比单独使用OHA大, 同时O(1s)也是同样的现象。 说明独居石吸附位点有两个, 一个是铈原子吸附OHA的两个氧原子形成五元螯合物, 另一个吸附位点是独居石上的O— Ca(OH)与OHA作用的; 而通过比较两种矿浆环境, 独居石吸附的N(1s)峰两者结合能差距较大, 差值为0.62 eV, 且N原子相对含量有所增加, 达到2.36%, 说明N原子起到化学键合作用, 因此推断出氧原子吸附位点的构型为O— Ca— O— N成键, 期间Ca(OH)+失去一个OH-, 而OHA上的N— O— H键失去一个H+, 形成一个H2O分子, 典型的脱水反应, 故吸附更稳定。 其上就解释了加入Ca2+有利于OHA浮选独居石。 两种吸附构型如图11所示。
研究了Ca2+对以辛基异羟肟酸浮选独居石的的影响, 通过Ca2+的溶液化学计算、 独居石浮选试验、 红外光谱分析(FTIR)和X射线光电子能谱(XPS)得出如下结论。
(1)溶液化学计算显示, 在水溶液中, 随着pH值的升高, Ca2+分别以离子态、 羟基络合物和氢氧化合物的形式存在, pH值在7~8左右时优势组分为Ca2+和Ca(OH)+。
(2)浮选结果表明, 不添加Ca2+时, OHA不能充分的浮选独居石, 而pH为8± 0.5, 加入3× 10-4 mol· L-1的Ca2+剂量下, 可显著的提高OHA对独居石的浮选性能, 回收率达到96.48%。 由此可以得出Ca2+有利于OHA吸附独居石表面。 Ca2+剂量大于3× 10-4 mol· L-1时浮选回收率下降幅度较大, 说明Ca2+剂量的进一步增加, 反而抑制独居石浮选, 只有一定剂量的Ca2+有效的促进独居石浮选, 这可能归因于Ca2+剂量消耗了OHA的浓度, 进而影响独居石的浮选。
(3)FTIR分析表明, 矿浆中添加Ca2+时的独居石吸附OHA后, 同时在2 974、 2 928、 1 454、 1 382和880 cm-1处生成新的峰, 同时纯独居石光谱中1 385 cm-1处的峰消失, 而2 974和2 928 cm-1处的峰面积增大, 峰锐而强。 比较OHA光谱中基团存在2 974、 2 928、 1 454、 1 382和880 cm-1分别代表— CH3的反对称峰、 — CH2— 对称、 N— O— H弯曲、 C=C拉伸、 N— O拉伸, 这些基团出现在Ca2+处理独居石的光谱中表明发生了化学吸附且吸附强度大于纯独居石吸附OHA的效果。 Ca2+处理完的独居石与OHA作用后, 红外光谱中出现的新峰种类较多, 峰强变强, 说明Ca2+处理的独居石吸附了OHA后, 化学吸附更强, 更致密, 说明Ca(OH)+吸附在独居石表面增加了吸附位点, 从而增加了OHA的剂量, 基团种类增多。
(4)XPS分析表明, 添加Ca2+在独居石的解理面上氧原子与Ca(OH)+反应形成O— Ca— OH基团, 可以作为吸附OHA的新吸附位点, 同时独居石的铈原子与OHA上的两个氧原子形成五元螯合物也作吸附位点。 独居石表面的Ca和Ce活性位点都能吸附OHA, 有利于OHA在独居石表面吸附, 可能形成更均匀更致密的OHA疏水吸附层, 这就是Ca2+在OHA浮选独居石的性能得到改善的原因。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|