作者简介: 沈梦姣, 女, 1998年生, 贵阳学院贵州省农产品无损检测中心硕士研究生 e-mail: 1483995652@qq.com
辣椒早疫病是影响辣椒安全生长的常见生物灾害, 具有突发性和易感性等特点, 容易引发大的经济损失。 在辣椒生长过程中, 针对病害潜育期侵染情况进行科学监测预警是保证作物健康生长的重要前提。 利用400~1 000 nm波段的高光谱图像结合光谱相似性测度方法建立作物病害潜育期的光谱特性判别方法。 针对接种早疫病病菌的辣椒叶片和健康叶片, 用高光谱成像仪连续动态监测其不同感染期的高光谱图像。 对试验采集的一系列高光谱图像提取感兴趣区的平均光谱, 通过卷积平滑、 多元散射校正以及最大最小归一化方法(SG-MSC-MMN)预处理, 进而提出以光谱角余弦-相关系数和切比雪夫距离两种测度作为早疫病潜育期的光谱特性评价参数。 最后利用主成分分析(PCA)验证潜育期的光谱特性判别方法效果, 实现样本潜育期的可视化分布。 试验结果显示: 利用光谱角余弦-相关系数与切比雪夫距离作为辣椒早疫病潜育期的光谱特性评价参数并分别建立相应的判别方法是可行的, 且根据这两种判别方法得到的辣椒早疫病潜育期最早可识别时间均为接种后24 h。 根据PCA绘制得到接种24 h时的健康-接种样本空间分布情况, 分别验证所提出的两种基于光谱特性的潜育期最早可识别时间判别方法。 建立的辣椒早疫病潜育期最早可识别时间判别方法可推广应用于其他作物病害潜育期的监测识别, 为作物病害潜育期的科学防治提供理论参考与方法借鉴。
Early blight of chili peppers is a common biological disaster that affects the safe production of chili peppers. It is characterized by suddenness and susceptibility and can easily cause significant economic losses. During the growth process of chili peppers, scientific monitoring and early warning of disease infestation during the incubation period is an important prerequisite for ensuring the healthy growth of crops. This paper establishes the spectral characteristics discriminative model of crop disease incubation period using the hyperspectral image with the working band of 400~1 000 nm and the spectral similarity measurement method. Continuous and dynamic monitoring of hyperspectral images of pepper leaves and healthy leaves inoculated with early blight pathogens at different infection stages using a hyperspectral imager.Extract the average spectrum of the region of interest from a series of hyperspectral images collected in the experiment and preprocess it using convolutional smoothing, multivariate scattering correction, and maximum minimum normalization method (SG-MSC-MMN). Then, two measures, spectral angle cosine correlation coefficient, and Chebyshev distance, are proposed as spectral characteristics evaluation parameters for the incubation period of early blight. Finally, principal component analysis (PCA) was used to verify the results of the spectral characteristics discriminative model of the incubation period to realize the visual distribution of the incubation period of samples.The experimental results show that it is feasible to use the spectral angle cosine correlation coefficient and Chebyshev distance as the spectral characteristic evaluation parameters of the incubation period of early blight of pepper and establish the corresponding discriminative model, respectively, and the earliest identifiable time of incubation period of early blight of pepper obtained from these two discriminative models is 24 hours after inoculation.According to the PCA drawing, the spatial distribution of health vaccination samples during inoculation for 24 hours was verified by the two spectral characteristics-based discriminative models for the incubation period proposed in this paper.The discriminative model of the incubation period of early blight of pepper established in this paper can be extended to monitor and identify the incubation period of other crop diseases and provide theoretical reference and method reference for scientific control of the incubation period of crop diseases.
辣椒作为茄科作物的代表, 具有种植范围广、 产量高的特点, 早疫病是辣椒生长中的一种破坏性病害, 严重时会导致作物歉收, 对我国各地辣椒种植区造成了巨大危害[1, 2]。 近年来, 国内外学者在辣椒早疫病的发生、 流行规律、 预测和防治等方面做了大量的工作, 以期减轻早疫病的危害[3, 4]。 在农作物的生长过程中, 及时有效地发现其病害状态并进行预警是保证作物健康生长的前提。 传统的病害检测方法是依靠肉眼对明显病症的观察, 但受作物种植面积、 产量等因素影响, 加上早疫病流行迅速导致很难控制病害的发展。 因此, 对辣椒早疫病潜育期进行检测识别能够及时指导病害防治, 在作物感染发病之前控制病情、 预防病害传播, 对作物生长具有重大指导意义[5, 6, 7]。
目前, 高光谱成像技术以其快速、 无损的特点被广泛应用于农业生产信息监测领域。 现有作物病害早期检测识别主要针对植株冠层。 因不同叶片的采光程度、 距离探测器位置差异等影响, 容易造成成像模糊, 严重影响了植株冠层监测识别的成像质量[8]; 冠层的检测方法是针对大样本, 采用宏观的统计学分析方法, 对群体染病程度作判断。 在少数以叶片为研究对象的病害早期检测试验中, 通常是先给作物叶片接种病原菌后离体培养, 在对样本图像实际采集与分析中, 都是选择在叶片接种出现病症后一次性进行高光谱检测, 所选叶片样本已经显现出肉眼可见病症, 并不能做到真正意义上的早期诊断[9, 10, 11], 同时也尚未对作物感染病害后的病状演变过程进行连续监测, 不能尽早发现感染状态。 针对现有研究存在的不足, 本试验通过高光谱图像连续动态监测样本的病程演变, 基于样本光谱特性对潜育期最早可识别时间进行判别, 以期揭示病害潜育期光谱特性的演变规律。
以辣椒叶片为研究对象, 通过高光谱成像仪连续动态监测离体辣椒叶片早疫病的侵染情况并获取对应的高光谱图像。 选取整个叶片表面为感兴趣区域, 并提取感兴趣区的平均光谱, 获取不同采集时间的健康与接种样本平均光谱曲线。 采用光谱角余弦-相关系数测度结合光谱距离(切比雪夫距离)检测光谱曲线的相似性用于早疫病潜育期最早可识别时间的判定, 从而得到早疫病潜育期的最早可识别时间。 利用主成分分析对比该时间健康-接种样本的空间分布情况对模型结果进一步验证, 最终确定早疫病潜育期最早可识别时间。
试验方案主要分为4个阶段: 样本制备与图像采集、 光谱数据预处理、 病害潜育期光谱特性判别方法建立以及模型验证, 流程如图1所示。
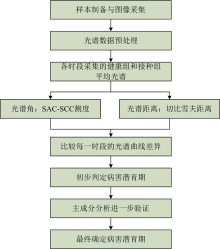 | 图1 基于光谱特性的作物病害潜育期高光谱图像判别流程图Fig.1 Flow chart of hyperspectral image discrimination for latent period of crop diseases based on spectral characteristics |
采用时序跟踪法对健康组与接种组叶片连续采集高光谱图像。 根据作物感染发病的不同时段, 拍摄时间间隔分别设置为12和24 h。 为了建立病害潜育期光谱特性判别方法, 创新性地提出将光谱角与光谱距离作为判定作物病害潜育期最早可识别时间的评价参数, 利用光谱特性判别辣椒早疫病潜育期最早可识别时间。
选取的辣椒品种为线椒, 将辣椒幼苗置于恒温恒湿的室内培养至开花期。 为了保证在试验过程中辣椒叶片具有均一性, 选取植株上冠层中健康正常、 大小形状相近、 表面光洁无污染叶片为试验样本, 共采集辣椒叶片120片。
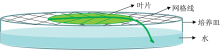
辣椒茄链格孢菌由北纳生物菌种平台购得。 对叶片样本同时采用菌丝刮伤和孢子悬浮液喷洒以确保样本成功接种。 为了模拟早疫病易感环境, 试验室培养温度控制在28~30 ℃。 为了防止在离体培养过程中叶片表面残留水分影响高光谱图像采集效果, 采用了以下叶片离体保鲜培养方案, 如图2所示。
叶片放置于带有细线编织网格的培养皿上, 培养皿中注入适量水分以对叶片进行保湿保鲜。 将叶柄伸至水中并在培养皿上加盖以到达更好的保湿效果, 同时避免水分对叶片表面造成图像采集干扰。
遵循作物病害侵染的一般过程, 为了使得监测图像覆盖整个病害潜育期, 高光谱图像实行连续动态采集。 试验所用高光谱成像仪(GaiaField-F-V10, 双利合谱科技有限公司, 中国四川)波长范围为400~1 000 nm, 空间分辨率为696像素× 1 313像素, 光谱分辨率为3.5 nm。 叶片接种前, 先对所有辣椒叶片正面进行一次高光谱数据采集。 前期拍摄每隔12 h将叶片取出采集一次高光谱图像, 直至接种组辣椒叶片中80%以上的叶片出现肉眼可见的病斑; 再调整拍摄时间间隔为24 h继续拍摄2~3次, 以便将叶片早疫病显著发病期的病状与潜育期病状进行对比。 对于整个拍摄过程中的高光谱图像按照统一命名标准进行归档整理。 其中, 首次图像采集在接种前进行, 定义此时采集的时间为0 h, 采集后立即接种, 然后按照拍摄时间对图像进行顺序标注。 为了避免其他病菌感染对采集高光谱图像造成干扰, 在秧苗来源、 菌种培养、 接种感染、 样品采集等试验过程的每个环节都保持稳定的实验条件以避免其他因素的干扰, 尽量保障单一病菌的接种感染。
高光谱数据的提取通常基于感兴趣区域(region of interest, ROI)进行分析。 本工作的感兴趣区域是指拍摄图片中去除背景后的整个观测叶片区域。 考虑到早疫病病斑的空间不规则性, 对于健康组和接种组的辣椒叶片均选择整个叶片区域为 ROI提取其平均光谱。 在高光谱图像中, 找出辣椒叶片光谱反射率和背景光谱反射率差异最大的波段, 然后设定一个光谱反射率阈值, 令小于阈值的光谱反射率设为0, 达到去除背景的目的。 感兴趣区域的选择主要分为3个模块, 具体流程如图3所示。
为了综合考虑整个叶片在接种前后的光谱变化, 将整个叶片在400~1 000 nm 光谱范围内的光谱反射率按256个波段分别取平均后, 得到整个叶片的平均光谱曲线, 有效减少叶片表面的偶然误差。
由于受到外界环境、 设备电流、 样本不均匀等干扰的影响, 样本原始光谱起止波段的信噪比较低。 为了提高后续数据处理的有效性, 先采用SG-MSC-MMN进行光谱预处理降低噪声和光散射对光谱数据的影响, 并对光谱进行归一化处理便于后续建模。
为了便于观察在连续动态监测过程中健康组与接种组叶片样本的平均光谱反射率变化, 绘制了经过预处理后的健康组和接种组叶片样本在0、 12、 24、 36、 48、 60及72 h的平均光谱曲线, 具体如图4所示, 其中, (a)为健康组, (b)为接种组。
 | 图4 健康与接种样本的平均光谱随时间的演变趋势 (a): 健康组; (b): 接种组Fig.4 The evolution trend of the average reflectance spectra of healthy and vaccinated samples (a): Healthy group; (b): Inoculation group |
从图4(a)可以看出, 随着时间推移, 健康组辣椒叶片平均光谱曲线在760~1 000 nm范围内存在明显分离, 叶片的平均光谱反射率整体逐渐下降, 主要由于叶片在离体培养后导致细胞代谢缓慢, 出现失水现象。 健康组叶片在其他波段范围内的整体光谱曲线较为密集重合, 说明在动态监测期间内, 健康组叶片生理状态较为稳定。 图4(b)接种组叶片在500~670、 680~760及760~1 000 nm波长范围内的平均光谱曲线存在明显差异, 表明随着接种时间的推移接种组叶片的生理活性一直波动, 在一定程度上也说明了接种的有效性。 其中, 接种叶片光谱曲线随着采集时间在500~670 nm范围内逐步分离, 且平均光谱反射率逐渐增大, 主要是因为病原菌侵染导致叶片细胞中叶绿素、 叶黄素等色素含量下降, 对光的吸收减弱, 光谱反射率增加。 680~760 nm属于可见光与近红外区域的交接处, 为绿色植物的“ 红边” 位置, 是描述植物色素状态和健康状况的重要指示波段。 在该波段范围内, 植物的光谱反射率增长最快, 通常情况下, 植物生长状态越好, “ 红边” 位置会出现“ 红移” ; 反之, 则会“ 蓝移” , 此时可看出接种组样本随着接种时间的推移, “ 红边” 逐渐发生左移即“ 蓝移” 。 由图4可见, 与健康作物的平均光谱曲线相比, 感染植物的平均光谱曲线会发生不同程度的变化, 这为利用光谱特性进行作物病害潜育期最早可识别时间判别提供了可能性。 当然, 仅从样本在采集时段的平均光谱曲线整体变化趋势上无法直接得出病害潜育期最早可识别时间, 需要合适的测度方法对光谱曲线之间的差异性进行深度挖掘。
物质之间的本质差异可通过光谱曲线形状和幅度的差异来反映。 通常, 用光谱距离来表征光谱曲线的幅度差异, 用光谱角和相关系数来表征光谱形状的差异。 常用的光谱相似性测度包括欧氏距离(Euclidean distance, ED)、 光谱角(spectral angle mapper, SAM)及光谱角余弦(spectral angle cosine, SAC)等[12, 13, 14]。 然而传统的光谱匹配方法通常仅使用单一光谱相似性测度进行分类, 导致在比较光谱曲线相似性时存在信息单薄、 比较不够全面的缺陷。 因此, 考虑将两种或多种相似性测度结合以提高光谱匹配分类的精度[15]。
光谱角(spectral angle metric, SAM)是一种最具代表性的光谱相似性度量方法, 通过计算光谱向量间的夹角来描述光谱整体波形的相似程度, 夹角越小, 则表明相似度越高。 该方法现已集成到ENVI软件中, 并广泛应用于遥感影像中的光谱精细填图[16, 17]。
对于测试光谱(像元光谱)与参考光谱而言, 光谱角的计算为式(1)
式(1)中, r为参考光谱, 在本试验中参考光谱为接种样本的平均光谱; t为像元光谱, 指健康样本的平均光谱; ti和ri分别代表像元光谱和参考光谱中第i波段的光谱反射值; n为光谱曲线波段数, α 为所求夹角。 α 越小, 代表与参考光谱的匹配越紧密, 相似性越高, 则判为同种类别的可能性更高。
在光谱角的基础上, 将光谱向量间广义夹角的光谱角余弦测度和光谱曲线整体形状的光谱相关系数测度结合形成光谱角余弦-相关系数(spectral angle cosine-spectral correlation coefficient, SAC-SCC)测度。 由于相关系数测度的计算公式涉及两条光谱曲线不同波段反射值之间的运算, 为了简化公式, 设x和y为不同像元的n维光谱向量, xi和yi为光谱向量第i波段的值, 则光谱角余弦测度的计算公式为式(2)
光谱相关系数用于描述两个向量之间的组构相似性。 设xi和xj为两条不同的光谱曲线, 其光谱反射率平均值分别为
其中, n为波段数。
则光谱曲线之间的相关系数rij可以表示为式(5)
相关系数测度r的计算公式为式(6)
光谱角余弦cosα 和相关系数r的取值范围均为[0, 1], 聚类原则同样都是“ 数值越大, 光谱曲线越相似” 。 两种测度有着相同的取值范围和聚类原则, 为了减少计算量, 分别赋以相同的权重, 采用算数平均组合两种相似性测度, 形成光谱角余弦-相关系数测度, 如式(7)所示
光谱角余弦-相关系数测度的取值范围为[0, 1], 聚类原则为“ 数值越大, 光谱曲线越相似” 。 光谱角余弦-相关系数测度联合了几何空间测度和概率空间测度, 有效提高了光谱匹配分类的精度。
根据式(7)计算出不同时段(T)接种组样本平均光谱曲线光谱角余弦-相关系数值(SAC-SCC), 如表1所示。 表中从上至下, SAC-SCC值呈现逐步减小趋势, 说明随着接种时间的延长, 接种样本的区分度逐渐增大, 这也说明了接种的有效性。 为了降低接种前健康组与接种组的原始样本自身差异性带来的干扰, 计算接种前(0 h)的健康组样本与接种组样本的SAC-SCC值为0.988 8, 并以此作为评价光谱相似性的参数, 即光谱角余弦-相关系数值≥ 0.988 8, 判定两条光谱曲线相似; 反之则存在明显差异。 其中, 通过比较接种0 h即未接种的样本与连续监测时段的接种样本平均光谱曲线, 发现在接种后24 h时, 二者平均光谱曲线的SAC-SCC值为0.973 0, 光谱曲线存在明显差异。 而在该时段的前后采集时间即12和36 h, 样本的平均光谱曲线SAC-SCC数值分别为0.988 1和0.959 7, 处于基本相似和存在显著差异状态, 而24 h处于中间临界状态。 而接种12与24 h的平均光谱曲线SAC-SCC值为0.992 6, 属于高度相似, 说明样本在接种24 h内, 病菌侵染初期的活动十分微弱, 通过肉眼难以捕捉到病害感染的相关信息; 随着接种时间的推移, 病原菌的侵染程度在逐渐增强, 接种12和36 h的平均光谱曲线的SAC-SCC值为0.977 6说明二者存在明显区别。 因此样本在接种后, 病菌侵染潜育期最早可识别时间锁定在24 h。
| 表1 光谱角余弦-相关系数(SAC-SCC)随时间(T)的变化关系(接种组) Table 1 The relationship between spectral angle cosine correlation coefficient (SAC-SCC) with time (T) (inoculation group) |
切比雪夫距离(Chebyshev distance, CD)是向量空间中的一种度量, n维空间里点x与y之间的切比雪夫距离定义如式(8)所示
式(8)中, L∞ (x, y)将两个n维向量之间的距离定义为其各坐标数值差绝对值的最大值。 根据式(8)计算得到不同时段接种组样本平均光谱曲线的切比雪夫距离, 结果如表2所示。
| 表2 切比雪夫距离L∞ 随时间(T)的变化关系(接种组) Table 2 The relationship between Chebyshev Distance (L∞ ) with time (T) (Inoculation group) |
表2从左至右, 随着接种时间的推移, 相邻时段样本平均光谱曲线的切比雪夫距离(L∞ )整体呈现逐渐增大趋势, 说明病菌侵染的程度也在逐渐加强。 其中, 样本接种0与12、 24、 36、 48以及60 h的平均光谱曲线的L∞ 分别为0.244 8、 0.231 4、 0.226 4、 0.210 0及0.311 8, 说明利用L∞ 作为测度方法进行光谱曲线测量时, 显示在接种48 h内, 样本处于感染初期状态。 而进一步比较接种12与24、 36及48 h, L∞ 分别为0.151 0、 0.239 3及0.264 0, 其中接种24与36 h的平均光谱曲线的L∞ 存在明显差异, 此后又逐渐趋于平缓。 因此利用L∞ 进行光谱曲线相似性测量时, 接种24 h为判断光谱差异的转折点, 同样可视作病害侵染的潜育期最早可识别时间。
同时, 采用SAC-SCC和L∞ 这两种评价方法分别计算了12~168 h的健康组样本与0 h的健康样本的光谱曲线差异, 结果如表3所示。 从表3可以看出, 随着培养时间的递增, 健康组叶片在12~168 h的SAC-SCC和L∞ 数值与0 h的SAC-SCC和L∞ 数值的整体差异并不显著。 其中SAC-SCC数值在0~72 h均≥ 0.980 0, 且相邻时段的差值较小, 说明健康组叶片一直处于稳定的生理状态; 由于叶片离体培养容易失水, 在72 h以后, SAC-SCC数值逐渐减小, 与0 h的叶片差异性逐渐增大。 同时比较叶片在12~168与0 h的L∞ 值, 也能基本反应此变化趋势, 进一步验证了这两种判别方法的有效性。
| 表3 光谱角余弦-相关系数和切比雪夫距离随时间(T)的变化关系(健康组) Table 3 The relationships between SAC-SCC and chebyshev distance with time (T) (health group) |
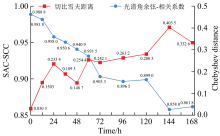
样本在离体状态下培养, 叶片自身活性除了受到病原菌侵染的影响, 也可能受到环境因素的影响。 因此进一步计算基于光谱角余弦-相关系数和切比雪夫距离作为测度在采集时段中健康-接种样本的平均光谱在可见光波段范围下(392.53~760.68 nm)的相似度, 并绘制了健康-接种样本平均光谱曲线的光谱角余弦-相关系数和切比雪夫距离随采集时间变化趋势图, 如图5所示。
从图5可以看出随着采集时间的延长, SAC-SCC测度整体呈现逐步减小趋势, 说明随着接种时间的推移, 健康组与接种组样本的差异性在逐步增大, 光谱曲线在可见光波段范围内呈现明显分离趋势。 接种12 h时, 健康-接种样本的SAC-SCC值为0.981 8> 0.980 0, 此时健康-接种样本的平均光谱曲线趋近一致。 在24 h时, 健康-接种样本的SAC-SCC值为0.958 0< 0.980 0, 健康组与接种组样本的差异开始显现。 此后健康-接种样本的光谱角余弦-相关系数不断下降, 健康组与接种组的平均光谱曲线差异逐步增大。
根据健康-接种样本的平均光谱曲线的L∞ 变化趋势可以看出, 接种12 h以后, L∞ 表征的接种组平均光谱变化显著, 说明了接种的有效性; 在12~24 h时段, 接种组平均光谱的L∞ 呈现明显上升趋势, 结合病原微生物入侵的微观机理进行分析, 可能是茄链格孢菌正在缓慢入侵叶片; 在24~48 h时段, 接种组L∞ 呈现下降趋势, 主要由于随着茄链格孢菌的侵染, 叶片表面细胞的破坏程度加深, 其光合作用和蒸腾作用也受到较大的影响, 叶片自身愈伤抵御机制在增强。 在48 h以后, 接种组L∞ 基本呈平缓上升态势, 说明叶片细胞结构受到病原菌的严重破坏, 叶片色素含量显著降低, 加上叶片离体培养一段时间后, 叶片生理活性减弱造成叶片光谱反射率明显增大, 导致接种样本与健康样本在平均光谱曲线上的差异逐渐增大。 由此变化趋势可初步判定24 h为辣椒遭受早疫病侵染后的潜育期最早可识别时间。
综合SAC-SCC和L∞ 两种测度方法的结果, 初步判定24 h为辣椒早疫病潜育期最早可识别时间。 在后续数据处理中, 将主要围绕接种后24 h这一时间点展开进一步分析, 并用于检测识别模型的建立。
为了进一步对辣椒早疫病潜育期光谱判别方法的判定结果进行验证, 根据SAC-SCC和L∞ 两种判别方法得出的结果, 结合接种组样本在0~60 h的接种组叶片RGB图像, 同时利用主成分分析对连续采集时段的健康组与接种组叶片样本进行分布可视化, 如表4所示。 从表4中可以比较得出仅凭人眼是无法直观判断叶片是否染病的, 因此也在一定程度上说明基于光谱特性提出的两种测度方法对作物病害潜育期判别的必要性。 通过对接种后不同时段进行样本数据分布可视化, 得到接种后0~60 h的健康和接种叶片样本的PC1、 PC2和PC3的主成分分析图。 为便于直观比较分析, 将三维散点图的角度均调为一致。 从表4中可以看出随着时间推移, 健康与接种样本从初期空间分布较为均匀分散, 无法将二者区分到接种组样本开始定向聚集, 逐步呈现与健康样本明显可分趋势。 其中, 在接种12 h时健康与接种样本均呈分散状且存在大面积重叠, 无法将二者区分; 24 h时接种组样本逐渐聚集, 与健康组样本开始出现一定的分离趋势, 说明在0~24 h这一时段开始, 健康和接种的辣椒样本开始出现一定的差异; 而在36 h, 健康与接种样本的分离状态出现起伏, 可能是因为接种组样本感染病害出现一定的波动; 往后随着病原菌的不断侵染, 接种样本开始定向聚集, 健康组样本基本无明显变化, 健康与接种组样本逐渐可分, 进一步验证了将24 h作为辣椒样本早疫病潜育期最早可识别时间从而建立相应判别方法的可解释性。
| 表4 样本RGB图像和主成分分布可视化图像随采集时间的变化 Table 4 RGB images and principal component distribution visualization images over collection time |
在健康-接种叶片样本主成分分布可视化的基础上进一步得到接种24 h时, 样本前10个主成分的病害信息分布情况, 接种24 h时的样本前10个主成分的方差贡献率, 如图6所示。
 | 图6 接种24 h样本PC1— PC10的方差贡献率Fig.6 Variance contribution rate of PC1 to PC10 for samples inoculated for 24 h |
从图6中可以看出样本在接种后24 h时前三个主成分的累积方差贡献率达到99.32%, PC4的累积贡献率为99.70%, PC10的累积贡献率为99.80%, 累积贡献率增幅减小并逐渐趋于平稳, 这说明前三个主成分解释了原数据绝大多数的变量信息。
为探究基于光谱特性的辣椒早疫病潜育期高光谱图像判别方法, 提出通过结合光谱角余弦-相关系数测度和切比雪夫距离两种测度方法进行样本平均光谱曲线的相似性测量, 从而建立辣椒早疫病潜育期光谱特性判别方法。 通过试验可得到以下结论:
(1)试验分别从光谱角余弦-相关系数与切比雪夫距离两个测度对不同采集时段的健康和接种辣椒样本进行潜育期判定, 根据两种方法建立的辣椒早疫病潜育期判别方法, 初步判定接种24 h为辣椒早疫病潜育期最早可识别时间。
(2)结合PCA主成分分析, 提取了接种24 h光谱数据的前3个主成分, 累积贡献率达到99%以上, 可以解释原数据绝大多数的变量信息。 将得到的前3个主成分绘制得到了样本的三维空间可视化分布图, 发现24 h时健康和接种的辣椒样本重叠较少, 存在明显可分趋势, 进一步验证了潜育期最早可识别时间判别方法的可信度。 证明基于高光谱成像技术采用光谱角余弦-相关系数和切比雪夫距离两种测度方法进行作物病害潜育期最早可识别时间判定的可行性。
建立的辣椒早疫病潜育期光谱特性判别方法可推广应用于其他作物病害潜育期最早可识别时间的的监测, 为作物病害潜育期科学预警与及时防治提供理论参考与方法借鉴。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|