作者简介: 汪德颖, 2000年生,北京工业大学环境与生命学部硕士研究生 e-mail: 1244593082@qq.com
表面增强拉曼光谱(SERS)具有超高灵敏度、 指纹信息、 少量样本和无损检测等独特优势, 设计和制备具有优异重现性和稳定性的SERS基底是实现SERS检测技术进一步发展的关键因素。 水凝胶是一种新型的封装材料, 其交联聚合物网络具有能够保留大量水分的三维分层结构, 并且对杂质具有良好的阻隔作用和强大的抗干扰能力。 水凝胶SERS基底具有低成本、 高灵敏度、 快速检测、 高通量等诸多优点, 在这篇综述中, 主要从SERS基底研究进程, 水凝胶SERS基底优点, 水凝胶SERS基底在食品、 生物、 环境检测领域的应用三个方面进行综述, 以期为水凝胶SERS基底制备提供新的参考。 首先, 针对SERS基底研究进程, 早期的固定金属纳米粒子(MNPs)刚性固态基底中, MNPs倾向于氧化和聚集, SERS基底重现性差, 无法对表面粗糙样品进行分析; 柔性支撑材料上修饰MNPs的SERS基底中, MNPs检测过程中容易分离, SERS基底灵敏度和稳定性差。 为获得具有良好均匀性和稳定性的SERS基底, 将水凝胶与等离子体纳米结构结合, 水凝胶作为MNPs的保护层为SERS分析提供了可靠的尺寸和电荷选择性, 同时保持了高渗透性。 其次, 水凝胶SERS基底可以无需样品预处理对待测物实现原位检测, 生物相容性复合水凝胶可以直接体内检测, DNA水凝胶可以精确识别, 修饰多重抗体的水凝胶可以同时检测多种分析物, 可调网孔尺寸的微凝胶对目标物具有选择筛分作用, 三维纳米结构的水凝胶提供更多吸附热点。 目前, 制备的水凝胶SERS微粒、 芯片、 贴片等在食品安全、 生物医药, 环境监测的现场痕量分析方面显示出巨大的潜力。 综上, 水凝胶SERS基底的制备具有很好的发展前景, 能够为今后的分析检测领域提供新的借鉴。
Surface-enhanced Raman spectroscopy(SERS) has unique advantages such as ultra-high sensitivity, fingerprint information, small samples, and non-destructive detection. The design and preparation of a SERS substrate with excellent reproducibility and stability are key factors in the further development of SERS detection technology. Hydrogel is a new type of encapsulation material; its cross-linked polymer network has a three-dimensional layered structure that can retain a large amount of water and has a good blocking effect on impurities and strong anti-interference ability. Hydrogel SERS substrate has many advantages, such as low cost, high sensitivity, rapid detection, and high throughput. In this review, the research process of SERS substrate, the advantages of hydrogel SERS substrate, and the application of hydrogel SERS substrate in the field of food, biology, and environmental detection are mainly reviewed to provide a new reference for the preparation of hydrogel SERSsubstrate. First, for the SERS substrate research process, early fixed metal nanoparticles(MNPs) rigid solid substrate, precious MNPs tend to oxidate and aggregate. SERS substrate has poor reproducibility, so it cannot analyze the surface rough samples. In the SERS substrate with MNPs modified on the flexible support material, MNPs are easy to separate in the detection process, and the sensitivity and stability of the SERS substrate are poor. The hydrogel is combined with a plasma nanostructure to obtain a SERS substrate with good uniformity and stability. Hydrogel, as the protective layer of MNPs, provides reliable size and charge selectivity for SERS analysis while maintaining high permeability.Furthermore, hydrogel SERS substrate can achieve in situ detection of the target without sample pretreatment, biocompatible composite hydrogels can be directly detected in vivo, and DNA hydrogel substrate can be accurately recognized, hydrogel modified with multiple antibodies allow for the detection of multiple analytes simultaneously, microgel with adjustable mesh size have a selective sieving effect on the target, and 3D nanostructured hydrogel provides more adsorption hotspots. The prepared hydrogel SERS particles, chips-, and patches show great potential for on-site trace analysis in food safety, biomedicine, and environmental monitoring. In conclusion, preparing hydrogel SERS substrates has good development prospects and can provide new references for future analysis and detection fields.
表面增强拉曼光谱(surface-enhanced Raman spectroscopy, SERS)作为一种新型的痕量分析技术, 具有灵敏度高, 选择性好, 高通量和快速响应, 检测方便快捷等优势, 已经被广泛应用于食品安全[1], 生物医学[2], 环境有害污染物检测[3]等领域。 随着材料化学和仪器技术的发展, 特别是近10年来对痕量检测的需求不断增加, SERS技术已成为研究的热点之一。 然而, SERS在定量分析中存在较大的偏差, 这严重限制了SERS技术的应用。 因此, 提高SERS在定量分析中的可靠性尤为重要。 SERS基底是影响定量分析中可靠性的主要原因之一。 SERS检测要求将目标分子吸附在SERS基底的表面上, 在吸附时, 由于SERS基底的物理和化学增强作用, 目标分子的拉曼信号可以显著放大。 目前开发的SERS基底主要分为固态和柔性基底, 其灵敏度和稳定性有待提高[4]。 近年来, 有人提出将SERS活性材料与水凝胶结合, 有望获得具有良好均匀性和稳定性的SERS基底, 这是SERS进行可靠定量分析的必要条件, 并在各个检测领域显示出巨大潜力。
水凝胶是由水溶性或亲水性高分子通过物理交联法或化学交联法形成的具有三维网络结构的聚合物[5]。 物理交联法通过静电相互作用[6]、 氢键[7]、 疏水相互作用[8]形成, 化学交联法通过自由基聚合[9], 希夫碱反应[10], 迈克尔加成反应[11]等形成。 水凝胶具有良好的溶胀性[12]、 生物相容性[13]、 环境响应性[14], 类似于软组织细胞外基质[15]等特性, 广泛应用在组织工程、 药物缓释、 伤口敷料等方面[16]。 水凝胶的表面含有羟基、 羧基、 氨基和酰胺基, 易于与生物识别基团进行表面修饰, 可以与适配体组装用于靶标检测[17]。 水凝胶的高孔隙、 网孔尺寸和电荷可控以及亲水性在分子捕获和过滤系统中显示出巨大的潜力, 可以用于水净化、 超级电容器、 生物体液如血液和唾液复杂系统中违禁药物的痕量检测[18]; 水凝胶优异的吸水性和较强的保水性能可以作为可穿戴传感器汗液采样基质[19]; 水凝胶具有诱导聚合物网络反应的性质, 在固体状态中容易快速形成特定反应体系的边界, 可以用于制造高便携式探针[20]。
SERS是吸附在粗糙金属(如金、 银、 铜等)纳米结构表面的分子在光照射下, 其拉曼光谱获得显著增强的异常表面光学现象。 自1974年Fleischmann等首次发现吡啶吸附在粗糙的银电极表面的拉曼散射异常增强后, 人们提出了各种物理和化学增强机制来解释SERS机制, 其中电磁增强(electromagnetic enhancement, EM)和化学增强(chemical enhancement, CE)是目前公认的两种增强机制, EM增强占主导地位, 局部电磁场增强通常称为“ 热点” , 常在较尖锐的棱、 角或曲率较大的纳米粒子间隙中, 其局部电磁场增强因子高达1010的“ 热点” , 通常SERS传感的增强效应是这两种机制协同作用[21]。
SERS基底对SERS信号的影响十分显著, 制备高性能的SERS活性基底关键在于获得更多“ 热点” 和调控“ 热点” 的分布。 一般主要在基底上组装或生长等离子体金属纳米结构, 如银(Ag)和金(Au)纳米颗粒。 在光激发下, 金属纳米粒子(MNPs)产生表面等离子体激元共振, 作为电磁“ 热点” , 通过吸附分析物在这些位点显著增强拉曼信号[22]。 早期的SERS基底主要以Ag和Au纳米颗粒的胶体溶液形式存在[23], MNPs的固定可以通过静电相互作用、 化学附着、 毛细管力或预组装MNPs直接转移在固体基底上进行[24, 25]。 然而在刚性固态基底如玻璃和硅片中, MNPs倾向于氧化和聚集, 导致SERS重现性较差。 另一方面, 刚性固态SERS基底在面对复杂的实际检测环境时, 无法对表面粗糙的样品进行分析, 固体表面的信号分子由于接触面积较小而不能实现有效检测[26]。
近年来, 研究人员研究了不同的柔性材料如纸、 滤纸、 织物等[27]。 柔性SERS基底具有以下优点: 通过在粗糙表面上包裹或擦拭取样, 对各种分析物进行无损和灵敏检测, 有助于检测物质表面的污染物。 柔性复合SERS基底还具有机械性能优异、 形状多样、 易处理、 便携、 价格低廉等优点。 目前报道的柔性SERS基底的制备方法主要通过浸涂和过滤将预合成的MNPs修饰到柔性材料表面[28]。 然而, 制备的复合基底中MNPs与柔性材料的连接较弱, MNPs在检测过程中容易从柔性基底上分离出来。 此外, MNPs的分散性也受到限制。 因此, 该类SERS基底的灵敏度和稳定性较差。
通过在一层封闭包装的纳米颗粒上沉积金属薄膜制备的纳米球金属薄膜(MFONs)是SERS基底主要结构之一[29]。 其他纳米光刻的方法如电子束制备的压印纳米结构图案[30]和聚焦离子束(FIB)制备的纳米孔阵列[31], 这些SERS基底与MFONs类似, 具有良好的重现性、 均匀性以及一致的热点[32], 但是其相对缓慢、 复杂的制造程序和高成本阻碍了该SERS基底的应用。
有研究人员提出将新兴的等离子体纳米结构与水凝胶结合, 通过水凝胶的体积膨胀或收缩来精确地控制水凝胶基底上等离子体金属纳米结构的热点, 有望获得具有良好均匀性和稳定性的SERS基底。 使用水凝胶作为金属纳米结构的保护层为SERS分析提供了可靠的尺寸和电荷选择性, 同时保持了高渗透性。 单个MNPs或其附聚物可以封装在水凝胶微粒的基质中, 防止金属表面的污染, 同时允许目标分子的快速扩散。 Ansah等[33]制备的3D AuNPs水凝胶基底和Lee等[34]制备的3D聚亚酰胺纳米柱水凝胶基底, 目标分子通过水凝胶网络扩散并在金属纳米间隙中被捕获, 很好地分布在高度堆积的MNPs的间隙中, 但是制备过程繁琐, 需要用四氟化碳和氩等离子体处理。 基于水凝胶的SERS基底还具有低成本、 便携性、 简单性和灵活性的优点, 符合对实用SERS基底的需求。 实际应用中, 分析物通常存在于粗糙、 弯曲或非平面表面上, 采用传统的固态或柔性SERS基底, 需要使用适当的溶剂进行额外提取, 而水凝胶基底可以不需要样品收集、 预浓缩和转移步骤对待测物实现原位检测。 Wu等[35]通过硼氢化钠还原了均匀分散在聚乙烯醇(PVA)网络中的Ag+离子, 采用浸渍法制备了PVA-AgNP水凝胶。 与常规SERS底物如胶体悬浮液相比, PVA-AgNP水凝胶对结晶紫(CV)具有突出的拉曼增强效果, 检测限为1× 10-12 mol· L-1。 目前应用在SERS中的水凝胶有壳聚糖, 琼脂糖, 明胶[36], 再生纤维素[37], 聚丙烯酸[38], 聚丙烯酰胺[39]等, 如表1所示。
| 表1 应用在SERS中的不同类型水凝胶 Table 1 Different types of hydrogels applied in SERS |
据报道, 生物相容性纳米复合水凝胶可以直接用于体内检测。 Park等[41]制备了嵌入MNPs的琼脂糖水凝胶SERS生物贴片, 实现了对低拉曼活性小分子神经递质γ -氨基丁酸和淀粉样蛋白的高灵敏检测。 此外, 生物相容性纳米复合水凝胶可以有效地将等离子体材料与外部环境以及基质本身分离, 控制底物的进入, 实现在样品收集后对生物标志物的直接测定, 进而作为传感器应用基础。 You等[42]基于4-巯基苯甲酸(MBA)-AuNPs和葡萄糖氧化酶(GOX)封装在碳酸钙微粒中, 制备了聚电解质多层膜包被的pH感应水凝胶和酶蒂葡萄糖感应水凝胶, pH感应水凝胶可用于监测pH 4.43~8.07范围内的生物样本和体内组织, 酶促葡萄糖感应水凝胶在360 min孵育时间内可以监测0~400 mg· dL-1葡萄糖浓度变化。 Wang等[19]基于磺化纤维素纳米复合水凝胶(S-CNF-AgNPs/PAA)开发了一种可穿戴SERS传感器, 可以检测汗液中低至63.1 μ mol· L-1的尿素和3.98 μ mol· L-1的尿酸, 准确感应人体运动后pH 5.5~7.0范围内的汗液。 Parnsubsakul等[43]开发了环保的AgNP-细菌纳米纤维素(BNC)水凝胶SERS基底, 通过简单粘贴在橘子和苹果果皮上实现对农药灭多威的原位SERS分析。 通过互补DNA链之间的分子杂交反应或DNA链之间的交联形成的DNA水凝胶具有结构可设计性和精确的分子可识别性的优点。 Chen等[44]尝试了采用圆形挂锁探头(CCP)结合连接滚动圆扩增(L-RCA)识别目标方法组装DNA水凝胶, 捕获含间隙核壳等离子体纳米颗粒和磁珠, 定量检测1 pg· L-1~10 ng· L-1范围的卡那霉素, 最低检测限(LOD)为2.3 fmol· L-1。 值得关注的是, 多种MNPs结合到聚合物上的研究还很少, Manikas等[45]首次提出了用两种金属Au和Ag纳米颗粒静电吸附在偶联ss-DNA的热响应聚N-异丙基丙烯酰胺(PNIPAAm)水凝胶表面上, 这表明通过不同生物分子特异性识别水凝胶表面上的不同金属, 完成多重传递和释放生物成分的可行性。 针对目前同时检测多种分析物的局限性和挑战, Liu等[46]提出了一种修饰多重抗体探针的多孔水凝胶珠结合SERS纳米标签实现多重蛋白质生物标志物分析, 这种多孔结构不仅有利于待测物的进入, 而且暴露更多的水凝胶内表面, 从而增强了表面积体积比, 对甲胎蛋白和癌胚抗原两种生物标志物分析, 两者线性动态范围(LDRs)涵盖10 pg· mL-1~10 μ g· mL-1。
对于复杂生物体液样品中小分子的直接检测, 具有可调网孔尺寸的微凝胶对目标物具有选择筛分作用。 Lin等[47]合成金纳米双锥体(AuNBP)@Ag-透明质酸微凝胶, 无需任何预处理过程即可直接检测人血清中的6-硫鸟嘌呤(6-TG)。 为克服微凝胶基质中MNPs局部聚集导致的拉曼强度不均匀分布限制, Kim等[48]通过微流控方法获得高度浓缩且均匀分散的AuNPs微凝胶。
与一维、 二维SERS基底相比, 三维纳米结构的水凝胶SERS基底可实现多维表面等离激元耦合, 在3D体积内, 最大的平均场增强, 通过浓缩分析物, 提供更多吸附热点, 提高了SERS信号的生成和收集, 具有更高的检测灵敏度。 他们[49]制备了三维等离子体聚乙烯醇(PVA)-Ag水凝胶, 在3D网络中监测到一个超过100 μ m的宏观有效深度, Ouyang提出有效深度(H)概念抢估三维水凝胶基底SERS强度, H是从表面平面到表现出最高SERS强度的深度, SERS强度与水凝胶切片的厚度有关, 厚度小于H时, 由于没有足够的AgNPs产生SERS信号, SERS强度低于饱和强度。 当基底足够厚时, 有效体积外的较深空间不会对信号产生影响, SERS强度达到饱和。 Wang等[50]制备3D壳聚糖泡沫(CF)-Ag水凝胶, 用于从固体表面和溶液中主动收集分析物, 但是由于SERS底物孔隙大而对MNPs的负载和探针分子的吸附效率低下。 基于此, Feng等[51]制备了AgNPs修饰的高孔隙率和高比表面积3D壳聚糖气凝胶(CAA), 通过对CAA骨架结构调整实现超灵敏检测。
SERS由于检测灵敏度高、 速度快、 无损取样等优点, 已经被广泛应用在食品、 生物、 环境检测等诸多领域。
在食品领域, SERS技术可以用于高效迅速便捷的监测食品中的农药残留、 非法添加剂、 抗生素等物质。 Sun等[52]利用微流体液滴平台开发了一种通用的SERS-MNPs水凝胶微粒, 用于对复杂样品全血中的小分子葡萄糖和牛奶中的三聚氰胺检测。 全血中葡萄糖的LOD为10 μ mol· L-1, 牛奶中三聚氰胺的LOD为10 nmol· L-1。 Chang等[53]制备AgNPs@琼脂(Agar)复合水凝胶SERS基底检测新疆骆驼奶粉中的痕量三聚氰胺和青霉素G钠, LOD分别为10-8和10-9 mol· L-1。 Hu等[54]制备Au@Ag纳米棒(AgNRs)-羧甲基纤维素(CMC)水凝胶SERS芯片, 用于对苹果和蓝莓等含量低、 丰富色素干扰物水果中福美双残留检测, LOD分别为0.058和0.078 mg· kg-1, 储存9个月后的SERS芯片显示出原始SERS强度的80.4%。 Wang等[55]构建了DNA水凝胶SERS传感器检测食品中的链霉素, 存在链霉素时, 链霉素和适配体之间的特异性相互作用破坏Pb2+诱导的G-四联体结构, 释放游离的Pb2+激活Pb-DNAzyme, 导致SERS基底上DNA水凝胶裂解和4-巯基苯甲腈(4-MB)释放。 由吸附的4-MB引起的SERS信号与链霉素的数量成正比, 传感器处于ON状态, 产生强拉曼信号。 LOD为4.85× 10-3 nmol· L-1, 远低于中国和欧盟有关链霉素的规定343.9 nmol· L-1。
 | 图1 水凝胶SERS基底在食品检测中的应用 (a): 基于MNPs水凝胶微粒检测全血中的葡萄糖和牛奶中三聚氰胺[52]; (b): 基于AgNPs@Agar复合水凝胶检测三聚氰胺和青霉素G钠[53]; (c): 基于Au@AgNRs-CMC水凝胶芯片检测苹果和蓝莓中福美双[54]Fig.1 Application of hydrogel SERS substrate in food detection (a): Detecting glucose in whole blood and melamine in milk based on MNPs hydrogel microparticles[52]; (b): Detecting melamine and sodium penicillin G based on AgNPs@Agar composite hydrogel[53]; (c): Detecting thiram of apple and blueberry based on Au@AgNRs-CMC hydrogel chip[54] |
SERS可用于生物体液中低浓度药物分析物的快速、 高灵敏鉴定。 Almohammed等[56]使用3D打印获得灵敏、 可重复的芴甲氧羰基二苯丙氨酸(Fmoc-FF)水凝胶负载AgNPs或AuNPs SERS模板。 Fmoc-FF模板允许在低至100 pmol· L-1的浓度下检测低拉曼截面分子如腺嘌呤。 Ouyang等[57]通过分子识别策略和三维胶凝技术, 合成了一种包裹β -环糊精(β -CD)修饰的AgNPs的β -CD-Ag/PVA水凝胶SERS基底。 在便携式拉曼仪器上, 该基底用于磺胺类药物的痕量检测, LOD为10 ng· mL-1, 可以实现结构相似的磺胺类药物的鉴定。 基于此, Ouyang等[58]在后续实验中将其用于快速鉴定非法添加到减肥胶囊中的盐酸西布曲明(SH), LOD为3.0 μ g· mL-1。 Cao等[59]受超粘稠贻贝启发, 通过对丙烯酸、 壳聚糖、 没食子酸和氧化铝离子的简单调节, 合成了一系列具有不同形貌和力学性能的水凝胶, 对四种β 受体阻滞剂比索洛尔、 美托洛尔、 乙酰丁洛尔和艾司洛尔进行SERS化学计量学分析。 制备的水凝胶通过简单的“ 粘贴和剥离” 有效地收集分析物, 使用家用喷雾器喷洒AgNPs组装灵活的SERS基底, 分析物可以通过便携式拉曼光谱仪检测到。 SERS胶带用于模拟尿液中β 阻滞剂的识别, 实现了1.0 ng· mL-1的检测限, 表明基于SERS的即时检验(POCT)在临床检测兴奋剂滥用方面具有潜力。 Kim等[60]设计了一种新型纸基3D SERS水凝胶基底, 并结合一锅金电沉积, 用于快速直接检测铜绿假单胞菌在浑浊培养基中分泌的绿脓菌素(PCN)。 在将Au单锅电沉积到水凝胶封装的3D Au电极上的过程中, PCN的小目标分子被捕获在生长的小Au颗粒的间隙中, 显著增强SERS活性。 此外, 3D水凝胶皮肤促进Au纳米结构的形成, 并作为尺寸选择性分子过滤器, 排除培养基中不需要的大蛋白质分子。 LOD为0.56 μ mol· L-1, 实现了在复杂的细菌培养物中直接快速检测PCN, 而不需要任何纯化步骤。 对感染的早期诊断和细菌细胞通讯的深入研究具有重要意义。 Wang等[61]构建新型的甲胎蛋白(AFP)适配体响应型DNA凝胶中, 免疫球蛋白(Ig G)包埋在DNA水凝胶中, 存在AFP时, AFP适配体特异性识别AFP并形成靶-适配体复合物, 水凝胶网状结构解离, IgG从水凝胶中释放并被溶液中纳米探针捕获和磁性分离, 测定悬浮液中SERS信号获得待测样品中AFP含量, 该方法LOD为50 pg· mL-1。 此外, 通过特异性编码DNA水凝胶的核酸适配体序列能容易设计出对其他抗原有靶向响应的新型DNA水凝胶。
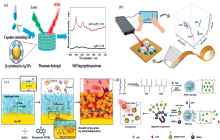 | 图2 水凝胶SERS基底在生物检测中的应用 (a): 基于β -CD-Ag/PVA水凝胶检测SH[58]; (b): 基于水凝胶胶带检测β 受体阻滞剂[59]; (c): 基于3D SERS水凝胶检测PCN[60]; (d): 基于DNA水凝胶检测AFP[61]Fig.2 Application of hydrogel SERS substrate in biological detection (a): Based on β -CD-Ag/PVA hydrogel detection for SH[58]; (b): Based on hydrogel tape detection for β -blockers[59]; (c): Based on 3D SERS hydrogel detection for pyocyanin[60]; (d): Based on DNA hydrogel detection for AFP[61] |
环境检测中, SERS技术可以用来检测环境中的有害物质如重金属、 甲醛、 农药等。 He等[62]通过DNA酶切割扩增策略, 开发出新型响应性DNA水凝胶SERS柔性生物膜, 对U
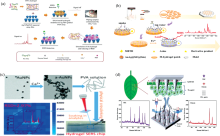 | 图3 水凝胶SERS基底在环境检测中的应用 (a): 基于DNA水凝胶检测 (a): Based on DNA hydrogel detection of U |
对近10年来水凝胶SERS基底检测研究进行了综述。 水凝胶SERS基底具有高度的灵敏性、 稳定性和可重复性, 基底上热点均匀集中, 信号增强效果显著, 水凝胶作为金属纳米结构的保护层, 避免干扰物的非特异性和不可逆吸附的污染, 帮助快速有效地捕获金属纳米间隙中的目标分子, 为SERS分析提供了可靠的尺寸和电荷选择性, 同时保持了高渗透性, 并且可以通过便携式拉曼光谱仪直接应用于一些复杂样品的定量分析, 而无需复杂的样品预处理, 在食品、 生物和环境即时检验等领域具有广阔的应用前景。 此外, 可拉伸性和高机械韧性的水凝胶可以用作传感器贴片, 作为可穿戴式传感设备基础; 用作无创植入生物组织光纤探针, 在生物医学中对代谢物进行多重检测; 用作智能抗菌软材料和生物支架, 应用在药物输送、 伤口愈合和组织工程。 尽管水凝胶SERS基底具有许多优势, 但也存在一些问题需要解决, 即提高SERS分析性能和批量制造水平。
水凝胶SERS基底分析性能仍需要在以下方面进行改进: (1)在目标尺寸引导下精准控制等离子体纳米材料的纳米间隙从而产生灵敏、 均匀、 高选择性增强信号; (2)增强水凝胶SERS基底对真实样品的抗干扰能力; (3)加大对同时检测多种分析物的水凝胶SERS基底研究。 在水凝胶SERS基底批量制造方面, 目前已有研究将墨水直写(DIW)-3D打印技术结合到水凝胶SERS基底制备的中以获得热点一致的基底, 但未来还需要简化基底的制备工艺和降低成本, 此外, 天然聚合物与等离子体纳米颗粒混合作为复合油墨材料打印3D SERS水凝胶支架, 在癌症生物标志物检测上显示出优良的生物传感特性。 针对手动控制创建SERS基底过程复杂, 步骤繁多, 重现性较差的弊端, 自动化和可编程的计算机控制微流体装置在制备一系列形状均匀、 可靠性和重复性强的SERS基底方面具有潜在的应用前景。
实现水凝胶SERS基底批量生产、 长存储时间、 商业一体化的集成, 对实际检测应用具有重要意义, 因此, 设计和制备具有优异性能的水凝胶SERS基底仍有待进一步研究。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|


