作者简介: 郭亚菲, 1993年生, 甘肃中医药大学药学院博士研究生 e-mail: guoyafei1993@126.com
对于中药材的质量控制研究是中医药现代化的主要研究内容之一。 唐古特大黄是一种常用中药, 目前对唐古特大黄的质量控制研究多集中在总蒽醌类成分、 游离蒽醌类成分以及指纹图谱, 基于抗炎效果的质量标准研究尚为少数。 采集不同产地、 不同采收时间的18批唐古特大黄药材, 对其粉末进行傅里叶变换红外光谱(FTIR)研究, 发现16个共有峰, 18批次之间具有较高的相似性(0.798~0.900), 相同产地(甘南产、 青海产)的唐古特大黄相似度较高(相似度大于0.900的达80%以上), 但两产地之间的相似度相对较低(相似度大于0.900的仅为69.44%), 结合聚类分析发现不同产地唐古特大黄FTIR谱图存在一定差异性, 产地可能是主要影响因素。 建立双指标分析序列, 可在一定程度上区分药材不同产地。 脂多糖(LPS)刺激RAW264.7细胞建立炎性细胞模型, 以NO抑制率作为炎性指标, 测定不同批次唐古特大黄的NO抑制率。 以共有峰透过率作为 X, NO抑制率作为Y, 采用SMICA14.1软件构建PLSR模型建立谱效关系, 谱图中 X14、 X15、 X11、 X2四个共有峰 VIP>1, 其中 X2与抗炎效果呈正相关关系, X14、 X15、 X11与抗炎效果现负相关关系。 进一步建立数学模型得共有峰( X)与NO抑制率( Y)的关系 Y=237.618+2.992 X2-0.845 X4+2.979 X6-3.722 X7+0.433 X8-0.957 X12-0.759 X14-0.632 X15( p=0.003<0.01, R=0.935), p<0.01代表构建数学模型有意义, R=0.935代表所构建数学模型可解释93.5%的数据。 可知 X2、 X6与抗炎效果呈正相关关系, X4、 X7与抗炎效果呈负相关关系, 可预测体外抗炎效果, 准确率达93.5%, 但由于样本量过小, 仅可用于解释本研究纳入数据。 X6是由甲基的 β(C—H)产生, 可能与大黄素、 大黄酸、 大黄素甲醚、 芦荟大黄素等蒽醌类成分有关。 该研究将抗炎活性与红外光谱数据相结合, 引入唐古特大黄质量评价体系, 为唐古特大黄产业的健康发展提供新思路。
Research on the quality control of Chinese medicinal materials is one of the main aspects of the modernization of traditional Chinese medicine. Rheum taanduticum ( R. tanguticum) is one of the most widely used Chinese medicinal materials. The research on the quality control of R. tanguticum is total anthraquinones, anthraquinones, fingerprint and so on. There are few studies on quality standards based on anti-inflammatory effect in the study of R. tanguticum. Eighteen batches of R. tanguticum from different origins and processing conditions were collected to study by Fourier-transform infrared spectroscopy (FTIR). FTIR founded sixteen common peeks. There is high similarity (0.798~0.900) in 18 batches of R. tanguticum. There is a high similarity (the similarity greater than 0.900 is more than 80%) in the same origin (Gannan, Qinghai). The similarity of R. tanguticum in the same origin (Gannan, Qinghai) was higher (more than 80% if the similarity is greater than 0.900) than that between the two origins (only 69.44% if the similarity is greater than 0.900). There were variations in FTIR spectra of R. tanduticum in different origins, combining the result of cluster analysis. The origins maybe the main influence factor in the FTIR spectra. Furthermore, the sequence of double index analysis was established to distinguish different origins of medicinal materials. LPS stimulated RAW 264.7 cells to establish an inflammatory cell model. NO inhibition rate was used as an inflammatory index. Determination of NO inhibition rate of 18 batches of R. tanduticum. Establishing the PLSR model with common peaks ( X) and NO inhibition rate ( Y) by SMICA 14.1 software. There were 4 common peaks ( X14, X15, X11, X2), which VIP>1. It was found that X2 in the FTIR spectrum was positively correlated with an anti-inflammatory effect, and X14, X15, X11 were negatively correlated with anti-inflammatory effect. By further establishing the mathematical model with common peaks ( X) and NO inhibition rate ( Y), Y=237.618+2.992 X2-0.845 X4+2.979 X6-3.722 X7+0.433 X8-0.957 X12-0.759 X14-0.632 X15 ( p=0.003<0.01, R=0.935), it can be seen that X2, X6 have a positive correlation with the anti-inflammatory effect, and X4, X7 have a negative correlation with the anti-inflammatory effect. The in vitro anti-inflammatory effect can be predicted by the FTIR spectrum of R. tanguticum, with an accuracy of 93.50%. However, due to the small sample size, it can only be used to explain the data included in this study. X6 is made of methyl β(C—H), which may be related to the content of anthraquinone components (such as Emodin, Rhein, Physcion, Aloe emodin). The results of this study can introduce the anti-inflammatory efficacy evaluation into the quality evaluation system of Rheum tanguticum, enrich the quality evaluation system of R. tanguticum, and provide new ideas for the healthy development of Rheum tanguticum industry.
唐古特大黄为蓼科植物唐古特大黄Rheum tanguticum Maxim. ex Balf.的干燥根及根茎, 是大黄的主要来源之一, 主要生产于甘肃南部、 青海南部和西藏偏东部地区, 是甘肃省道地药材[1, 2]。 大黄是常用的中药之一, 主要成分是蒽醌类、 双蒽酮类、 鞣质类成分, 其主要药理作用有泻下、 抗炎、 利尿、 抗菌以及抗肿瘤[3, 4]。 由于品种混杂、 加工方法、 产地不同, 市面上大黄质量参差不齐, 国内外学者对于大黄的质量控制进行了大量的研究, 但对不同产地的唐古特大黄差异研究尚为少数。
傅里叶变换红外光谱(FTIR)因其简单、 快捷的测量方法避免质量分析过程中繁琐的前处理过程, 且不需要大量的化学试剂, 已经广泛的应用于食品与天然药物的产地鉴别, 食品与中药指标性成分的含量预测[5, 6, 7, 8]。 本工作通过FTIR光谱法结合聚类分析、 双指标序列法分析等分析方法研究甘南、 青海两个产地唐古特大黄的差异性, 并对FTIR光谱图与抗炎效果之间的相关性进行分析, 建立预测模型, 初步阐明抗炎效果与唐古特大黄FTIR图谱之间的关系, 将抗炎药效引入唐古特大黄的质量评价体系, 促进唐古特大黄产业的健康发展, 并助力天然药物溯源体系的建立。
唐古特大黄样品经由甘南州科技开发交流中心甘玉伟农业技术推广研究员鉴定为正品, 详细信息见表1。
| 表1 唐古特大黄样品信息 Table 1 Samples information of Rheum tanguticum |
Nicolet 6700 傅里叶变换红外光谱仪(Thermo fisher, America); 安捷伦1260高效液相色谱仪(Agilent Technologies, America); ME204E型万分之一电子天平(梅特勒-托利多仪器(上海)有限公司); KQ-700DE型数控超声波清洗器(昆山市超声仪器有限公司); MING-CHE 24 UV纯水仪(Merck Millipore, France); SHZ-D(Ⅲ )循环水多用真空泵(巩义市英峪高科仪器厂); UF110烘箱(Memmert, Germany); 371型二氧化碳培养箱(Thermo Fisher Scientific), HR1500-Ⅱ A2型生物安全柜(青岛海尔生物医疗股份有限公司), BCD-478W型无霜冷藏冷冻箱(博西华家用电器有限公司), IX53+DP73型研究级倒置荧光显微镜(Olympus), HWS-12型电热恒温水浴锅(上海一恒科学仪器有限公司), 酶标仪(型号: EPOCH, BioTek Instruments, INC), Countstar IC-1000型细胞计数仪(上海睿钰生物科技有限公司)。
溴化钾(KBr, 光谱纯, 批号: 20200715, 天津市大茂化学试剂厂)。
RAW264.7细胞专用培养基(由89%DMEM高糖培养基、 10%FBS、 1%P/S Solution组成), 批号: XH01112107XP, 购自武汉普诺赛生命科技有限公司。 脂多糖(LPS, 批号: 513E038, Solarbio), 噻唑蓝(MTT, Purity≥ 98.0%, 批号: 1223G0539, Solarbio), 二甲基亚砜(DMSO, ACS Grade, 批号: 1121E0321, Solarbio), 磷酸盐缓冲液(PBS, pH 7.2~7.6, 批号: 16I13B30, 博士德生物)。 NO试剂盒(批号: 20210731, 南京建成生物工程研究所)。
RAW 264.7细胞株, 批号: WXAKX9OB0N, 由武汉普诺赛生命科技有限公司提供。
仪器采用硅碳棒光源, DTGS检测器, 4 cm-1分辨率, 30次扫描累加, 在4 000~400 cm-1光谱范围内进行检测, 随行扣除H2O和CO2的干扰。
取唐古特大黄药材粉末约1 mg, 与100 mg的KBr粉末一起研磨至均匀混合, 压片, 以KBr为空白, 按“ 2.1” 项下红外光谱条件进行检测。
唐古特大黄药材的红外光谱结果运用OMNIC 8.2软件和Origin 2021自动基线校正、 平滑和纵坐标归一化处理。
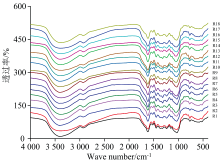
唐古特大黄药材的FTIR光谱图如图1所示, 18批唐古特大黄药材的FTIR光谱图有一定的相似性, 主要在400~1 800和2 700~3 800 cm-1有吸收峰。
对光谱图进行相似度分析, 唐古特大黄药材分析结果见表2。 18批唐古特大黄药材FTIR光谱图相似度在0.798~0.984之间, 总体相似度较高, 说明唐古特大黄药材质量相对稳定。 R10样品相似度较低, 主要在0.798~0.900之间。 在R1-R9之间样品相互相似度分析中, 相似度大于0.9的占80.56%; 在R11-R18之间样品相互相似度分析中, 相似度大于0.9的占85.71%; R1-R9与R11-R18之间的样品相似度分析中, 相似度大于0.9的占69.44%; 说明R1-R9、 R11-R18组内有较高的相似度, 但R1-R9、 R11-R18之间相似度次之。 结合各批次药材产地可发现, 唐古特大黄药材FTIR光谱图与产地有一定的关联度, 采用FTIR光谱图可区分甘南产与青海产唐古特大黄药材。
| 表2 唐古特大黄药材FTIR图谱相似度分析 Table 2 Similarity analysis of FTIR spectrum of Rheum tanguticum |
唐古特大黄醇提物FTIR光谱图相似度较药材高, 结合产地可发现, 相同产地的唐古特大黄药材相似度较高, 不同产地之间的唐古特大黄药材略有差异。 红外色谱用于唐古特大黄产地区分有一定的可行性。
对于一组吸收峰, 如果该组吸收峰的波数最大差值小于与其相邻组峰之间的平均波数之差, 则确定该组峰为一组共有峰[8]。 如对1 613.12、 1 612.74、 1 617.33、 1 623.06、 1 619.94、 1 622.1、 1 626.7、 1 616.18、 1 619.43、 1 624.86、 1 616.42、 1 616.24、 1 616.32、 1 615.65、 1 615.89、 1 615.56、 1 615.59和1 622.90 cm-1这一组峰, 平均波数为1 618.34 cm-1, 该组峰内最大波数差为13.96 cm-1; 该组峰前后相邻组峰的平均波数为2 930.44和1 517.28 cm-1, 该组峰与其前后相邻组峰的平均波数差值为1 312.10和101.05 cm-1, 13.96 cm-1小于1 312.10和101.05 cm-1, 则可判定该组峰为共有峰。
根据OMNIC软件识别吸收峰数据, 按照共有峰指认规则, 唐古特大黄药材共指认共有峰16个, 汇总FTIR吸收峰波数及共有峰, 结果见表3。
| 表3 唐古特大黄药材FTIR吸收峰波数及共有峰 Table 3 Common peaks of Rheum tanguticum FTIR absorption |
特征区共有峰归属:
3 415.27~3 359.21 cm-1(宽强峰): 聚合物的ν (O— H), 酰胺类的ν (N— H);
2 932.79~2 924.68 cm-1(肩峰): 亚甲基的ν as(C— H);
1 701.26~1 696.30 cm-1(中强峰): ν (C=O);
1 626.70~1 608.92 cm-1(中强峰): 酰胺类的β (N— H);
1 520.35~1 512.78 cm-1(弱峰): 酰胺类的β (N— H), 芳香烃类苯环骨架振动ν (C=C);
1 449.86~1 446.70 cm-1(中强峰): 甲基的δ (C— H), 亚甲基的δ (C— H), β (O— H), 芳香烃类苯环骨架振动ν (C=C);
1 367.46~1 316.93 cm-1(中强峰): 甲基的β (C— H);
1 243.07~1 235.59 cm-1(中强峰): δ (O— H), ν (C— N), 脂类化合物的ν (C— O— C);
1 146.30~1 141.00 cm-1(中强峰): ν (C— N), 脂类化合物的ν (C— O— C);
1 053.72~1 033.93 cm-1(强峰): δ (C— O)。
对于唐古特大黄的成分研究表明, 唐古特大黄主要含有蒽醌类、 多糖类与鞣质类物质, FTIR分析结果与成分研究结果具有一致性。
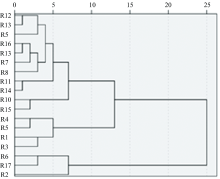
使用SPSS 26.0软件分别对18批次的唐古特大黄药材系统聚类分析, 聚类方法选择组间链接法, 区间选择平方欧式距离, 对18批次FTIR图谱进行聚类分析。 唐古特大黄药材FTIR光谱聚类分析结果见图2, 当欧氏距离为10时被分为三组, R12、 R13、 R5、 R16、 R18、 R7、 R8、 R11、 R14、 R10、 R15为一组, R4、 R9、 R1、 R3为一组, R6、 R17、 R2为一组。 不同产地唐古特大黄所含化学成分有一定差异性, 土壤、 天气、 人文环境等均会产生一定的影响, 具体影响因素有待进一步分析。
式(1)— 式(3)中: P为两个图谱中共有峰率, N为两个图谱中独立峰数, Ng为两个图谱中共有峰数, Pa为a图谱变异峰率, Na为a图谱中变异峰数, Pb为b图谱变异峰率, Nb为b图谱中变异峰数, 且符合N=Ng+Na+Nb。
根据式(1)— 式(3) 计算18批唐古特大黄药材之间红外图谱的共有峰率和变异峰率, 建立18批唐古特大黄的双指标分析序列, 该序列可在2+n维(n=样品数)空间中精确判断任何一样品与其他样品的亲缘远近关系, 具有很强的鉴别能力。 18批唐古特大黄药材的共有峰率和变异峰率双指标分析序列记为Ra∶ Rb(P; Pa, Pb), 含义为: 以Ra为对照药材, Rb的共有峰率为P, Ra的变异峰率为Pa, Rb的变异峰率为Pb[9]。
2.6.1 唐古特大黄药材的双指标分析序列的建立及分组
在不同的序列中, 共有峰率的不同表明样品之间关系不同。 具有相同的共有峰率的样品之间, 多数变异峰率不同, 此时可用于区分不同批次样品; 少数变异峰率相同, 说明二者相对于标准样品非常相似, 可在更深层次上做出认同或区分。 运用双指标序列分析法从共性和变异性两方面分析样品的红外图谱, 可以准确地找出化学成分最相似与差异最大的样品。
依据唐古特大黄药材的序列, 对唐古特大黄药材进行基本的分组(具体分组信息见附件), 在最相似样品对、 组中, 可根据共有峰率分为以下几组:
A组中, 序列的共有峰率、 变异峰率相同, 吸收峰情况完全对应。 比如R3∶ R5R8序列对应的药材均来源于合作市; 气候条件和生长环境近似, 所产生的唐古特大黄药材相似性高。
B组中, 序列的共有峰率较高、 变异峰率相对较低。 比如R1∶ R2R3R5R8序列, 序列内样品均来自于合作, 共有峰率为92.31%, R1的变异峰率为7.69%, 说明R1与R2、 R3、 R5、 R8样品之间相似度较高, 但有微小差异。
C组中, 序列的共有峰率较高, 变异峰率较高。 比如R1∶ R13序列, 1号来自合作, 13号来自青海, 二者共有峰率86.67%, 13号变异峰率为15.38%, 说明二者之间相似度较高, 同时存在一定差异。
D组中, 序列的共有峰率较低, 变异峰率较高。 比如R1∶ R12序列, 1号来自合作, 12号来自青海, 二者共有峰率为73.33%, 1号变异峰率为18.18%, 12号18.18%, 说明二者之间相似度较低, 同时差异较大。
根据“ 表3” 中共有峰数据, 采用OMNIC软件采集各批次唐古特大黄药材共有峰的透光率, 共有峰以X1— X16表示, 无吸收峰的以100.00%计, 排除缺失值达到50%以上的共有峰X13、 X14、 X16, 结果见表4。
| 表4 唐古特大黄药材共有峰透光率(单位: %) Table 4 Common peak transmittance of Rheum tanguticum (Unit: %) |
造模与给药: 取对数生长期RAW 264.7细胞以2× 106细胞浓度, 200 μ L铺板。 培养12 h后, 实验分为空白组、 模型组, 不同批次唐古特大黄醇提物组。 空白组, 不加LPS和唐古特大黄醇提物; 模型组, 加LPS至终浓度150 ng· mL-1, 不加唐古特大黄醇提物; 不同浓度唐古特大黄醇提物组, 加LPS至终浓度150 ng· mL-1和不同批次唐古特大黄醇提物至终浓度300 μ g· mL-1; 每组处理重复3孔, 培养24 h。
NO检测: 按照NO试剂盒操作, 检测上清液中NO浓度, 按照式(4)计算NO抑制率, 结果见表5。
| 表5 不同批次唐古特大黄NO抑制率( |
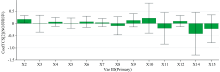
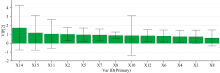
以共有峰透光率X1— X16作为X, NO抑制率作为Y, 采用SMICA 14.1软件构建PLSR模型, 各共有峰与NO抑制率的相关系数见图3, VIP值见图4。 由结果可知, X14、 X15、 X11、 X2四个吸收峰VIP> 1, 其中, X14、 X15、 X11呈现负相关关系, X2呈现正相关关系。
为进一步研究唐古特大黄FTIR共有峰与体外抗炎药效之间的关系, 以共有峰透光率X1— X16作为自变量, NO抑制率作为因变量, 导入SPSS 26.0软件采用后退法进行线性关系拟合, 以前15批唐古特大黄数据进行模型构建, 得到共有峰与NO抑制率之间存在以下数学关系
式(5)中, p=0.003< 0.01, 代表构建数学模型有意义, R=0.935代表所构建数学模型可解释93.5%的数据。 由模型可知X2、 X6与NO抑制率呈现正相关关系, X4、 X7与NO抑制率呈现负相关关系。
现今对唐古特大黄指纹图谱方面的研究已有很多, 但对不同产地唐古特大黄的差异研究尚为少数。 本研究采用FTIR光谱法对不同产地的唐古特大黄药材及其醇提物进行检验, 聚类分析发现不同产地此药材的FTIR有一定的差异性。 进一步建立了共有峰和变异峰的双指标分析序列, 可在一定程度上区分唐古特大黄的不同产地。 通过双指标序列法的分析, 双指标分析序列可一定程度上区分环境对于唐古特大黄药材的影响。 结果表明, 相同环境生长的唐古特大黄药材相似度较高。 但采用双指标分析序列分析唐古特大黄药材并不能完全阐明环境的影响, 比如在A组中R1∶ R11R15来源于合作与青海, 但二者的共有峰率为100%, 不存在变异峰。
将唐古特大黄的抗炎效果引入质量控制研究中, 采用PLSR建立唐古特大黄FTIR与抗炎效果的谱效关系, 并建立数学模型。 由模型可知X2、 X6与NO抑制率呈现正相关关系, X4、 X7与NO抑制率呈现负相关关系。 查阅X6的归属发现, X6是1 367.46~1 316.93 cm-1的中强峰, 由甲基的β (C— H)产生。 大黄中大黄素、 大黄酸、 大黄酚、 大黄素甲醚、 芦荟大黄素等成分均包含— CH3, 可以产生该吸收峰, 且这些成分已被证实是大黄中的抗炎药效物质基础[10, 11, 12, 13, 14, 15]。 X6的强弱应该与这些成分的含量有关, 与本研究结果具有一致性。 由于本研究纳入的唐古特大黄批次仅有18批次, 数据量过小, 建立的数学模型仅限于解释本研究纳入数据, 如需扩大模型应用仍需要进一步扩大建立模型所需要的样本量。
FTIR可应用于原植物分类鉴定、 质量评价和产地鉴别, 可解释部分化学信息, 所得的指纹图谱已经成为一种权威的质量一致性评价方法。 FTIR由于其简单、 快捷的特点, 以及不需要大量的化学试剂, 应用于中药质量控制有其独有的优势。 本研究将抗炎效果与质量控制相结合, 有利于唐古特大黄质量控制的进一步提升。 另外, 研究结果表明不同产地的唐古特大黄FTIR有一定的差异性, 这是由于唐古特大黄的品质是由多方面因素共同作用的结果, 例如温度、 湿度、 降水量、 光照时间、 经度、 纬度、 海拔、 坡度、 土壤因素; 另外, 人工栽培的大面积推广, 人为因素也是必不可少的影响因素[16, 17, 18]。 在唐古特大黄的进一步开发利用过程中, 可将不同生长环境纳入考察范围, 并充分考虑能促进其次生代谢产物积累的生态因子, 以期望能有针对性的提升药材质量, 并可扩大唐古特大黄的进一步开发利用。 可为唐古特大黄的质量控制提供新思路, 并助力中药溯源体系的建立。
唐古特大黄药材的双指标分析序列的分组∶
A组: R1∶ R11R15(1.000 0; 0.000 0, 0.000 0), R3∶ R5R8(1.000 0; 0.000 0, 0.000 0), R5∶ R3R8(1.000 0; 0.000 0, 0.000 0), R7∶ R14(1.000 0; 0.000 0, 0.000 0), R8∶ R3R5(1.000; 0.000 0, 0.000 0), R11∶ R1R15(1.000 0; 0.000 0, 0.000 0), R14∶ R7(1.000 0; 0.000 0, 0.000 0), R15∶ R1R11(1.000 0; 0.000 0, 0.000 0)。
B组: R1∶ R10R17R18(0.928 6; 0.000 0, 0.076 9), R1∶ R2R3R5R8(0.923 1; 0.076 9, 0.000 0), R1∶ R9(0.857 1; 0.083 3, 0.083 3), R2∶ R1R11R15(0.923 1; 0.000 0, 0.083 3), R2∶ R3R5R8(0.846 2; 0.090 9, 0.090 9), R3∶ R1R9R11R15(0.923 1; 0.000 0, 0.083 3), R3∶ R7R14(0.916 7; 0.090 9, 0.000 0), R3∶ R2(0.846 2; 0.090 9, 0.090 9), R4∶ R13(0.933 3; 0.000 0, 0.071 4), R4∶ R16R17R18(0.866 7; 0.076 9, 0.076 9), R5∶ R1R9R11R15(0.923 1; 0.000 0, 0.083 3), R5∶ R14(0.916 7; 0.090 9, 0.000 0), R5∶ R2(0.846 2; 0.090 9, 0.090 9), R6∶ R10R18(0.866 7; 0.076 9, 0.076 9), R7∶ R3R5R8(0.916 7; 0.000 0, 0.090 9), R8∶ R1R9R11R15(0.923 1; 0.000 0, 0.083 3), R8∶ R2(0.916 7; 0.090 9, 0.090 9), R8∶ R7R14(0.916 7; 0.090 9, 0.000 0), R9∶ R18(0.928 6; 0.000 0, 0.076 9), R9∶ R18(0.928 6; 0.000 0, 0.076 9)R9∶ R3R5R8(0.923 1; 0.083 3, 0.000 0), R9∶ R1R11R12R15(0.857 1; 0.083 3, 0.083 3), R10∶ R1R11R15(0.928 6; 0.076 9, 0.000 0), R10∶ R6R17R18(0.866 7; 0.076 9, 0.076 9), R11∶ R10R17R18(0.928 6; 0.000 0, 0.076 9), R11∶ R9(0.923 1; 0.083 3, 0.083 3), R11∶ R2R3R5R8(0.923 1; 0.083 3, 0.000 0), R12∶ R9(0.857 1; 0.083 3, 0.083 3), R13∶ R4R16R17R18(0.933 3; 0.071 4, 0.000), R14∶ R3R5R8(0.916 7; 0.000 0, 0.090 9), R15∶ R10(0.928 6; 0.000 0, 0.076 9), R15∶ R2R3R5R8(0.923 1; 0.083 3, 0.000 0), R15∶ R9(0.857 1; 0.083 3, 0.083 3), R16∶ R13(0.933 3; 0.000 0, 0.071 4), R16∶ R4R17R18(0.866 7; 0.076 9, 0.076 9), R17∶ R13(0.933 3; 0.000 0, 0.071 4), R17∶ R1R11R15(0.928 6; 0.076 9, 0.000 0), R18∶ R13(0.933 3; 0.000 0, 0.071 4), R18∶ R1R9R11R15(0.928 6; 0.076 9, 0.000), R18∶ R4R6R10R16R17(0.866 7; 0.076 9, 0.076 9)。
C组: R1∶ R13(0.866 7; 0.000 0, 0.153 8), R1∶ R7R14(0.846 2; 0.181 8, 0.000 0), R1∶ R4R6R16(0.800 0; 0.083 3, 0.166 7), R2∶ R4R10R17R18(0.857 1; 0.000 0, 0.166 7), R2∶ R7(0.846 2; 0.181 8, 0.090 9), R2∶ R13(0.800 0; 0.000 0, 0.250 0), R3∶ R10R17R18(0.857 1; 0.000 0, 0.166 7), R3∶ R13(0.800 0; 0.000 0, 0.250 0), R4∶ R2(0.857 1; 0.166 7, 0.000 0), R4∶ R1R9R11R12R15(0.800 0; 0.166 7, 0.083 3), R5∶ R7(0.909 1; 0.100 0, 0.000 0), R5∶ R10R17R18(0.857 1; 0.000 0, 0.166 7), R5∶ R12(0.846 2; 0.090 9, 0.181 8), R5∶ R13(0.800 0; 0.000 0, 0.250 0), R6∶ R13(0.812 5; 0.076 9, 0.153 8), R6∶ R16(0.800 0; 0.166 7, 0.166 7), R6∶ R1R9R11R12R15(0.800 0; 0.166 7, 0.083 3), R7∶ R1R9R11R15(0.846 2; 0.000 0, 0.181 8), R8∶ R10R17R18(0.857 1; 0.000 0, 0.166 7), R8∶ R13(0.800 0; 0.000 0, 0.250 0), R9∶ R13(0.866 7; 0.000 0, 0.153 8), R9∶ R7R14(0.846 2; 0.181 8, 0.000 0), R9∶ R4R6R10R16R17(0.800 0; 0.083 3, 0.166 7), R10∶ R2R3R5R8(0.857 1; 0.166 7, 0.000 0), R10∶ R13(0.812 5; 0.076 9, 0.153 8), R10∶ R9(0.800 0; 0.166 7, 0.083 3), R11∶ R13(0.866 7; 0.000 0, 0.153 8), R11∶ R6R16(0.857 1; 0.083 3, 0.166 7), R11∶ R7R14(0.846 2; 0.181 8, 0.000 0), R11∶ R4(0.800 0; 0.083 3, 0.166 7), R12∶ R13(0.866 7; 0.000 0, 0.153 8), R12∶ R4R6R16R17R18(0.800 0; 0.083 3, 0.166 7), R12∶ R4R6R16R17R18(0.800 0; 0.083 3, 0.166 7), R13∶ R1R9R11R12R15(0.866 7; 0.153 8, 0.000 0), R13∶ R6R10(0.812 5; 0.153 8, 0.076 9), R13∶ R2 R3R5R8(0.800 0; 0.250 0, 0.000 0), R14∶ R1R9R11R15(0.846 2; 0.000 0, 0.181 8), R15∶ R7R14(0.846 2; 0.181 8, 0.000 0), R15∶ R4R6R16(0.800 0; 0.083 3, 0.166 7), R16∶ R1R9R11R12R15(0.800 0; 0.166 7, 0.083 3), R17∶ R4R10R16R18(0.866 7; 0.076 9, 0.076 9), R17∶ R2R3R5R8(0.857 1; 0.166 7, 0.000 0), R17∶ R9R12(0.800 0; 0.166 7; 0.083 3), R18∶ R2R3R5R8(0.857 1; 0.166 7, 0.000 0), R18∶ R12(0.800 0; 0.166 7, 0.083 3)。
D组: R1∶ R12(0.733 3; 0.181 8, 0.181 8), R2∶ R9(0.785 7; 0.071 4, 0.142 9), R2∶ R14(0.769 2; 0.200 0, 0.100 0), R2∶ R6R16(0.733 3; 0.090 9, 0.272 7), R2∶ R12(0.666 7; 0.200 0, 0.300 0), R3∶ R12(0.785 7; 0.090 9, 0.181 8), R3∶ R4R6R16(0.733 3; 0.090 9, 0.272 7), R4∶ R6R10(0.750 0; 0.166 7, 0.166 7), R4∶ R3R5R8(0.733 3; 0.272 7, 0.090 9), R4∶ R7R14(0.666 7; 0.400 0, 0.100 0), R5∶ R6(0.785 7; 0.090 9, 0.272 7), R5∶ R4R16(0.733 3; 0.090 9, 0.272 7), R6∶ R4R17(0.750 0; 0.166 7, 0.166 7), R6∶ R2R3R8(0.733 3; 0.272 7, 0.090 9), R6∶ R7R14(0.666 7; 0.400 0, 0.100 0), R6∶ R5(0.666 7; 0.300 0, 0.100 0), R7∶ R10R17R18(0.785 7; 0.000 0, 0.272 7), R7∶ R2(0.769 2; 0.100 0, 0.200 0), R13(0.733 3; 0.000 0, 0.363 6), R12(0.714 3; 0.100 0, 0.300 0), R4R6R16(0.666 7; 0.100 0, 0.400 0), R8∶ R12(0.785 7; 0.090 9, 0.181 8), R8∶ R4R6R16(0.733 3; 0.090 9, 0.272 7), R9∶ R2(0.785 7; 0.181 8, 0.090 9), R10∶ R7R14(0.785 7; 0.272 7, 0.000 0), R10∶ R4R16(0.750 0; 0.166 7, 0.166 7), R10∶ R12(0.733 3; 0.272 7, 0.181 8), R11∶ R12(0.733 3; 0.181 8, 0.181 8), R12∶ R3R5R8(0.785 7; 0.181 8, 0.090 9), R12∶ R1R11R15(0.733 3; 0.181 8, 0.181 8), R12∶ R7R14(0.714 3; 0.300 0, 0.100 0), R12∶ R10(0.687 5; 0.181 8, 0.272 7), R12∶ R2(0.666 7; 0.300 0, 0.200 0), R13∶ R7R14(0.733 3; 0.363 6, 0.000 0), R14∶ R10R17R18(0.785 7; 0.000 0, 0.272 7), R14∶ R2(0.769 2; 0.100 0, 0.200 0), R14∶ R13(0.733 3; 0.000 0, 0.363 6), R14∶ R12(0.714 3; 0.100 0, 0.300 0), R14∶ R4R6R16(0.666 7; 0.100 0, 0.400 0), R15∶ R17R18(0.785 7; 0.000 0, 0.090 9), R15∶ R12(0.733 3; 0.181 8, 0.181 8), R15∶ R13(0.733 3; 0.181 8, 0.000 0), R16∶ R6R10(0.750 0; 0.166 7, 0.166 7), R16∶ R2R3R5R8(0.733 3; 0.272 7, 0.090 9), R16∶ R7R14(0.666 7; 0.400 0, 0.100 0), R17∶ R7R14(0.785 7; 0.272 7, 0.000 0), R17∶ R6(0.750 0; 0.166 7, 0.166 7), R18∶ R7R14(0.785 7; 0.272 7, 0.000 0)。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|