作者简介: 王新强, 1977年生, 桂林电子科技大学光电工程学院正高级实验师 e-mail: xqwang2006@126.com
纤维素是由葡萄糖组成的大分子多糖, 是世界上最丰富、 最便宜、 最容易获得的天然聚合物。 纤维素作为最古老最丰富的天然高分子在研究中备受关注, 纤维素的可控性取决于其分子量、 大小和结构, 而拉曼光谱具有“指纹特性”, 可以对不同的纤维素纤维进行鉴别, 也能对历史老化的纺织纤维材料进行鉴别。 然而纤维素作为大分子多糖对其做理论仿真较为困难, 该研究提出采用基本单元模拟大分子光谱这一方案, 使用纤维素单体仿真拉曼光谱来分析纤维素大分子的光谱性质。 使用Gaussian 16软件基于密度泛函理论, 在B3LYP/6-31g(d, p)的基组条件下, 计算了不同外电场(-0.01~0.03 a.u.)下的纤维素单体的拉曼光谱, 以及纤维素双链节的拉曼光谱。 研究表明, 在无外电场作用下, 纤维素单体的拉曼光谱主要在449、 597、 842、 1 127、 1 361、 1 395和3 005 cm-1处有特征峰, 对其做振动分析, 结果表明这些拉曼峰分别是由环 (C6—C4—O20) 伸缩振动、 C—C—H扭曲振动、 环(C4—O20—C2) 伸缩振动、 糖苷键(C2—O1—C8)的伸缩振动、 CH2的弯曲振动、 CH2的弯曲振动、 CH2的伸缩振动产生。 通过与实验值比较, 纤维素单体仿真拉曼光谱与天然纤维素的实测拉曼光谱相吻合, 故可通过对纤维素单体的第一性原理计算来反映纤维素大分子的拉曼光谱特性。 当外电场由负方向变为正方向且逐渐增大时, 597 cm-1对应的环C—C—H扭曲振动的振幅无明显变化, 以无电场为基准, 施加外电场时, 振动能量减小光谱红移; 1 127 cm-1对应的糖苷键(C2—O1—C8)的伸缩振动振幅明显减小, 光谱呈蓝移; CH2的弯曲振动在1 395 cm-1处的特征峰光谱呈蓝移, 在1 361 cm-1处产生的光谱先蓝移再红移又再次蓝移, 推测是弯曲振动区域更容易受到骨架振动和环境变化的影响。 对比纤维素单体与双链节拉曼光谱的差异, 除单体明显的特征峰外, 双链节分子的在1 041和151 cm-1处有明显的特征峰, 其分别为仲醇C—O伸缩振动, C—O—H弯曲振动所产生, 可对纤维素单体的拉曼光谱进行补充说明。 这些结论为研究纤维素在外电场作用下的光谱提供理论依据, 同时为其他大分子聚合物的拉曼光谱研究分析提供一种新的方法。
Cellulose is a macromolecular polysaccharide composed of glucose, the most abundant, cheapest and easiest to obtain natural polymer in the world. Cellulose, as the oldest and most abundant natural polymer, has attracted much attention in research. The controllability of cellulose depends on its molecular weight, size and structure, and Raman spectroscopy has “fingerprint characteristics”, which can identify different cellulose fibers, as well as historical aging textile fiber materials. However, it is difficult to simulate cellulose as a macromolecular polysaccharide theoretically. In this study, we propose using the basic unit to simulate macromolecular spectrum, and use cellulose monomer to simulate Raman spectrum to analyze the spectral properties of cellulose macromolecules. In this paper, based on density functional theory, the Raman spectra of cellulose monomers and cellulose double links under different external electric fields (a. u.) were calculated under the basis set conditions of B3LYP/6-31g (d, p) using Gaussian 16 software. The study shows that the Raman spectrum of cellulose monomer has characteristic peaks at 449, 597, 842, 1 127, 1 361, 1 395 and 3 005 cm-1 without the action of the external electric field. The vibration analysis shows that these Raman peaks are respectively composed of the ring (C6—C4—O20) stretching vibration, C—C—H twisting vibration, ring (C4—O20—C2) stretching vibration, glycosidic bond (C2—O1—C8) stretching vibration, CH2 bending vibration The expansion vibration of CH2 is generated. Compared with the experimental value, the simulated Raman spectrum of cellulose monomer is consistent with the measured Raman spectrum of natural cellulose, so the first principle calculation of cellulose monomer can reflect the Raman spectrum characteristics of cellulose macromolecules. When the external electric field changes from the negative direction to the positive direction and gradually increases, the amplitude of the C—C—H torsional vibration of the ring corresponding to 597 cm-1 has no obvious change. With no electric field as the benchmark, when the external electric field is applied, the vibration energy reduces the spectral red shift; The stretching vibration amplitude of the glycoside bond (C2—O1—C8) corresponding to 1 127 cm-1 decreased significantly, and the spectrum showed a blue shift; The characteristic peak spectrum of the bending vibration of CH2 at 1 395 cm-1 shows a blue shift, and the spectrum generated at 1 361 cm-1 shows a blue shift first, then a red shift, and then a blue shift again. It is speculated that the bending vibration area is more susceptible to the influence of the skeleton vibration and environmental changes. Comparing the difference between the Raman spectra of cellulose monomer and double chain link, in addition to the obvious characteristic peaks of the monomer, the double chain link molecule has obvious characteristic peaks at 1 041 and 151 cm-1, which are respectively produced by C—O stretching vibration of secondary alcohol and C—O—H bending vibration, which can supplement the Raman spectra of cellulose monomer. These conclusions provide a theoretical basis for studying the spectra of cellulose under the action of external electric field and a new method for studying and analyzing the Raman spectra of other macromolecular polymers.
纤维素是地球上最古老最丰富的天然高分子, 是人体七大营养素之一, 也是植物细胞壁的主要构成成分[1, 2]。 纤维素是由β -D-葡萄糖残基彼此以1, 4-苷键连接而成的大分子多糖, 它的结构中没有分支, 分子式为(C6H10O5)n。 纤维素具有预防肠癌, 预防和治疗冠心病, 降压等作用[4, 5]。 近年来, 人们对纤维素及其衍生物和纤维素纳米材料等方面有诸多研究[6, 7], 然而对纤维素在外电场作用下分子结构、 拉曼光谱等方面的影响还鲜有报道。 纤维素作为一个大分子聚合体, 直接对其进行拉曼光谱的理论计算十分的困难, 因此, 我们通过对纤维素单体进行理论拉曼光谱仿真来反应纤维素大分子的拉曼光谱。 本文基于密度泛函理论[8], 研究纤维素单体的拉曼光谱, 及其在不同外电场下的光谱变化, 分子在外电场作用下会产生一系列新的物理现象和化学变化, 例如分子结构的改变, 化学键的断裂, 光谱的红移和蓝移[9, 10, 11]等。 本研究分析了两个单体通过脱氢耦合后形成双链节与单体的差异, 为研究纤维素大分子的光谱检测提供理论依据。 同时为其他大分子聚合物的拉曼光谱研究分析提供新思路。
在外电场的作用下, 分子体系的哈密顿量H可表示为[12]
式(1)中, H0为无电场作用下的哈密顿量, Hint为有外电场作用时的哈密顿量。 加入偶极近似, 则分子体系与外电场相互作用可以表示为
式(2)中, μ 为电偶极矩, F为外电场。
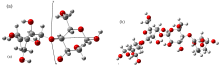
纤维素是由葡萄糖组成的大分子多糖, 它的分子式是(C6H10O5)n, 其中n为聚合度。 相邻的两个葡萄糖残基会沿轴向扭转180° , 因此每两个残基会形成周期性重复, 称为纤维素分子的基本链节。 选取纤维素一个基本链节创建单体分子模型如图1(a)所示。 其中红色的球体代表氧原子, 灰色球体代表碳原子, 白色球体代表氢原子。 采用密度泛函理论和 B3LYP/6-31g(d, p)的基组方法优化纤维素单体, 优化后没有虚频, 判断其优化为稳定结构, 得到纤维素分子单体的基态几何结构。 在形成纤维素大分子结构时, 各基本链节单体会通过脱氢耦合形成化学键。 为了考察这一成键多用对纤维素拉曼光谱的影响, 本研究同时构造了纤维素分子的双链节分子结构来进行对照分析, 如图1(b)所示。 对其也采用DFTY B3LYP/6-31g(d, p)的基组方法优化, 得到双链节基态几何结构。
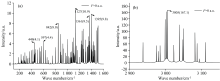
纤维素作为大分子聚合体, 对其拉曼光谱进行理论仿真计算较为困难。 故本文提出一种新方法, 即可以使用纤维素的基本链节及其两体耦合结构来研究纤维素大分子的拉曼光谱。 无外电场条件下纤维素单体的拉曼光谱如图2所示, 纤维素单体拉曼光谱可分为三个部分: 200~640、 800~1 600、 2 900~3 150 cm-1, 其主要的拉曼峰位于449、 597、 842、 1 127、 1 361、 1 395和3 005 cm-1处。 对这些拉曼峰做振动归属分析: 449 cm-1处由环(C6— C4— O20)伸缩振动产生了一个较弱的特征峰; 在597 cm-1处的峰是由C— C— H扭曲振动产生的; 在842 cm-1处的峰, 是由环(C4— O20— C2) 伸缩振动引起的; 1 127 cm-1处产生的特征峰对应糖苷键(C2— O1— C8)的伸缩振动; CH2的弯曲振动在1 361和1 395 cm-1处产生了2个较强的吸收峰; 多个CH2的伸缩振动在3 005 cm-1处产生了最强的特征峰。 对比相关文献[13], 天然纤维素的拉曼光谱测量结果在458、 610、 897、 1 122、 1 360、 1 378和2 968 cm-1处有明显的特征峰, 其特征峰归属分别为环(C— O— C)伸缩振动、 C— C— H扭曲振动、 (C— O— C)面内对称伸缩振动、 糖苷键(C— O— C)对称伸缩振动、 CH2弯曲振动、 CH2弯曲振动、 CH2伸缩振动。 纤维素单体仿真所得拉曼光谱特征峰的位置与文献天然纤维素所测拉曼光谱特征峰的位置较为吻合。 因此我们可以用纤维素单体仿真来反映纤维素大分子的仿真性质。
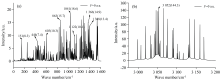
分子在外电场作用下会发生许多物理和化学变化, 如分子结构, 吸收光谱的变化, 但是直接对纤维素大分子做理论分析较为困难, 因此通过对纤维素单体做外电场下的拉曼光谱变化来反映维素大分子在电场下的变化。 在x轴方向上添加不同强度外电场(-0.01~0.03 a.u.), 得到不同外电场强度下纤维素单体拉曼光谱的变化如图3所示。 分子的拉曼光谱在外电场作用下会出现红移或蓝移现象, 外加电场对不同振动模式的影响不尽相同。 当外电场由负方向变为正方向且电场逐渐增大时, 图3(a)中, 597 cm-1对应的环C— C— H扭曲振动的振幅无明显变化, 以无电场为基准, 施加外电场时, 振动能量减小光谱红移; 由图3(b)可知, 1 127 cm-1对应的糖苷键(C2— O1— C8)的伸缩振动振幅明显减小, 这是因为外电场作用影响了基团的振动, 使其振动峰减弱, 正方向的外电场使拉曼光谱振幅变化更大, 拉曼光谱发生明显的蓝移现象, 糖苷键的断裂会使得纤维素聚合度降低; 在图3(c)中, CH2的弯曲振动在1 361 cm-1处产生的光谱先蓝移再红移又再次蓝移, 由图3(d)可知CH2的弯曲振动在1 395 cm-1处的特征峰光谱呈蓝移, 猜测是弯曲振动区域更容易受到骨架振动和环境变化的影响, 从而使拉曼光谱变化不同。
纤维素作为大分子多糖, 其单体结合可能也会对拉曼光谱产生影响。 研究纤维素单体结合与单体的拉曼光谱之间的差异, 可以更准确地研究纤维素大分子的仿真性质。 两个单体通过脱氢耦合的方式连接成双链节分子, 其拉曼光谱图如图4所示, 和纤维素单体一样, 其拉曼光谱在视觉上可分为三个区域: 150~610、 800~1 600和2 950~3 170 cm-1, 与纤维素单体相比, 双链节其拉曼光谱的特征峰振幅明显变大, 且存在纤维素单体中没有的拉曼特征峰。 单体中由环(C6— C4— O20)伸缩振动产生了一个特征峰位于449 cm-1处, 而在双链节中位于444 cm-1处, 且其特征峰振幅明显增强; 由C— C— H扭曲振动产生的特征峰在单体中位于597 cm-1处, 在双链节中位于602 cm-1处, 其特征峰振幅显著提升; 单体中在842 cm-1处的峰, 是由环(C4— O20— C2)伸缩振动引起的, 其在双链节中产生的特征峰位于863 cm-1处; 糖苷键 (C2— O1— C8) 的伸缩振动产生的吸收峰在单体与双链节中分别位于1 127和1 122 cm-1处; 多个CH2的伸缩振动产生的特征峰在单体与双链节中分别位于1 361、 1 395 cm-1处和1 366、 1388 cm-1处; 多个CH2的伸缩振动在3 005 cm-1处产生了最强的特征峰, 其在双链节中位于3 050 cm-1处。 除此之外, 双链节分子的拉曼光谱有其他明显的特征峰位于1 041和115 cm-1处, 分别是由仲醇C— O伸缩振动和C— O— H弯曲振动产生的。 对比相关文献[14], 天然纤维素的拉曼光谱测量结果中仲醇C— O伸缩振动产生的特征峰位于1 040 cm-1处, C— O— H弯曲振动产生的特征峰位于172 cm-1处, 与双链节的特征峰位置较为吻合。 通过单体与双链节的对比, 纤维素单体中一系列振动产生的特征峰都能在双链节中找到相应的特征峰, 此外, 双链节拉曼光谱中有其他明显的特征峰, 对单体拉曼光谱进行补充说明, 为研究纤维素大分子的仿真性质提供帮助。
本文提出了通过纤维素单体的第一性原理计算来仿真纤维素大分子拉曼光谱的方法, 研究了不同外电场作用下纤维素拉曼特征谱峰的变化规律, 以及双链节结构的成键效应对其拉曼光谱的影响。 纤维素单体理论拉曼光谱在3 005、 1 395、 1 361、 1 127、 842、 597和449 cm-1处存在明显特征峰, 与文献[13, 14]天然纤维素所测拉曼光谱特征峰的位置非常吻合。 不同外电场条件对纤维素单体的的振动模式会发生不同的变化, 其中环(C— C— H)的光谱呈红移, 特征峰无明显变化, 糖苷键(C2— O1— C8)和CH2的弯曲振动的光谱发生明显的蓝移。 无外电场条件下纤维素双链节分子的拉曼光谱与单体分子的拉曼光谱形状较为相似, 但存在其他位于1 041和115 cm-1处的特征峰, 与文献[13, 14]中产生的特征峰位置较为吻合, 对单体拉曼光谱进行补充说明。 这些结果为研究纤维素理论拉曼与其电场下光谱检测提供参考, 同时为其他大分子聚合物的拉曼光谱研究分析提供新思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|