作者简介: 高 雅, 女, 1996年生, 中国中医科学院医学实验中心博士研究生 e-mail: 2601804192@qq.com
寻找珊瑚药材与奶珊瑚饮片的差异性化学指标, 为奶珊瑚饮片的质量标准完善提供参考。 以奶水比例、 煎煮温度、 干燥时间、 干燥温度作为炮制工艺因素, 通过正交试验制备一系列奶珊瑚饮片。 使用滴定分析法、 X射线衍射法、 红外光谱法, 分别检测珊瑚药材与奶珊瑚饮片中的碳酸钙含量、 碳酸钙晶型、 有机与无机成分组成。 珊瑚奶制前后的碳酸钙含量均约80%, 珊瑚药材按照规范工艺炮制后的碳酸钙含量可能略有增加。 珊瑚奶制备前后的碳酸钙晶型均以方解石为主, 珊瑚药材2 θ=47.953°处X射线衍射特征峰可能在炮制后有所差异。 珊瑚奶制备前后的有机成分具有明显差异, 奶珊瑚饮片的红外光谱对应于脂肪、 蛋白质、 碳水化合物等3 050~2 750、 1 770~1 720、 1 710~1 600 cm-1特征谱带峰面积显著高于珊瑚药材。 红外光谱特征谱带峰面积对于奶水比例、 煎煮温度、 干燥时间、 干燥温度等炮制工艺因素的变化较为敏感。 红外光谱可以客观、 量化地鉴别珊瑚药材与奶珊瑚饮片, 还有可能用于评价奶珊瑚饮片的炮制工艺是否符合规范要求。
To find the differential chemical indicators between the raw and milk-processed corals, which can provide references for improving the quality standards of the milk-processed corals. A serial of the milk-processed corals was prepared by the orthogonal design of the processing factors, including the milk-to-water ratio, the decocting temperature, the drying time and the drying temperature. Calcium carbonate's content and crystal form in the raw and milk-processed corals were tested by titrimetric analysis and X-ray diffraction, respectively. The organic and inorganic compositions of the raw and milk-processed corals were characterized by infrared spectroscopy.The mass concentration of calcium carbonatewas about 80% in the raw and milk-processed corals, while the calcium carbonate content could increase slightly when the raw coral was processed according to the processing specification. The crystal form of calcium carbonatewas calcite in the raw and milk-processed corals, while the X-ray diffraction peak of the raw coral at 2 θ=47.953° could change after the processing. The organic compositions were quite different between the raw and milk-processed corals. The characteristic bands in the regions of 3 050~2 750, 1 770~1 720 and 1 710~1 600 cm-1 (corresponding to fats, proteins, carbohydrates, etc.) in the infrared spectra of the milk-processed corals were significantly stronger than those in the infrared spectrum of the raw coral. The areas of these infrared spectral bands were also sensitive to the variations of the processing factors, including the milk-to-water ratio, the decocting temperature, the drying time and the drying temperature. Infrared spectroscopy can objectively and quantitatively discriminate the raw and milk-processed corals. It was also possible to use infrared spectroscopy to evaluate the compliance of the processing methods of the milk-processed corals.
珊瑚(Corallii Rubra), 蒙药名旭日(Xur), 为矶花科动物桃色珊瑚也称日本红珊瑚(Coralliumjaponicum Kishinouye)是珊瑚虫分泌的石灰质骨骼[1]。 珊瑚的主要化学成分是以微晶方解石形式存在的碳酸钙(CaCO3), 还有其他一些无机和有机成分[2]。 除了广为人知的环境保护价值, 珊瑚也具有很高的药用价值。 珊瑚是蒙医和藏医常用药材之一, 始载于《四部医典》, 在《认药白晶鉴》、 《无误蒙药鉴》等历代文献中均有记载[3]。 蒙医认为珊瑚性凉、 味甘, 有清热、 解毒、 镇静之功效, 临床常用于治疗肝热、 脉热、 聚病、 毒热、 中风、 “ 白脉” 病等[4]。
临床应用时, 珊瑚经常炮制成奶珊瑚后入药。 《内蒙古蒙药饮片炮制规范》(2020年版)[5]对于奶珊瑚的炮制工艺有详细规定: “ 取珊瑚, 砸成碎粒, 照奶煮法(本附录Ⅱ ), 加鲜牛奶和水(1:1), 文火煮至近干(约4 h), 取出, 干燥(100 ℃烘干)。 每100 kg珊瑚, 用鲜牛奶50 kg、 水50 kg。” 然而, 该炮制规范列出的奶珊瑚与珊瑚其他炮制品的性状差异仅为前者“ 略具奶香气” , 也缺少奶珊瑚专属的鉴别或含量测定指标。 因此, 建立客观、 量化的珊瑚奶制前后的差异性化学指标, 对于奶珊瑚饮片的准确鉴别、 炮制工艺合规范性评价都很必要。
滴定分析法是通过对矿物药中某种阳离子的含量测定, 推测出矿物药中组成成分的含量, 目前是矿物药含量测定的常用方法[6]。 X射线衍射(XRD)分析法是基于多晶样品对X射线的衍射效应, 对样品中各组分的物质组成、 晶型、 构象、 分子构型等进行分析测定的方法, 广泛应用于矿物药鉴定中[7]。 红外光谱(IR)是由矿物分子振动产生的吸收光谱, 反映了红外射线与物质相互作用, 具有特征性强、 取样量小、 简便迅速等优点[8]。 根据珊瑚化学成分与奶制工艺特点, 本研究通过正交试验制备不同炮制工艺参数的一系列奶珊瑚饮片, 从碳酸钙含量、 碳酸钙晶型、 有机与无机成分组成等角度评价不同工艺要素对奶珊瑚化学成分的影响, 以探索奶珊瑚炮制前后的差异性化学指标及其检测方法。
所用珊瑚药材来自内蒙古自治区兴安盟乌兰浩特市中蒙制药有限公司, 经内蒙古民族大学蒙医药学院包桂花教授鉴定为矶花科动物桃色珊瑚(Coralliumjaponicum Kishinouye)等珊瑚虫分泌的石灰质骨骼。 参考《内蒙古蒙药饮片炮制规范》(2020年版)规定的奶珊瑚炮制工艺参数, 选取奶水比例、 煎煮温度、 干燥时间、 干燥温度作为4个因素, 每个因素设置3个水平, 根据L9(34)正交试验表设计9组炮制工艺参数, 使用前述珊瑚药材制备9批次的奶珊瑚饮片(饮片编号与对应炮制工艺参数如表1所示)。 珊瑚药材与奶珊瑚饮片粉碎后过药典六号筛, 取细粉用于后续各项测试。
| 表1 奶珊瑚炮制工艺正交试验参数 Table 1 Orthogonal design of the processing parameters for the milk-processed corals |
牛奶(批号2P20210625BJ01Ea)购自蒙牛; 乙二胺四乙酸二钠标准溶液(批号20200728A)购自以达科技(泉州)有限公司; 甲基红(批号395876), 钙黄绿素(批号027909), 氢氧化钠(批号629813)购自北京化工厂有限责任公司; 氯化钾(批号20160801), 盐酸(批号20200609)购自国药集团化学试剂有限公司; 氢氧化钾(批号870710)购自北京化学试剂三厂。
精密称量样品细粉0.1 g, 加稀盐酸5 mL, 加热溶解, 加水150 mL与甲基红指示剂2滴, 再加氢氧化钾试液至溶液显黄色后, 继续多加氢氧化钾试液10 mL, 加钙黄绿素指示剂少许, 用乙二胺四乙酸二钠滴定液(0.05 mol· L-1)滴定至黄绿色荧光消失, 并显橙色。 每1 mL乙二胺四乙酸二钠滴定液相当于5.004 mg碳酸钙。
样品X射线衍射谱测试使用D8 Advance X射线衍射仪(德国Bruker公司), 铜靶Kα 辐射, 石墨单色器, 管压40 kV, 管流40 mA, 扫描范围5° ~60° (2θ ), 扫描速度每分钟0.5° , 狭缝宽度1° , 步长0.02° 。
样品红外光谱测试所用仪器为Frontier FT-IR/NIR傅里叶变换红外光谱仪(美国PerkinElmer公司), 溴化钾压片法测量样品粉末的透射红外光谱。 光谱扫描范围4 000~400 cm-1, 光谱分辨率4 cm-1, 每张光谱累加扫描16次。 使用纯溴化钾片进行光谱背景校正, 扫描过程中自动扣除水蒸气和二氧化碳干扰。 所有样品红外光谱使用Spectrum v10.4.3软件(美国PerkinElmer公司)依次进行下列处理: 光谱纵坐标由透过率转变为吸光度; 光谱基线自动校正; 光谱纵坐标归一化, 使2 000~800 cm-1区域内最高吸光度为1、 最低吸光度为0。
参考《内蒙古蒙药饮片炮制规范》(2020年版)对于奶珊瑚炮制工艺的具体要求, 本研究设计了奶水比例、 煎煮温度、 干燥时间、 干燥温度的4因子3水平正交试验, 以考察不同工艺参数炮制的奶珊瑚饮片与原药材的化学指标差异。 《内蒙古蒙药饮片炮制规范》(2020年版)规定的珊瑚含量测定指标为碳酸钙含量(不得少于80.0%), 因此首先考察了不同工艺参数炮制后的奶珊瑚碳酸钙含量差异。 根据1.2节所述测试方法, 本研究使用的珊瑚药材碳酸钙含量为82.5%, 符合炮制规范的要求。 如表1所示, 9个奶珊瑚饮片的碳酸钙含量为76.5%~84.6%, 均值为80.5%, 标准差为2.4%, α =0.05时的分布区间为[75.8%, 85.1%]。 奶珊瑚饮片的碳酸钙含量分布区间包含了珊瑚药材的碳酸钙含量。 由此推测, 如果炮制工艺参数不是严格固定的, 奶珊瑚饮片与珊瑚药材的碳酸钙含量很可能没有显著性差异。
需要注意的是, 如果奶水比例为1:0(即煮制珊瑚时只用牛奶、 不加水), 3个奶珊瑚饮片的碳酸钙含量均低于珊瑚药材。 分析认为纯牛奶的固形物含量高, 珊瑚在煮制过程中吸附了较多的牛奶固形物, 所以最终的奶珊瑚饮片中碳酸钙含量相对于原药材有所降低。 如果奶水比例为1:1(牛奶与水等体积混合)或1:2(牛奶与二倍体积水混合), 6个奶珊瑚饮片的碳酸钙含量均不低于珊瑚药材。 分析认为加水后的牛奶固形物含量低, 珊瑚在煮制过程中吸附的牛奶固形物较少, 而溶解于加水牛奶中的珊瑚成分较多, 所以最终的奶珊瑚饮片中碳酸钙含量相对于原药材有所增加。 从表1的各因子R值也能明显看出, 奶水比例对碳酸钙含量的影响最大。
综上所述分析可得, 珊瑚药材按照规范炮制为奶珊瑚饮片后, 碳酸钙含量有所提高。 但是, 珊瑚药材与规范炮制的奶珊瑚饮片的碳酸钙含量是否具有普遍的显著性差异, 还需要大量样品的统计分析进行评估。 通常待检验的市售奶珊瑚饮片对应的珊瑚药材的碳酸钙含量均未知。 从实际操作的可行性角度看, 碳酸钙含量可用于生产企业的内部质量控制, 但是难以用于市售奶珊瑚饮片的质量检验。
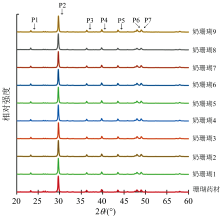
很多矿物类、 贝壳类药材的主要化学成分都是碳酸钙, 但结晶形式可能有所不同。 目前中国药典、 各省级炮制规范对于药材所含碳酸钙的鉴别方法通常是加稀盐酸产生气泡(二氧化碳)、 溶液显钙盐反应。 然而这些方法不能鉴别碳酸钙的晶型, 可能会造成一些相似药材的混淆。 因此在碳酸钙含量分析基础上, 本研究进一步使用X射线衍射法(XRD)对珊瑚药材与不同工艺炮制的奶珊瑚饮片进行了表征, 以考察奶制前后珊瑚的碳酸钙晶型是否有所变化。
如图1所示, 珊瑚药材与不同工艺炮制的奶珊瑚饮片的XRD谱图基本一致, 可以观察到7个比较明显的特征峰。 如表2所示, 奶珊瑚饮片XRD谱图中这7个特征峰的2θ 角度平均值分别为23.251(P1)、 29.670(P2)、 36.270(P3)、 39.758(P4)、 43.530(P5)、 47.997(P6)、 48.968(P7), 对应于国际衍射数据中心(ICDD)提供的标准衍射卡片PDF#29-0305的主要特征峰23.291、 29.776、 36.342、 39.782、 43.826、 48.211、 48.678, 说明奶珊瑚中的碳酸钙主要为方解石晶型。 然而奶珊瑚饮片与PDF#29-0305的特征峰位置不是完全相同, 可能是因为奶珊瑚中的其他成分使碳酸钙结晶不够纯粹。 如表2所示, α =0.05时, 奶珊瑚饮片XRD谱图中的P6特征峰的分布区间略高于珊瑚药材, 其余6个特征峰的分布区间均涵盖了对应珊瑚药材的特征峰。 由此可知, 奶珊瑚饮片与珊瑚药材的碳酸钙晶型可能没有非常显著的差异。 XRD谱图中的P6特征峰是否可以用于鉴别珊瑚药材与奶珊瑚饮片, 还需要更多样品的检验。
| 表2 珊瑚药材与奶珊瑚饮片的X射线衍射特征峰位置 Table 2 Positions of XRD characteristic peaks of the raw coral and the milk-processed corals |
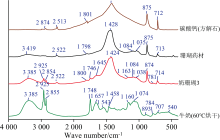
固体样品不需要分离提取、 衍生标记等处理, 可以直接进行红外光谱测试, 所得谱图能够同时反映样品中有机与无机成分的结构与含量信息。 如图2所示, 珊瑚药材的2 522、 1 798、 1 428、 875和713 cm-1等特征峰对应于方解石型碳酸钙的2 513、 1 801、 1 418、 875和712 cm-1等特征峰[9], 炮制为奶珊瑚饮片后上述特征峰没有明显变化。 表明珊瑚药材与奶珊瑚饮片中都含有大量的方解石型碳酸钙, 与前述XRD分析结果一致。 与纯碳酸钙相比, 珊瑚药材多出的3 419 cm-1峰可能是吸附水或结晶水的O— H伸缩振动吸收峰, 而1 084和1 035 cm-1主要表征硅酸盐的Si— O伸缩振动吸收等无机成分特征峰。 水分和硅酸盐等无机成分的存在可能影响碳酸钙的晶体结构, 导致上述XRD谱图上珊瑚与方解石并非完全一致。
珊瑚药材炮制为奶珊瑚饮片后, 增加了3 385、 2 925、 2 854、 1 746、 1 645、 1 163和781 cm-1等特征峰。 与炮制辅料牛奶的红外光谱比较, 上述特征峰反映了奶珊瑚饮片中含有的牛奶固形物特征: 3 385 cm-1是O— H与N— H伸缩振动吸收峰的重叠结果, 主要来自于碳水化合物与蛋白质; 2 925与2 854 cm-1分别是C— H反对称与对称伸缩振动吸收峰, 这两个特征峰可能来自于多种有机成分, 但以脂肪的贡献为主; 1 746 cm-1是C=O伸缩振动吸收峰, 主要来自于脂肪; 1 645 cm-1是O— H弯曲振动吸收峰与酰胺Ⅰ 带吸收峰的重叠结果, 表征碳水化合物与蛋白质; 1 163 cm-1是C— O伸缩振动吸收峰, 与多种有机成分相关, 但脂肪的贡献是最主要的; 781 cm-1是糖环骨架振动吸收峰, 主要来自于乳糖。
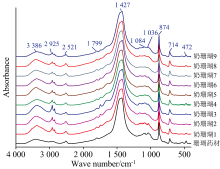
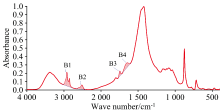
如图3所示, 不同工艺炮制的奶珊瑚饮片红外光谱吸收峰位置基本相同, 均有碳酸钙与牛奶固形物的特征峰。 根据1 427 cm-1附近的碳酸钙吸收峰对谱图进行归一化处理后, 牛奶固形物特征峰的强度在不同饮片中有所差异。 即以碳酸钙为内参时, 不同工艺炮制的奶珊瑚饮片中牛奶固形物含量有所不同, 可以反映在红外光谱特征峰强度上。 为了定量分析炮制工艺对奶珊瑚饮片中牛奶固形物的影响, 如图4所示, 对3 050~2 750 cm-1(B1)、 2 700~2 400 cm-1(B2)、 1 770~1 720 cm-1(B3)、 1 710~1 600 cm-1(B4)四个谱带的峰面积进行统计分析。
如表3所示, α =0.05时, 奶珊瑚饮片红外光谱中B1、 B3、 B4特征谱带的峰面积分布区间明显高于珊瑚药材, 而B2特征谱带的峰面积与珊瑚药材没有显著性差异。 根据上述的红外光谱指认结果, B1和B3特征谱带主要来自牛奶中的脂肪类成分, B4特征谱带主要来自牛奶中的碳水化合物与蛋白质, 而B2特征谱带是碳酸钙吸收峰。 因此, 根据B1、 B3、 B4特征谱带的峰面积区分珊瑚药材与奶珊瑚饮片, 是合理而且可行的。 区分珊瑚药材与奶珊瑚饮片的B1、 B3、 B4特征谱带的峰面积阈值还需要更多样品的统计分析来确定。 从图3和表3来看, 珊瑚药材与奶珊瑚饮片的B1、 B3特征谱带形状与强度差异最明显, 可做区分奶制前后珊瑚的最直观指标。 珊瑚药材中的水分等也可能产生B4特征谱带, 用于区分奶制前后珊瑚时存在一些不确定性。
| 表3 珊瑚药材与奶珊瑚饮片的红外光谱特征谱带峰面积 Table 3 Areas of FTIR characteristic peaks of the raw coral and the milk-processed corals |
为了进一步考察碳酸钙含量、 红外光谱4个特征谱带峰面积、 XRD谱图7个特征峰位置用于评价奶珊瑚炮制工艺是否合规的可行性, 本研究比较了正交试验中奶水比例、 煎煮温度、 干燥时间、 干燥温度4个因素对应的上述12个化学指标的R值。 由于不同化学指标的量纲不同, 本研究将各个化学指标的R值除以全部正交试验样品的该化学指标均值(结果如表4所示), 以便于比较不同化学指标对各工艺因素的敏感性。
| 表4 奶珊瑚不同化学指标正交试验R值与均值比例 Table 4 The ratios of the orthogonal experimental R values to the mean values of different chemical indicators of the milk-processed corals |
如表4所示, 各个炮制工艺因素在不同水平变化时, XRD谱图7个特征峰的位置波动很小(相对于均值的变化不超过千分之一), 说明XRD谱图7个特征峰难以用于评价奶珊瑚的炮制工艺。 碳酸钙含量对奶水比例变化的敏感度较高, 然而相对于均值的变化仅为5.7%, 说明根据碳酸钙含量有可能评价奶珊瑚炮制时的牛奶浓度, 但是需要大量样品统计分析来确定判断阈值。 红外光谱4个特征谱带的峰面积对于各个炮制工艺因素的变化都较为敏感, 说明其用于奶珊瑚炮制工艺合规性评价的潜力较大。 特别是红外光谱B1、 B3、 B4特征谱带峰面积对于奶水比例的变化都非常敏感, 进一步证明这几个谱带可以区分珊瑚是否经过牛奶煮制。
在很多传统民族医药中, 药材炮制为饮片后才能用于临床, 不同饮片具有不同的功效与用法[10]。 因此, 鉴别药材与炮制后的饮片, 或者鉴别源自同一种药材的不同饮片, 对于传统民族药物的质量控制非常必要。 本研究使用滴定分析法、 X射线衍射法、 红外光谱法, 尝试从碳酸钙含量、 碳酸钙晶型、 有机与无机成分组成等角度寻找珊瑚药材与奶珊瑚饮片的差异性化学指标。 结果表明, 珊瑚奶制前后的主要成分均为碳酸钙, 严格按照规范工艺炮制后的奶珊瑚饮片中碳酸钙含量可能略高于所使用的珊瑚药材; 珊瑚碳酸钙晶型以方解石为主, 奶制后碳酸钙晶型没有明显改变。 珊瑚奶制后吸附牛奶中的固形物, 因此奶珊瑚饮片的红外光谱有对应于蛋白质、 脂肪、 碳水化合物等的特征吸收峰。 根据3 050~2 750、 1 770~1 720和1 710~1 600 cm-1等红外光谱特征谱带的峰面积, 不仅可以区分珊瑚药材与奶珊瑚饮片, 还可能评价奶珊瑚饮片的炮制工艺是否符合规范要求。 后续研究中, 建议收集更多的珊瑚药材与奶珊瑚饮片样品, 通过统计分析进一步检验上述红外光谱特征谱带作为奶珊瑚炮制前后差异性化学指标的可靠性, 以确定是否可以将红外光谱作为客观、 量化的奶珊瑚饮片化学鉴别方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|