作者简介: 钱多, 女, 1994年生, 南华大学公共卫生学院硕士研究生 e-mail: 1070406583@qq.com
炭疽杆菌是高致病性病原微生物, 引起的炭疽病在我国属于乙类传染病, 因此建立操作简便、 灵敏准确的炭疽杆菌检测方法对预防和控制炭疽传播, 维护公共卫生安全至关重要。 该研究创新性地提出以绿色材料大豆蛋白为保护剂和还原剂, 采用微波加热法合成了一种具有强烈红色荧光发射的大豆蛋白金纳米簇(SPI-AuNCs)。 采用TEM、 UV-Vis、 FL、 XPS、 FTIR等方法表征了SPI-AuNCs的成功合成和部分特殊性能。 结果表明SPI-AuNCs呈球形, 粒径大小在1.8~3.2 nm范围内, 平均粒径为2.65 nm, 在500~550 nm范围内未出现表面等离子体共振峰; SPI-AuNCs的最大激发波长为370 nm, 最大发射波长为680 nm。 SPI-AuNCs的表面官能团主要有—NH、 —COOH、 —OH、 —SH等官能团, 元素的组成主要包括C、 N、 O、 S、 Au元素。 根据Cu2+与SPI-AuNCs表面基团通过配位作用形成非荧光复合物, 使荧光猝灭; 而2,6-吡啶二羧酸(DPA)与Cu2+具有更高的亲和力, 可将Cu2+从SPI-AuNCs表面竞争下来, 使荧光恢复, 据此建立了一种荧光“关-开”策略检测DPA的新方法。 在最佳实验条件下, 荧光恢复率(Δ F/F1)与DPA的浓度在1.15~70.0 μmol·L-1范围内呈良好的线性关系, 线性方程为Δ F/F1=0.011 c+0.131, 相关系数 r=0.991, 方法检出限为0.34 μmol·L-1。 同时, 通过加标回收实验研究了湖水和牛奶样品中DPA, 得到加标回收率在97.3%~103.6%, 表明了该方法在环境和食品样本DPA的检测中具有很大的应用潜力, 可以为环境监测和食品安全提供方法学支持。
Bacillus anthracis is a highly pathogenic microorganism. Anthrax is an infectious disease caused by Bacillus anthracis, classified as Class B of our country's statutory reporting infectious diseases. Therefore, the establishment of simple operation, rapid and sensitive detection methods for Bacillus anthracis is vital for preventing and contralling the spread of anthrax and maintaining public health security. This study innovatively proposed to synthesize soy protein gold nanoclusters (SPI-AuNCs) with strong red fluorescence emission by microwave heating using the green material soy protein as a protective agent and reducing agent.TEM, XPS, FTIR, FL, and UV-Vis characterizations were used to verify successful synthesis of SPI-AuNCs. SPI-AuNCs are spherical, which the particle size is in the range of 1.8~3.2 nm, an average diameter of 2.65 nm, and no surface plasma resonance absorption from 500 to 550 nm. The maximum excitation wavelength of SPI-AuNCs is 370 nm, and the maximum emission wavelength appears at 680 nm. The surface functional groups of SPI-AuNCs mainly include —NH, —COOH, —OH, —SH, and the element composition includes C, N, O, S, Au elements. The fluorescence of SPI-AuNCs could be quenched by the coordination between Cu2+ and surface groups of SPI-AuNCs, while DPA has a stronger chelation effect with Cu2+, which could compete for Cu2+ from the surface of SPI-AuNCs and restore the fluorescence of SPI-AuNCs. Accordingly, a new method for DPA detection based on the fluorescent “off-on” strategy was established. Under the optimal experimental conditions, the fluorescence recovery efficiency (Δ F/F1) performs a good linear relationship with DPA concentration in the range of 1.15~70.0 μmol·L-1. The linear regression equation is Δ F/F1=0.011 c+0.131 with high correlation coefficient ( r=0.991), and the detection limit is 0.34 μmol·L-1. In addition, the spiking experiments of the DPA in lake water and milk samples were performed. The spiked recoveries were 97.3%~103.6%, indicating that this method has great application potential in DPA detection for environmental and food samples, and can provide methodological guidance for environmental monitoring and food safety.
炭疽芽孢杆菌(简称炭疽杆菌)是一种需氧芽孢杆菌, 可引起人兽共患炭疽病[1]。 芽孢是炭疽芽孢杆菌在外环境中形成的一种耐干燥、 光热、 辐射和化学物质等的休眠体, 其对外环境有较强的抵抗力, 使污染的土壤、 水源、 病畜成为持久的传染源。 人类通过食用、 吸入、 皮肤接触污染物而感染。 根据感染途径不同, 炭疽分为皮肤炭疽、 肺炭疽、 肠炭疽等临床类型[2]。 皮肤炭疽最常见, 患者出现全身脏器损伤, 甚至死亡[3]。 芽孢还可以通过空气传播, 在适宜条件下重新发芽生长, 由此炭疽杆菌成为一种潜在生物战剂[4]。 因此, 快速有效地检测炭疽杆菌, 对于控制炭疽传播, 患者治疗, 保护生命健康具有重要意义。
目前, 病原学检测、 血清学检测、 分子生物学检测是炭疽杆菌的常用检测方法。 病原学检测方法操作复杂、 耗时、 检出率低; 血清学检测炭疽芽孢杆菌, 灵敏度低, 感染初期不易检出抗体; 分子生物学(PCR)检测方法, 靶点基因遗传过程中会发生丢失导致检测不稳定, 基因组序列和蜡样芽孢杆菌高度相似, 会发生交叉反应[5]。 有研究发现, 2, 6-吡啶二羧酸(DPA)或其钙盐(CaDPA)是炭疽杆菌芽孢的主要成分[6]。 因此, DPA可作为炭疽杆菌的生物标志物。 近年来, 检测DPA的方法主要有表面增强拉曼散射法[7]、 电化学法[8]和荧光分析法[9]等。 这些方法中荧光分析法由于其操作简单、 快速、 灵敏等优点得到研究者们青睐。 Pang[10]等合成了能发射橙色和绿色荧光的OG-CDs, 在Cu2+存在下, 建立CDs-Cu(Ⅱ )荧光探针检测生物标志物DPA的新方法。 Su[11]等构建了基于AIE的发光稀土Tb3+比率荧光检测水中炭疽杆菌生物标志物DPA的新方法。 Bao[12]等开发了一种基于2D MOF/CDs的比率荧光检测炭疽杆菌生物标志物DPA的荧光法。
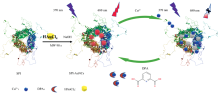
大豆蛋白是一种来源丰富、 质优价廉的植物蛋白, 根据蛋白质的含量不同, 可分为大豆分离蛋白、 大豆蛋白粉、 大豆浓缩蛋白, 其中大豆分离蛋白的蛋白质含量高达90%, 主要由白蛋白和球蛋白组成[13]。 由于蛋白质含有多种官能团(— NH、 — COOH、 — OH、 — SH等)非常适合作为合成AuNCs的模板。 Cheng等[14]研究了采用大豆蛋白分离液作为模板合成金纳米簇(SP-AuNCs)的机制。 本文以质优、 价廉、 绿色、 蛋白质含量高的大豆分离蛋白为模板, 通过微波加热合成具有红色荧光发射的大豆蛋白金纳米簇(SPI-AuNCs), 该合成方法简单, 材料环保, 不需额外添加还原剂, 大豆蛋白具有集保护剂和还原剂为一体的功能。 实验研究发现Cu2+可猝灭SPI-AuNCs的荧光, 使荧光信号呈“ 关闭” 状态获得较低的背景; 当加入DPA后, 基于DPA分子对Cu2+具有非常强的亲和力, DPA与Cu2+迅速发生反应, 导致SPI-AuNCs荧光信号“ 打开” , 据此构建了一种基于SPI-AuNCs荧光“ 关-开” 策略检测环境中炭疽杆菌生物标志物DPA的新方法。
大豆蛋白分离液(SPI, 纯度90%)购于酷尔化学科技有限公司; 氯金酸(HAuCl4)购于北京索莱宝科技有限公司; 对苯二甲酸(PTA)、 苯甲酸(BA)、 2, 6-吡啶二羧酸(DPA)(99%, 购自上海麦克林生化科技有限公司); 所用化学试剂均为分析纯; 实验用水为超纯水(电阻率≥ 18.25 MΩ · cm)。
UV2550紫外-可见分光光度计(UV-Vis, 日本岛津); F-4500荧光分光光度计(FL, 美国赛默飞); F200X G2透射电子显微镜(TEM, 美国泰勒斯); Escalab 250Xi X射线光电子能谱仪(XPS, 美国赛默飞); MS-100恒温混匀仪(杭州奥盛); IRTracer傅里叶变换红外光谱仪(FTIR, 日本岛津)。
室温条件下, 加入2.9 mL 70 mg· mL-1 SPI于锥形瓶中, 在磁力搅拌下加入1.7 mL 10 mmol· L-1 HAuCl4, 然后逐滴加入0.5 mL 1 mol· L-1 NaOH溶液, 此时溶液颜色变为浅黄色, 继续加入900 μ L超纯水, 搅拌2 min后。 微波加热1.5 min, 得到浅棕色的SPI-AuNCs, 4 ℃保存备用。
向2 mL EP管中加入50 μ L SPI-AuNCs, 50 μ L 100 μ mol· L-1的Cu2+溶液, 用PBS缓冲液定容至200 μ L, 混匀反应15 min, 再向上述混合液中加入不同浓度的DPA标准溶液, 振荡混匀, 反应3 min后, 在λ ex=370 nm下测定λ em=680 nm处的荧光强度, 计算荧光恢复率(Δ F/F1)(Δ F=F2-F1, 其中F2和F1分别表示存在和不存在DPA条件下680 nm处的荧光值)。
由于炭疽杆菌可感染动物进而导致动物制品被污染, 另外在外环境中炭疽杆菌可以形成芽孢, 拥有很强抵抗干燥、 高热、 紫外线的能力, 能持久污染水源、 土壤。 因此本文选择牛奶和环境水样作为实际样品评价方法的可行性, 样品1为当地超市购买的特伦苏纯牛奶, 样品2为公园荷花池(西湖公园)采集的水样。 牛奶通过蛋白质等电点沉淀法除去蛋白, 进一步离心10 min得到上清液, 经0.22 μ m滤膜过滤后备用; 水样经离心10 min处理后, 用0.22 μ m滤膜过滤后备用。
SPI-AuNCs荧光探针的合成及检测DPA原理如图1所示。 以大豆蛋白为模板, 微波加热1.5 min合成SPI-AuNCs。 该金纳米簇在370 nm波长激发下, 在680 nm处发射强烈的红色荧光, Stokes位移大。 由于SPI中氨基酸的— NH2和— COOH可与顺磁性Cu2+发生配位和光致电子转移作用, 导致SPI-AuNCs荧光基团电子密度降低, 使SPI-AuNCs荧光猝灭[15, 16, 17], 呈现荧光信号“ 关闭” 状态。 向荧光猝灭后的复合物溶液中加入DPA, 由于Cu2+与DPA分子的羧基或吡啶氮的螯合作用强于Cu2+与金纳米簇的配位作用, 使体系荧光恢复, 荧光信号“ 打开” 。 随着DPA浓度的增加, 荧光逐渐增强, 基于SPI-AuNCs荧光强度变化实现DPA的灵敏检测。
采用透射电镜(TEM)对制备的SPI-AuNCs进行形貌表征, 表征结果如图2(a)所示, 所合成的SPI-AuNCs呈球形, 在水溶液中分散性好。 图2(b)是SPI-AuNCs的粒径分布图, 粒径大小均匀, 主要分布在1.8~3.2 nm范围内, 平均粒径为2.65 nm。
 | 图2 (a)SPI-AuNCs的TEM图; (b)粒径分布图Fig.2 (a) TEM image and (b) particle size distribution image of SPI-AuNCs |
采用傅里叶红外光谱仪(FTIR)对SPI-AuNCs 的官能团组成进行分析。 大豆蛋白(黑线)和SPI-AuNCs(红线)的红外光谱如图3所示, 可见SPI和SPI-AuNCs均在1 523和1 645 cm-1有特征吸收, 吸收峰分别归因于C— N与C=O伸缩振动。 SPI-AuNCs在2 500和3 000 cm-1之间存在弱的S— H吸收峰。 由于SPI-AuNCs的形成, SPI在2 943 cm-1处的吸收峰出现减弱, 说明SPI与Au成功形成Au— S共价键。 比较SPI-AuNCs和SPI的FTIR光谱, 发现SPI-AuNCs与SPI具有相似的红外光谱, 表示SPI-AuNCs的形成对蛋白的表面结构没有太大影响[18]。
通过X射线光电子能谱(XPS)进一步表征了SPI-AuNCs所含的主要元素, 结果如图4所示。 图4(a)是SPI-AuNCs XPS谱图的总谱, 在284.5、 400.0、 531.0、 162.8和84.0 eV峰位处。 分别是C、 N、 O、 S、 Au元素。 图4(b)是高分辨率C(1s)谱图, 在284.5、 286.0和288.0 eV处有三个特征峰, 分别对应C=C/C— C、C— O/C— N、 C=O键[19]。 图4(c)是N(1s)光谱图, 可以观察到在399.6和400.0 eV有两个峰, 提示氨基氮和C— N键存在。 O(1s)的XPS图谱[图4(d)]显示531.0和532.9 eV处两个峰分别对应C— O键和C=O/C— OH键。 S(2p)的高分辨率光谱图[图4(e)]拟为两个峰, 分别位于161.5和162.8 eV处, 表明硫原子主要以S— H键和C— SOx(x=2, 3, 4)基团中的C— S键存在。 图4(f)是Au(4f) XPS光谱, 在87.3和84.0 eV处分别为Au(4f5/2)]和Au(4f7/2)[20], 这表明合成的SPI-AuNCs中同时存在Au(0)和Au(Ⅰ )。
 | 图4 (a)SPI-AuNCs的XPS全谱图; (b— f)C(1s)、 N(1s)、 O(1s)、 S(2p)、 Au(4f)的高分辨率图谱Fig.4 (a) XPS spectra of SPI-AuNCs; (b— f) High-resolution XPS narrow-scan spectrum of C(1s), N(1s), O(1s), S(2p), Au(4f) |
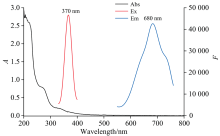
采用紫外-可见分光光度计、 荧光分光光度计对SPI-AuNCs光学性质进行表征。 紫外-可见吸收光谱图如图5(黑线)所示, SPI-AuNCs在250~350 nm之间有吸收峰, 源于大豆蛋白的色氨酸和酪氨酸等芳香族氨基酸残基[21]。 荧光光谱图(图5红线和蓝线)可见SPI-AuNCs的最大激发波长为370 nm, 最大发射波长为680 nm, Stokes位移为310 nm。 较大的斯托克斯(310 nm)使激发和发射带分开, 这样可以有效地减少自吸或自发荧光引起的干扰[22]。
为获得荧光最强的SPI-AuNCs, 优化了合成SPI-AuNCs的SPI、 HAuCl4、 NaOH溶液的浓度和微波加热时间。 结果表明, 在SPI浓度为33.8 mg· mL-1, HAuCl4浓度为2.83 mmol· L-1, NaOH溶液浓度为83.3 mmol· L-1, 微波加热1.5 min时, 合成的SPI-AuNCs荧光最强。
首先优化了缓冲液种类、 pH、 反应温度和时间对Cu2+ 猝灭SPI-AuNCs荧光的影响。 在pH 5.5的PBS缓冲溶液中, 反应温度为30 ℃, 反应15 min条件下, Cu2+对SPI-AuNCs的猝灭效果最好。 进一步考察猝灭剂Cu2+的最适用量。 随着Cu2+浓度增加, 导致SPI-AuNCs在680 nm处的荧光强度急剧降低, 当Cu2+溶液浓度大于20 μ mol· L-1时, 荧光猝灭程度变缓, 反应基本达到平衡。 综合考虑后, 选择20 μ mol· L-1的Cu2+ 进一步实验。 最后, 优化了检测DPA时需要的反应时间, 由于DPA与Cu2+反应速度较快, 反应3 min时体系荧光恢复率达到最大。 因此, 选择3 min作为最佳反应时间。
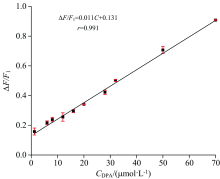
在最佳实验条件下, 测定不同DPA浓度时体系的荧光强度, 以DPA浓度C为横坐标, 荧光恢复率(Δ F/F1)为纵坐标, 绘制标准曲线。 如图6所示, 在1.15~70.0 μ mol· L-1浓度范围内, 荧光恢复率(Δ F/F1)与DPA浓度呈正相关, 线性方程为Δ F/F1=0.011c+0.131, 相关系数r=0.991。 根据公式LOD=3Sb/k计算出该方法的检出限为0.34 μ mol· L-1。 为评价该方法的精密度, 选取8.0、 16.0和40.0 μ mol· L-1三个浓度分别平行测定7次, 计算得到相对标准偏差(RSD)分别为0.65%、 2.42%、 4.19%。
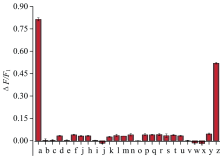
考查了实际样品中可能共存的干扰物质对测定的影响, 结果如图7所示。 以60 μ mol· L-1的DPA作为对照, 将相对误差控制在± 5%以内, 10 mmol· L-1的蔗糖、 葡萄糖、 十二烷基磺酸钠, 1 mmol· L-1的草酸、 苯甲酸、 对苯二甲酸、 半胱氨酸、 赖氨酸、 Zn2+、 S
通过检测实际样品湖水、 牛奶评价本文所建方法的可行性, 结果如表1所示。 由于不是炭疽疫区, 上述实际样品中未发现DPA。 将不同浓度标准DPA溶液加入到实际样品中, 平行测定7次, 得到加标回收率在97.3%~103.6%之间, 表明该方法准确度较好, 可用于实际样品检测。
| 表1 实际样品中DPA检测结果(n=7) Table 1 Determination results of DPA in the samples (n=7) |
以大豆蛋白为模板, 采用微波辅助法快速合成了一种稳定性好, 能发射红色荧光的SPI-AuNCs, 并建立了基于SPI-AuNCs的“ 关-开” 型荧光分析方法用于检测DPA。 当DPA的浓度在1.15~70.0 μ mol· L-1范围内浓度与荧光强度呈良好的线性关系, 方法检出限为0.34 μ mol· L-1。 将该方法应用于检测湖水和牛奶样品中DPA, 得到加标回收率在97.3%~103.6%, RSD均低于4.8%。 这些结果表明, 建立的荧光方法可为环境食品监测和公共卫生安全评价提供一种新的参考方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|