作者简介: 陈晓丽, 女, 1987年生, 北京市农林科学院智能装备技术研究中心助理研究员 e-mail: chenxl@nercita.org.cn
为了探究红、 蓝光在番茄果实着色过程中的作用关系, 在人工光型植物工厂中采用岩棉种植微型番茄, 以各发育阶段番茄果实在不同LED红蓝光模式下的反射光谱为切入点, 通过对纯红光、 红蓝组合光以及不同间隔的交替光照射下番茄果实色相指标和反射光谱的分析, 研究了不同的红蓝光照射模式对番茄果实光谱特性及着色的影响。 结果表明: (1) R6h/RB2h(纯红光/红蓝组合光6 h/2 h)交替供光模式最有利于番茄果实中呈红色素(如β-胡萝卜素和番茄红素)的积累和叶绿素的分解, 最终促成番茄果实更早地转色; R(纯红光)供光模式作用效果仅次于R6h/RB2h; 相比之下, RB(红蓝组合光)供光模式不利于番茄果实呈红色素的积累和果实着色进程。 (2) 在促进番茄果实着色方面, 红光和蓝光之间既存在协同增强效应, 也存在信号串扰引发的削弱效应, 红光与红蓝组合光以一定的间隔进行交替辐射, 能最大化地发挥单一红光与红蓝混合光在番茄果实色素代谢及果实着色方面的积极作用。 (3) 转色期番茄果实红绿区域反射比(Red/Green)、 修正叶绿素吸收比指数(MCARI)、 光化学反射指数绝对值(|PRI|)等光谱参量所反映出的色素含量变化动态与Hue值所反映的番茄果实色相一致, 该时期番茄果实反射光谱特性与果皮着色有较高的统一性, 转色期番茄果实的反射光谱能够更好地反映番茄果实着色程度和着色进程。
In order to explore the role of red and blue light in the coloring process of tomato fruit, the micro tomato was planted with rock wool in an artificial light plant factory and irradiated with different lighting modes such as pure red light, combined red and blue light and alternating red/blue light. The reflection spectrum and hue index of tomato fruits at different development stages were analyzed to study the effects of red and blue irradiation modes on the spectral characteristics and coloring of tomato fruit. The results showed that: (1) The alternating irradiation mode of R6h/RB2h (pure red light/combined red and blue light, 6 h/2 h) was the most beneficial to the accumulation of the red pigments (e. g. β-carotene and lycopene) and the decomposition of chlorophyll, finally led to the earlier color conversion of tomato fruit; The effects of R (pure red light) was second only to R6h/RB2h; In contrast, the mixed irradiation mode of RB (combined red and blue light) was not conducive to the accumulation of red pigments and fruit coloring process of tomato fruit. (2) There are both synergistic enhancement effects and signal crosstalk weakening effects between red and blue light in promoting tomato fruit coloring. The alternated irradiation of R and RB may maximize the positive effects of single red light and mixed red and blue light in tomato fruit coloring. (3) The dynamics of pigment content reflected by spectral parameters such as Red/Green, MCARI, |PRI| of tomato fruit in the color conversion period displayed consistent with the color of tomato fruit reflected by Hue value, the reflection spectral characteristics of tomato fruit in this period were highly unified with peel coloring. The reflection spectrum of tomato fruit in the color conversion period can better reflect the degree and process of tomato fruit coloring.
光是影响蔬菜和水果色素代谢的重要环境因素之一, 植物通过至少多种类型的光感受器来感知光及探测光谱的特定区域, 如光敏色素(PHYs)是吸收红光-远红光可逆转换的光受体蛋白, 隐花色素(CRYs)和光促蛋白(PHOTs)则是吸收波长为390~500 nm的蓝光受体色素蛋白, 这些光感受器收集光子信息并将其转导为基因表达的变化, 从而调节植物的发育和分化[1]。 色素是影响植物在可见光区域光谱特征的决定性因素, 番茄果实的颜色主要由叶绿素、 番茄红素和β -胡萝卜素等色素的含量所决定, 类胡萝卜素(如β -胡萝卜素和番茄红素)及其分解代谢物对人类健康非常重要, 番茄及其衍生产品是类胡萝卜素的主要食物来源之一, 人类饮食中番茄红素摄入量的80%以上均来自于番茄[2]。
在番茄果实成熟过程中叶绿体转化为质体, 导致叶绿素分解和类胡萝卜素色素的合成, 促成番茄果实从绿色到红色的典型颜色变化。 据报道, 番茄果实转色期或果实采后增加红光光照能够促进番茄红素的生物合成, 如采后番茄果实经过红光的连续照射, 其果实内番茄红素和β -胡萝卜素含量均显著增加; 有研究发现红光处理的离体番茄果实比黑暗处理的对照果实内番茄红素增加了2.3倍, 红光激活PHY以抑制光敏色素相互作用因子(PIF)蛋白质的积累, 从而增加植物烯合酶(PSY)的表达, 由此诱导番茄红素的积累[3, 4, 5]。 然而, 有研究表明, 在番茄转色期间蓝光也可以提高番茄果实中番茄红素的含量, 认为蓝光受体CYR1a的高度表达能够导致番茄中番茄红素含量的升高; 另有研究认为, 红蓝组合光(2R1B)更有利于番茄果实番茄红素的积累[6, 7, 8]。 目前虽然大部分研究认为纯红光最有利于促进番茄红素的积累, 但是也有研究表明纯蓝光、 红蓝组合光可能更有利于番茄红素的积累, 因此红光和蓝光在番茄果实色素积累过程中的作用目前并无定论。 植物的反射光谱特性主要取决于色素分子对光的吸收特性, 番茄果皮着色反映了多种色素积累和分解的综合结果, 虽然目前用高光谱遥感技术精确估计植物色素已成为多个学科的科学家研究热点, 然而, 关于番茄果皮反射光谱特性与果皮着色的关系却鲜有报道。 研究表明, 基于近红外波段和叶绿素吸收波段(红波段) 或叶绿素反射波段(绿波段)构建的多个光谱参量中, 在以反射率为基础计算时, 与叶片叶绿素a、 叶绿素b和类胡萝卜素含量间存在极显著相关性, 而以吸收率为基础计算时, 与色素含量间不存在相关性[9, 10]。 本研究在人工光型植物工厂中采用不同模式的LED红、 蓝光照射番茄, 通过对各发育阶段番茄果实在不同供光模式下的果实色相指标和反射光谱的分析, 研究了不同红蓝光照射模式对番茄果实光谱特性及着色的影响, 为揭示红、 蓝光在番茄果实着色过程中的作用关系以及采用光控手段提升番茄果实商品价值提供一定的理论基础。
本试验在北京市农林科学院智能装备技术研究中心的全人工光型植物工厂中进行, 试验光源采用本中心研制的LED植物光配方调控系统, 该系统可以设置不同光谱、 光量配比以及供光模式等。 植物工厂内昼/夜温度为24 ℃/20 ℃, 空气湿度65%, CO2浓度450 μ mol· mol-1, 试验材料为微型番茄(Solanum lycopersicum L. cv. Micro Tom)。 将番茄幼苗用山崎营养液在岩棉块上培养, 营养液pH、 EC分别保持在6.5和2.8 mS· cm-1左右, 每7天更新一次营养液; 光照条件为LED白光, 植株顶端光强度为200 μ mol· m-2· s-1光合光量子通量密度(PPFD), 光期为16 h。 花后(DAA)10 d将植株置于以下五种不同的红蓝供光模式进行培养(光期均为16 h, 红、 蓝光峰值波长分别为660和450 nm; 试验处理见表1):
| 表1 不同红蓝光供光模式 Table 1 Different irradiation modes of red and blue light |
(1) 纯红光模式(R), 光强度为200 μ mol· m-2· s-1;
(2) 红蓝混合光模式(RB), 红、 光强度分别为130和70 μ mol· m-2· s-1;
(3) 纯红光与红蓝混合光交替模式(R2h/RB6h), 即纯红光照射2 h后红蓝混合光照射6 h, 一个光期(16 h)内2次循环; 纯红光时光强度为200 μ mol· m-2· s-1; 红蓝混合光时红、 蓝光强度分别为130和70 μ mol· m-2· s-1, 下同。
(4) 纯红光与红蓝混合光交替模式(R4h/RB4h), 即纯红光照射4 h后红蓝混合光照射4 h, 一个光期内2次循环;
(5) 纯红光与红蓝混合光交替模式(R6h/RB2h), 即纯红光照射6 h后红蓝混合光照射2 h, 一个光期内2次循环。
在番茄植株开花后36、 47和58 d分别取样, 取样时期代表的果实发育阶段分别为果实绿熟期(36DAA)、 果实转色期(47DAA)以及果实完熟期(58DAA)。 每处理选取4颗番茄植株进行果实摘取, 共取8个果实, 重复三次; 每个果实赤道线上选取三个不同的点进行测量, 以平均值计算。 番茄果实着色及在400~700 nm光谱范围的反射率用分光测色仪(YS3010)进行测定, 对L* , a* , b* 空间和数据进行处理以获得色调。 色相角Hue(单位: 度)用以反映番茄果实着色, 数值越大, 果实越绿; 反之, 数值越小, 果实越红。 光化学反射指数(PRI)用以反映类胡萝卜素与叶绿素的比率; 光谱中红色和绿色区域的反射比(Red/Green)用以反映花青素与叶绿素的比率; 修正叶绿素吸收比指数 (MCARI), 用以反映叶绿素的变动, 计算公式如式(1)— 式(4)
数据采用Excel、 Spss软件进行统计分析。
如表2, 番茄果实从绿熟期到转色期再到完熟期, L* 值逐渐变大, a* 值逐渐变小, b* 值先变大后变小, 而Hue逐渐变小。 36(DAA)绿熟期, 不同红蓝光模式下番茄果实Hue值差异不大, 最大值仅比最小值高1.7%。 47(DAA)转色期, 不同红蓝光处理下番茄果实Hue值差异较大, 表现为R6h/RB2h< R< R4h/RB4h< R2h/RB6h< RB; 其中, R6h/RB2h处理下Hue值最小为50.66, 比RB处理下的最大值(79.88)降低了36.6%, 而R次之, 比RB处理下的Hue值降低了25.1%; 由模拟色可见, 47(DAA)转色期R6h/RB2h和R处理下番茄果实果皮颜色最红, 而RB处理下番茄果实颜色最偏绿, 结果表明R6h/RB2h和R两种供光模式有利于番茄果实中红色素(如β -胡萝卜素和番茄红素)的积累和叶绿素的分解, 最终促成番茄果实更早转色, 相比之下, RB处理不利于番茄果实红色素的积累或叶绿素的分解。 58(DAA)完熟期, 番茄果实Hue值以R处理下最低, R4h/RB4h和R6h/RB2h处理下次之, 同时这三个处理下番茄果实颜色最红。
| 表2 不同红蓝供光模式下番茄果实色相值及模拟色 Table 2 Hue value and simulated color of tomato fruit under different irradiation modes of red and blue light |
表3为不同处理下各发育阶段番茄果实在蓝光/绿光/红光光谱区域的平均反射率以及三个光谱参量值。 结果显示, 伴随果实转色发育, 果实在蓝、 绿光区域的反射率逐渐下降, 而在红光区域的反射率总体上升。 Red/Green和|PRI|均逐渐上升, 表明果实中花青素和类胡萝卜素的积累量逐渐增多; 而MCARI值下降, 表明果实中叶绿素逐渐分解, 积累量下降。 47(DAA)转色期, 不同红蓝光处理下番茄果实Red/Green值表现为R6h/RB2h> R> R4h/RB4h> R2h/RB6h> RB, 与Hue值的变化相反; MCARI值表现为R6h/RB2h< R< R4h/RB4h< R2h/RB6h< RB, 与Hue值的变化相同; |PRI|表现为R> R6h/RB2h=R4h/RB4h> R2h/RB6h> RB, 接近于Hue值的变化。 总体上, 转色期Red/Green、 MCARI、 |PRI|值所反映出的色素含量变化动态与Hue值所反映的番茄果实色相一致。
| 表3 不同红蓝供光模式下番茄果实光谱参量 Table 3 Spectral parameter of tomato fruit under different irradiation modes of red aod blue light |
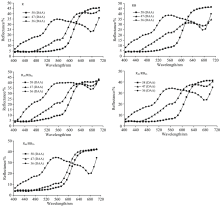
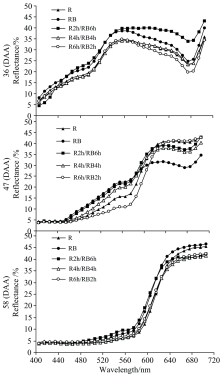
图1为不同红蓝光处理下各发育时期番茄果实的反射光谱曲线。 由图1可见, RB处理下47(DAA)转色期和58(DAA)完熟期的反射光谱曲线交点为620 nm, 在小于620 nm的光谱区域47(DAA)果实反射率均高于58(DAA)果实, 在大于620 nm的光谱区域相反; R, R2h/RB6h, R4h/RB4h处理下47(DAA)转色期和58(DAA)完熟期的反射光谱曲线交点为640 nm, 在小于640 nm的光谱区域47(DAA)果实反射率均高于58(DAA)果实, 在大于640 nm的光谱区域相反。 反射光谱曲线在红光区域的交点和走向反映出果实转色期到完熟期的颜色变化幅度, 交点出现越晚说明转色期和完熟期果实颜色差异越小, 即转色进度越快。 与RB处理相比, R, R2h/RB6h, R4h/RB4h处理下47(DAA)和58(DAA)果实反射光谱曲线在红光区域的交点后移, 反映出这三个处理更有利于番茄果实的着色进程。 R6h/RB2h处理下47(DAA)转色期和58(DAA)完熟期的反射光谱曲线交点为660 nm, 在小于660 nm的光谱区域47(DAA)果实反射率均高于58(DAA)果实, 而在大于660 nm的光谱区域二者反射率基本一致, 说明该处理下转色期的番茄果实着色水平与成熟期差异最小, 即R6h/RB2h处理最有利于果实着色。 图1关于果实反射光谱曲线的分析结果与前述Hue值所反映的番茄果实色相基本一致, 即R6h/RB2h处理最有利于加快番茄果实着色进程, 而RB处理在所有光处理中最不利于果实着色。 这说明, 在促进番茄果实着色方面, 红光和蓝光之间既存在协同增强效应, 也存在信号串扰削弱效应, 红光与红蓝混合光以一定的间隔进行交替照射番茄能最大化地发挥单一红光与红蓝混合光在番茄果实色素代谢及果实着色方面的积极作用。
图2为各发育阶段不同光处理下番茄果实的反射光谱曲线。 36(DAA)绿熟期番茄果实在可见光光谱区域反射率呈先升高后下降再升高的波动趋势, 反射光谱曲线拐点分别为550和660 nm, 不同处理间番茄果实在可见光光谱区域反射率表现为R6h/RB2h< R≈ R4h/RB4h< RB< R2h/RB6h。 47(DAA)转色期和58(DAA)完熟期番茄果实在可见光光谱区域反射率基本均呈现上升趋势。 47(DAA)转色期不同处理间番茄果实在可见光光谱区域反射率表现为, 小于620 nm的区域: R6h/RB2h< R< R4h/RB4h< R2h/RB6h< RB; 大于620 nm的区域, R6h/RB2h> R> R2h/RB6h> R4h/RB4h> RB, 结果与Hue值基本一致。 58(DAA)完熟期不同处理间番茄果实在可见光光谱区域反射率差异不大。 因此, 转色期番茄果实反射光谱特性与果皮着色有较高的一致性, 转色期番茄果实的反射光谱能够更好地反映番茄着色程度和着色进程。
光是植物光合作用的能量来源, 通过光合色素的吸收和转化进行光合作用, 最终光能转变为化学能贮存在植物体中。 同时光也作为重要信号调节植物色素的合成与代谢, 不同光质对植物色素的影响不同, 与不同光质光受体之间的信号通路有关。 番茄果实转色进程快慢影响其商品生产周期, 而果皮色泽也直接影响其商品价值, 番茄果实转色进程和果皮色泽均取决于发育期果实内色素的合成和代谢。 因此, 通过光控方式干预番茄果实转色是一条提升番茄商品经济效益的途径。
以往研究表明, 红、 蓝光在番茄果实转色过程中都有正向的促进作用, 而红光最有利于番茄中类胡萝卜素的积累和叶绿素的分解。 本研究结果表明, 当蓝光和红光混合照射番茄果实时, 番茄果实转色效率不及纯红光照射, 说明蓝光对红光在作用于番茄果实色素代谢过程中有一定的干扰作用, 即蓝光削弱了红光的积极作用。 本研究同时发现, 当红光与红蓝组合光以一定的时间间隔交替照射番茄时, 番茄果实转色效率明显高于红蓝组合光, 而当红光与红蓝组合光以6 h红光/2 h红蓝组合光的模式照射时, 番茄转色效果优于纯红光。 不同红蓝光照射模式下番茄果实转色效果由优到差呈现的顺序为: R6h/RB2h, R, R4h/RB4h, R2h/RB6h, RB。 由表1可知, R2h/RB6h, R4h/RB4h, R6h/RB2h处理间总光量子数相等, 其不同在于红光量子数逐渐上升、 蓝光量子数逐渐减少, 从结果来看, 极少量的蓝光与红光组合优于纯红光, 这说明蓝光与红光在R6h/RB2h处理中有一定的协同作用。 红、 蓝光通过光受体完成信号转导, 红、 蓝光的相互作用与其信号转导路径有关, 据报道红光受体光敏色素与蓝光受体隐花色素和光促蛋白在不同环境状态或生理活动下表现出协同或拮抗关系, 红、 蓝光的信号转导途径可能存在信号串扰或放大[11]; 即R6h/RB2h处理可能既充分发挥了纯红光的促转色效应, 最大程度地避免了红、 蓝光信号转导通路之间的信号串扰或拮抗作用, 同时少量的蓝光与红光混合照射一定时间, 激发了红、 蓝光在该生理活动中的协同增效作用。 尽管红、 蓝光在某一生理活动中的相互作用机制较为复杂, 探索适宜的红蓝光照射模式, 充分发挥其增效作用, 降低其拮抗作用是通过精准定量光学控制手段提高园艺生产效益的有效途径。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|