作者简介: 徐际童, 女, 1998年生, 沈阳农业大学工程学院硕士研究生 e-mail: 744178547@qq.com
黄瓜白粉病是一种传播速度快、 发生频率高的蔬菜病害, 一旦爆发将对产量产生严重的打击, 因此对黄瓜白粉病的识别与尽早防治具有重要的意义。 采用便携式光谱仪采集了黄瓜叶片的近红外光谱反射率曲线与荧光光谱强度曲线, 采用LI-6400光合作用测量仪测量叶片的光合速率, 并采集了叶片的图像信息。 首先, 采用图像分割技术对白粉病进行等级划分; 其次, 对净光合速率与光谱之间进行相关性分析; 最后, 利用定性分析以及定量预测两种方法, 结合黄瓜患白粉病叶片及健康叶片的光合速率指标建立白粉病检测模型。 从分析结果可知, 利用二值化将黄瓜叶片区域作为感兴趣区域(ROI)分割出, 根据R-G-B与L*a*b*色彩空间中颜色的差异可以有效提取白粉病斑面积; 通过皮尔逊相关性分析光合速率与光谱之间的相关性强度, 得到光合速率与光谱具有较强的负相关, 并且随着反射率及光谱强度的增高, 相关性减弱, 表明采用光谱及相关性较大的波段对光合速率进行预测具有可行性; 经过准确率比较, 选择集成学习(ensemble learner)中的子空间判别(subspace discriminant)算法对定性模型进行最终分析, 得到近红外光谱模型更加稳定, 识别准确率更高; 采用偏最小二乘回归模型(PLSR)进行定量预测, 通过比较7种不同的预处理方法, 验证得知MSC预处理可以有效去除光谱干扰信息, 其中近红外光谱模型 R2更高, 且RMSEP<RMSEC。 预测值与实际测量值对比可知, 近红外光谱模型得出的预测值与实际测试值更相近, 且健康样本与患白粉病样本区分明显, 表明该模型具有更高的鲁棒性。 结果表明, 利用近红外光谱与光合速率指标相结合建立的模型以及图像识别系统可以实现对黄瓜白粉病的快速识别与病情分级, 为黄瓜病害诊断提供了方法和参考依据。
As a disease with fast transmission speed and high frequency, cucumber powdery mildew will deal a serious blow to cucumber yield once it breaks out; therefore, it is of great significance for the identification and early prevention of cucumber powdery mildew. This study, used a portable spectrometer to collect the reflectance curves of near-infrared (NIR) spectral and the intensity curves of fluorescence spectral of cucumber leaves. LI-6400 photosynthetic meter was used to measure the photosynthetic rate of cucumber leaves, and we also collected the image information of cucumber leaves.Firstly, powdery mildew was classified by image segmentation. Secondly, the Pearson Correlation between net photosynthetic rate and spectrum was analyzed. Finally, Finally, a powdery mildew detection model was established using qualitative analysis and quantitative prediction methods combined with photosynthetic rate indexes of cucumber leaves. The results showed that the cucumber leaf region was segmented by binarization as the region of interest (ROI), and the powdery mildew spot area could be extracted effectively according to the color difference between RGB and L*a*b* color space. Pearson Correlation analyzed the correlation between the photosynthetic rate and the spectrum. Results showed that the photosynthetic rate and the spectrum were negatively correlated. The correlation weakened with the increasing reflectivity and spectral intensity, which indicated that it is feasible to predict the photosynthetic rate using bands with intense spectral correlations. After comparing the prediction accuracy, the qualitative model was finally analyzed by the Subspace Discriminant algorithm in Ensemble Learner, and the NIR spectrum model was stable, and the recognition accuracy was high. The PLSR model was used for quantitative analysis, and the MSC was used as a preprocessing method to effectively remove spectral interference information, of which the R2 obtained by the NIR spectrum model was high, and the RMSEP was smaller than the RMSEC. In addition, the predicted results of the NIR spectral model were more similar to the expected values, and the healthy samples were clearly distinguished from the ones with powdery mildew infection, indicating that the model is highly robust. The above results showed that the image recognition system and the photosynthetic rate detection model based on NIRspectroscopy could be used to identify cucumber powdery mildew and classification quickly and accurately, which provided a method and reference for the diagnosis of cucumber disease.
黄瓜是我国主要的蔬菜种植科目以及大众主要消费蔬菜品种之一。 但黄瓜种植的过程中经常受到各种病害的危害, 特别是白粉病的侵害, 严重的影响品质, 造成巨大经济损失[1]。 白粉病是一种由白粉菌侵染、 在温室蔬菜栽培中普遍发生的病害, 其病原物会形成霉层从而覆盖植物叶片, 减少光照面积, 影响其正常的光能吸收、 传递和转换, 从而影响植物的光合速率, 以及降低植物体的叶绿素含量, 抑制光系统的正常工作, 造成严重减产[2]。
目前, 传统的理化检测与感官诊断方法需要耗费大量的人力, 往往无法兼顾大面积的病情地区, 故而利用作物叶片光谱和图像差异进行病害信息的快速获取及检测对黄瓜、 番茄等作物白粉病的识别具有重要的意义。 白雪冰等[3]将全光谱分为若干个区间分别建立偏最小二乘(partial-least squares regression, PLSR)模型, 将其中小于全波段交叉验证均方根误差(root mean square error of cross validation, RMSECV)的区间建立光谱联合区间, 与成功分割白粉病病斑的图像融合建立黄瓜白粉病检测SI-PLSR模型, 有效去除光谱数据中冗余信息。 Ma等[4]利用过量红指数(ExR)、 HSV色彩空间的H分量和L* a* b* 颜色空间的b* 分量组成了综合色彩特征, 实现了野外环境黄瓜霜霉病病斑和复杂背景的精细识别。 张鹏等[5]采用机器视觉和人工神经网络, 借助白斑区域面积比、 平均面积、 白斑覆盖率等三个特征参数, 实现了对叶片染病程度的定量分析及模式分类; 四类白斑叶片的正确识别率分别为88%、 91%、 92%和94%[5]。 针对白粉病的严重程度及病情等级区分, 沈文颖等[6]采用高光谱特征对白粉病进行严重度估算, 在可见光与近红外光波段, 采用光谱参数MCARI和VARIgreen建立了最佳的估算模型, 10%严重度为白粉病识别诊断的临界值。 龙腾等[7]结合SF-SPAD值和PCA-SVM二分类建立了白粉病感染与否及感染等级监测模型, 可以降低采样数量提高效率。 冯伟等[8]利用高光谱估测技术综合分析了光谱反射率、 光谱特征参数与叶绿素之间的关系, 建立了估算模型, 得到NDAI(α 、 β )是估测白粉病胁迫下叶绿素密度的可靠指标。 Li等[9]等利用求解光谱表征的线性最优方程, 对黄瓜病害的分布及病情等级进行了定量测量。
在蔬菜病害检测方面近红外光谱以及高光谱成像技术已经被普遍的应用, 而荧光光谱广泛应用于中药真伪、 质量优劣等方面的检测, 是一种快携、 准确的检测手段。 针对目前利用荧光光谱识别病害研究较少的现状, 以黄瓜白粉病为研究对象, 采用近红外光谱与激光诱导荧光光谱对比的方法, 结合光合速率(Pn)参数建立黄瓜白粉病定性分析及定量预测模型, 寻找二者对白粉病检测的区别, 以及白粉病对光合作用的影响, 同时对照图像识别病斑分割、 分级结果, 旨在找到一种更加经济、 快速、 无损的判别黄瓜白粉病的方法。
光谱采集选用杭州SPL谱镭光电技术有限公司生产的USB2000+近红外光谱试验平台以及USB4000+激光诱导荧光光谱试验平台, 光谱检测范围为350~1 100 nm。 设定好参数后将设备预热30 min, 待谱图稳定储存其反射率及强度的光谱数据。 光合速率的检测采用美国LI-COR公司生产的便携式LI-6400光合作用测量仪, 测量之前将仪器预热15~20 min, 检查缓冲瓶稳定情况, 打开叶室夹住待测量活体叶片, 待显示器上所有数据稳定在正常范围内时记录其Pn值。
实验材料取自沈阳农业大学北山科研基地, 选取45个黄瓜白粉病叶片、 45个黄瓜健康叶片进行识别, 抽取其中60个作为建模集, 其余30个作为预测集。 光谱采集软件为海洋光学提供的Ocean Optics SpectraSuite软件, 通过调整参数, 设置近红外光谱的积分时间为100 ms, 平均次数为5, 平滑度为1; 荧光光谱积分时间为65 ms, 平均次数为9, 平滑度为1, 激光电流强度为1.645 A。 获取的光谱图像如图1所示。 选取可见-近红外光谱的490~900 nm和荧光光谱的640~788 nm作为分析研究的谱区。
图1(a)所示的近红外光谱图, 可以看出在550、 680、 750 nm波段范围内出现了波峰; 图1(b)所示的为激光诱导荧光光谱图像, 波峰出现在红荧光(red fluorescence, RF, 波长690 nm附近)和远红荧光(far-red fluorescence, FRF, 波长740 nm附近)[10], 主要由叶片中非叶脉区域产生。
计算机视觉和图像处理在农业领域的应用逐渐增多, 但将叶片从复杂背景的图像中识别出来还是具有一定的困难[11], 由于待分析的黄瓜叶片主要为绿色, 因此以白色的非反光的卡纸为背景以突出显示叶片区域。 选择Nikon-D7500型号相机搭配18~140 VR镜头作为图像采集设备, 采集到的彩色图像的分辨率为5 568× 3 712 pixels。 调整镜头焦距使得叶片大小在图像中的大小适中, 成像清晰。 调整好后, 固定相机与镜头, 光照条件为自然光照, 即可进行图像采集。
采用皮尔逊相关系数(pearson correlation)对光合速率与光谱数据之间的相关性进行分析。 在统计学中, 皮尔逊相关系数广泛用于度量两个变量之间的相关程度, 其值介于-1与1之间, 0代表无相关性, 负值为负相关, 正值为正相关。 两个变量之间的皮尔逊相关系数定义为两个变量之间的协方差和标准差的商。 皮尔逊相关系数常用英文小写字母r表示, 其表达式如式(1)所示。
式(1)中,
定性分析采用MATLAB2018中内置Classification Learner工具箱进行模型的训练, 其中包括多种分类算法, 如决策树(Tree)、 支持向量机(SVM)、 K-近邻算法、 集成学习(Ensemble leaner)等, 此工具箱还具备数据的特征选择、 方案验证、 训练模型、 检验训练结果等功能, 有着良好的人机交互性。 在交叉验证(cross-validation)后得到每种算法的分类准确率, 选择合适的算法模型。
定量预测模型采用The unscrambler10.4软件, 分析方法为偏最小二乘回归方法(partial-least squares regression, PLSR), 此方法是一种用于对多个样本对应多个因素进行建模分析的方法。 建模前, 对光谱信息进行多种预处理以减少噪声的干扰, 通过比较模型精度R2、 校正均方根误差(root mean square error of calibration, RMSEC)以及预测均方根误差(root mean square error of prediction, RMSEP)确定最终的定量预测模型, 并得到预测数据与实测数据进行对比。
为避免背景对识别结果的影响, 首先需要进行图像的灰度化与增强处理。 图像处理采用德国MVtec公司开发的HALCON机器视觉软件。 如图2所示, 将图像分为红(R)绿(G)蓝(B)三通道, 可以看出三个通道中R与B通道中叶片整体与背景对比较为明显, 但一些枯萎叶片边缘所产生的泛黄卷曲可能影响后续对叶片区域的分割以及白粉病斑的识别。 L* a* b* 色彩空间是一种与设备无关的颜色模型, 也是一种基于生理特征的颜色模型[12]。 L* a* b* 颜色空间模型由三个要素组成, 亮度通道L* , 红绿颜色通道a* 以及黄蓝颜色通道b* 。 因此, 这种色彩空间对颜色的鲜艳程度及其变化非常敏感。 由图2, a* 与b* 通道中, 叶片的颜色差别较大, 可采用二者做差的方式对叶片区域进行增强。 采用式(2)中计算方式对图像进行灰度化与增强处理, 得到的增强图像如图2(h)所示, 可以看出此时叶片区域与背景区域的对比度明显增强。
式(2)中, gsub为所得到增强图像的灰度值; ga为a* 通道图像的灰度值; gb为b* 通道图像的灰度值。
将黄瓜叶片区域作为感兴趣区域(region of interest, ROI), 因此图像增强后需要采用二值化的方法将叶片区域从背景区域中分割开。 采用了一种背景区域灰度值作为参考的方法进行阈值选取, 经过多次试验对比选取为30。 由于在增强图像中背景区域灰度值高于叶片区域, 因此二值化操作实现如式(3)所示。
式(3)中: gbina为叶片增强图像二值化操作惑的灰度值; gm为两矩形区域的平均灰度值; gsub为增强后的图像的灰度值; Offset为阈值补偿值。
完成二值化处理后, 识别到的叶片区域存在一些空洞如图3(a)所示, 因此采用形态学操作[13]对二值化结果进行了处理。 首先, 采用闭操作对这些孔洞进行填充处理, 为防止闭操作对边缘处的填充效果, 又进行了腐蚀操作, 最终得到的ROI区域如图3(b)所示, 其中红色区域代表灰度值为1, 黑色区域表示灰度值为0。 可以看出得到的叶片区域正确且完整。
图2(b)和(d)的R和B通道中, 白色的病斑与绿色的叶片区域对比明显, 因此, 将二者进行一定灰度调整系数(选取0.95)的相加, 使得患病区域增强, 但不增强叶片其他区域, 如图4(a)所示。 而后进行二值化处理, 即可得出所需的病斑区域。 计算方法如式(4)所示
式(4)中, Gbina为病斑增强图像二值化操作后的灰度值; f为灰度调整系数。
完成二值化处理后, 识别到的病斑区域如图4(b)所示, 为避免一些噪声点对其造成的干扰, 基于白粉病发病通常呈显斑块状的特征, 选取面积在800 pixels以上的区域作为最终的患病识别结果, 以患病区域面积占叶片区域总面积的百分比对比白粉病患病级别判断标准。 根据国家农业行业标准(NY/T 1857.2— 2010)的“ 黄瓜抗白粉病鉴定技术规程” 中的病情分级表, 将图像识别的白粉病斑进行病情分级即可得出最终的患病区域覆盖情况与最终的诊断情况。 按表1所示的病情级别划分表, 45个患白粉病的黄瓜叶片中, 1级有9个, 2级6个, 3级12个, 4级12个, 5级6个。 选取其中6幅典型的叶片病情分级结果, 如图5所示。
| 表1 黄瓜白粉病病情级别划分 Table 1 Classification of cucumber powdery mildew disease |
当白粉病菌侵入叶肉细胞后, 叶绿体遭到破坏, 引起细胞水分流失, 色素、 水分的吸收作用减弱, 导致染病叶片光谱反射率增高[14], 叶绿素发射荧光的能量与用于光合作用的能量是相互竞争的关系[15], 当黄瓜叶片受到白粉病侵染时, 不仅使叶绿素含量降低, 更主要的是使光合作用效率降低, 随着白粉病病情的加重, 光合速率降低、 荧光强度增高。 不同病情分级下, 两种光谱的谱图如图6和图7所示。
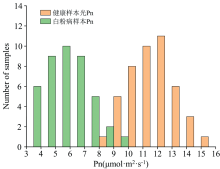
光合速率作为衡量叶片健康与否的重要指标, 除了水分、 CO2, 叶绿素也是重要的影响因素, 它决定了叶片对光能的选择、 传递和分配。 叶绿素分子吸收能量后跃迁到高激发态, 在退激过程中发出比入射光的波长长的出射光, 这种光被称为叶绿素荧光, 其与光合作用存在一定的竞争性即负相关性, 因此被称作植物光合作用的无损探针。 当白粉病干扰到叶片正常的光合作用时, 荧光强度会增强, 反之则减弱。 图8所示为90个黄瓜叶片样本的光合速率Pn值分布情况, 健康叶片的光和速率Pn平均值为11.803, 患白粉病叶片的光合速率Pn平均值为5.546, 健康叶片的光合速率Pn值高于患白粉病叶片的光合速率Pn值。
光合速率Pn值与近红外光谱和激光诱导荧光光谱进行皮尔逊相关性分析, 结果如图9所示。 由图9(a)可知光合速率Pn值与光谱具有负相关性, 与近红外光谱在680~700 nm波段范围内具有较强负相关, 相关系数可达到0.619; 与荧光光谱在660~670、 690~710和750~760 nm波段附近都存在相关性陡然变化的情况, 如图9(b), 并且都有伴随光谱强度的增强相关性减弱的现象。 因此采用原始光谱及相关性较大的波段对光合速率进行预测具有可行性。
通过MATLAB中Classification Leaner工具箱对近红外光谱、 荧光光谱与光合速率数据进行了模型训练。 各种算法的准确率如图10所示, Ensemble-Subspace Discriminant算法的识别精度更高可达到98.3%, 该种算法预测速度及训练速度虽不及其他几种算法, 但对于中小规模的数据集, 精度高, 性能好。 在模型的训练与验证过程中, 给定患病叶片类别标签为“ 1” , 健康叶片类别标签为“ 0” , 并将其设置为响应值, 通过将模型输出的响应值与已知的类别对比, 经验证后各模型算法准确率如表2所示。
| 表2 验证后各算法准确率(%) Table 2 The accuracy of each algorithm after validation |
经过6种算法准确率的比较, Ensemble-Subspace Discriminant算法的准确率相对较高, 以此来完成黄瓜白粉病与健康叶片的分类模型构建。 将30个样本作为测试集进行模型的验证, 图11(a)中近红外光谱模型中15个健康样本与15个患白粉病样本均预测准确, 图11(b)中有两个健康样本被误判为患病样本。 由此可证明光合速率与近红外光谱结合建立的定性分析模型对白粉病的识别准确率更高, 能够实现对黄瓜白粉病叶片和健康叶片的识别。
利用PLSR完成黄瓜白粉病与健康叶片光合速率定量模型的构建, 首先经过平滑处理、 光程校正处理、 微分处理等预处理方法的比较, 最终得到光程校正中MSC方法可以有效去除干扰信息。 通过近红外与荧光光谱PLSR模型的对比得到, 近红外光谱结合光合速率的模型精度R2(0.977 8)高于荧光光谱模型精度0.930 6, 其校正均方根误差(0.570 9)和预测均方根误差(0.548 5)相对较小, 且RMSEP(0.548 5)< RMSEC(0.570 9)。 两种光谱模型光合速率Pn值实际测量结果与预测结果对比图如图12所示, 前15个患白粉病样本与后15个健康样本区分明显, 与前文相呼应, 且近红外预测值更接近实际测量值, 由此可以得到近红外光谱+光合速率模型具有更高的鲁棒性。
以黄瓜白粉病为研究对象, 采取近红外光谱与激光诱导荧光光谱相对比的方法, 结合光合速率指标进行分析, 采用Ensemble-Subspace Discriminant与PLSR分别建立黄瓜白粉病叶片和健康叶片的定性分析与定量预测模型, 并利用图像识别病斑面积进行了黄瓜白粉病病情等级的划分, 实现了黄瓜白粉病的快速准确识别。
(1)光合速率Pn值与光谱在某些波段具有较强的负相关, 并且随着光谱反射率及强度增强, 相关性减弱。
(2)利用二值化方法将黄瓜叶片区域作为感兴趣(ROI)区域分割出, 根据RGB与L* a* b* 色彩空间中的颜色差异强化白粉病斑进行面积的识别与病情等级的划分, 随着病情等级的提高, 光谱反射率与强度逐渐升高。
(3)采用Ensemble-Subspace Discriminant算法对定性模型进行分析; 经过MSC预处理后构建PLSR定量预测模型。 得到近红外光谱+光合速率的定性分类模型与定量预测模型相较于荧光光谱具有更高的准确率和鲁棒性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|