作者简介: 侯倩宜, 1994年生, 山西中医药大学中药与食品工程学院硕士研究生 e-mail: 1216480606@qq.com
小窝蛋白-1(CAV-1)在动脉粥样硬化等心血管疾病的发生发展中发挥关键作用。 为了解槲皮素与CAV-1的相互作用, 在模拟生理环境和不同温度条件下, 采用多光谱法、 同源模建、 分子对接模拟和生物膜(BLI)技术进行研究。 荧光猝灭数据结果显示, 猝灭速率常数 Kq值远大于2.0×1010 L·mol-1·s-1, 且猝灭常数 KSV随温度升高而降低, 证明槲皮素和CAV-1相互作用的猝灭过程为静态猝灭; 而热力学参数, 焓变Δ H<0、 熵变Δ S<0且Δ G<0, 表明二者的结合过程是自发、 焓驱动的, 其相互作用的主要类型为范德华力和氢键作用。 通过对槲皮素与CAV-1相互作用的同步荧光光谱和三维荧光光谱分析, 随着槲皮素的加入, CAV-1的荧光强度逐渐降低, 证明二者之间发生了相互作用。 进一步分析发现, 同步荧光光谱中槲皮素使CAV-1中的芳香族氨基酸残基的最大发射波长发生了轻微红移, 周围的微环境极性增强, 亲水性增加, 表明槲皮素的加入使CAV-1的蛋白质构象发生了改变。 紫外-可见光谱结果显示, CAV-1与槲皮素之间形成了一个基态复合物, 进一步证实了CAV-1与槲皮素之间的静态猝灭机制。 采用同源模建技术建立CAV-1的X射线晶体结构模板。 分子对接模拟结果显示两者结合力为-7.372 kcal·mol-1。 对接结果表明槲皮素结合点位于由GLU20, ASP70, VAL16和ARG19等氨基酸形成的活性口袋中, 与GLN21, VAL16和ARG19位点产生范德华力作用, 与GLU20, ASP70位点存在氢键作用力。 各种作用力影响了CAV-1的微环境变化, 导致其荧光猝灭, 是参与复合物形成的关键因素。 最后, 利用BLI技术对槲皮素和CAV-1的结合进行定量研究, 研究结果显示, 二者具有良好的的结合活性, 结合解离平衡常数 KD值为2.50×10-5 mol·L-1; 其响应信号值随槲皮素浓度的升高而增强, 表明CAV-1与槲皮素之间存在特异性结合。 该研究有助于了解槲皮素与CAV-1的相互作用机制, 为槲皮素治疗动脉粥样硬化的作用靶点研究提供参考。
Caveolin-1 (CAV-1) plays a key role in developing cardiovascular diseases such as atherosclerosis. The interaction between quercetin and CAV-1 was studied by multispectral, homology modeling, molecular docking simulation and bio-layer interferometry (BLI) in the simulated physiological environment and different temperatures. The fluorescence quenching data showed that the Kq value (the quenching rate constant) were all much larger than 2.0×1010 L·mol-1·s-1, and the fluorescence quenching constant ( KSV) decreased with the increase of temperature, which proves that the quenching process of the interaction between quercetin and CAV-1 is static quenching. Furthermore, the thermodynamic parameters, enthalpy change Δ H<0, entropy change Δ S<0 and Δ G<0 indicated that the bonding process is spontaneous and enthalpy driven, indicating that the main types of interaction are van der Waals force and hydrogen bonding. Through the synchronous fluorescence and three-dimensional fluorescence spectrums analysis of the interaction between quercetin and CAV-1, it was found that the fluorescence intensity of CAV-1 was progressively decreased upon the addition of quercetin, indicating that quercetin interacted with CAV-1. Further analysis showed that quercetin caused the redshift of the maximum emission wavelength of the aromatic amino acid residues in CAV-1, enhanced the polarity of the microenvironment around the CAV-1, enhanced its hydrophilicity, indicating that the addition of quercetin changed the protein conformation of CAV-1. The UV-Vis absorption spectrum showed that a ground-state complex was formed between CAV-1 and quercetin, which further confirmed the static quenching mechanism between CAV-1 and quercetin. The X-ray crystal structure template of CAV-1 was constructed using homology modeling. The molecular docking simulation results showed that the binding force of quercetin and CAV-1 was -7.372 kcal·mol-1. The docking results showed that quercetin could bind to the active pocket composed of amino acids such as Glu20, ASP70, VAL16 and ARG19. There were the van der Waals forces between quercetin and residues GLN21, VAL16 and ARG19 of CAV-1, and hydrogen bonds between quercetin and GLU20 and ASP70. Various forces affected the micro-environmental changes of CAV-1 and led to its fluorescence quenching, which is a key factor involved in the formation of the complex. Finally, the binding of quercetin and CAV-1 was quantitatively studied by the BLI technique. The results showed that quercetin had a good binding activity with CAV-1 with an equilibrium constant ( KD) value of 2.50×10-5 mol·L-1. The response signal value increased with quercetin concentration, evidencing the specific binding between CAV-1 and quercetin. This research was helpful in understanding the mechanism of interaction between quercetin and CAV-1 and provide references for research on the therapeutic targets of quercetin in atherosclerosis.
槲皮素(Quercetin), 是一种天然存在的多羟基黄酮类化合物, 广泛存在于水果、 蔬菜、 茶和多种中草药中[1]。 槲皮素具有抗炎、 抗氧化应激、 抗糖尿病、 抗高血压和抗癌等多种药理作用, 特别是在治疗和预防心血管疾病方面, 可发挥降血脂、 抑制低密度脂蛋白氧化等保护作用[2, 3]。 然而, 目前有关槲皮素抗动脉粥样硬化等心血管疾病的作用靶点还不明确。
由CAV基因家族编码的小窝蛋白是细胞膜上负责集中一系列对细胞功能至关重要的信号分子的位点, 其中小窝蛋白-1(Caveolin-1, CAV-1)是小窝表面最具标志性的蛋白, 分子量为22~24 kDa, 是细胞膜上信号转导系统中的一种支架蛋白, 在多种信号途径中起调节血管内皮等多种功能[4]。 内皮细胞功能障碍是动脉粥样硬化病理学的关键潜在原因, CAV-1作为血管内皮细胞细胞膜上的一种主要的小窝结构蛋白, 参与脂蛋白胞吞、 血管炎症的调节和动脉粥样硬化的进展[5, 6]。 CAV-1被证实是参与调节内皮导致动脉粥样硬化发展的关键靶点[7]。
槲皮素可以调节小窝的功能特性, 改变小窝相关信号蛋白的激活, 并显示出对血管内皮细胞的保护作用, 抑制动脉粥样硬化的早期发展[8]。 研究表明, 槲皮素调节动脉粥样硬化相关的氧化应激和炎症通路与功能性小窝蛋白相关, 可通过调节 CAV-1及其磷酸化表达来维持氧化应激下内皮细胞功能的水平[9, 10]。 本工作采用多光谱、 分子对接模拟和生物膜层干涉技术研究槲皮素与CAV-1的相互作用机制, 从分子结构层面分析槲皮素对CAV-1空间结构和氨基酸残基微环境的影响, 旨在为阐明槲皮素与CAV-1的作用机制及槲皮素治疗动脉粥样硬化等心血管疾病的作用靶点提供重要信息。
槲皮素(四川省维克奇生物科技有限公司, 117-39-5); CAV-1蛋白(Cloud-Clone Corp, P20200605550); 磷酸缓冲盐溶液(Servicebio); 二甲基亚砜(索莱宝, D8371); 吐温-20(索莱宝, T8220); 超级链霉亲和素(FORTEBIO , 2010212); ZebaTM脱盐离心柱(Thermo, VB296675A); EZ-LinkTM NHS-PEG4-生物素(Thermo, VE300242)。
荧光分光光度计(F-4700, 日立, 日本); 低温恒温槽(LS-2500, 南京宁凯仪器有限公司); 化学发光荧光酶标仪(SpectraMax i3x, 美谷分子); 生物膜干涉分子相互作用仪(Octet K2, FORTEBIO)。
实验所用试剂为分析纯, 所用水为一级水。
荧光猝灭检测已被广泛应用于研究有机化合物与蛋白质的相互作用[11]。 本研究使用荧光分光光度计并采用温度相关的测量方法检测荧光发射光谱来分析槲皮素与CAV-1蛋白的相互作用。 蛋白CAV-1(1.0× 10-6 mol· L-1)溶液10 μ L溶于2毫升PBS缓冲液中。 将不同浓度的槲皮素(0, 0.5× 10-6, 1.0× 10-6, 1.5× 10-6, 2.0× 10-6, 2.5× 10-6和3.0× 10-6mol· L-1)分别与一定浓度的CAV-1蛋白反应。 样品检测在荧光分光光度计专用比色皿中进行, 在激发波长280 nm, 发射波长300~450 nm范围内, 激发狭缝和发射狭缝宽度均设置为5 nm, 以700 V的电压(PMT)及240的扫描速度, 设定温度为298和310 K, 使用循环水浴控制温度, 分别扫描获得荧光光谱。
在298 K温度下使用相同的溶液进行同步荧光测定, 将Δ λ (波长间隔)参数设置为60 nm, 以筛选微环境中色氨酸残基周围的扰动。 一般来说, 极性大小或亲水/疏水性的变化与最大峰的红移或蓝移有关, 其可影响氨基酸周围微环境[12]。 于荧光比色皿中加入1 990 μ L PBS和10 μ L蛋白溶液混匀, 使蛋白终浓度为5× 10-9 mol· L-1, 蛋白浓度保持不变, 逐渐加入5 μ L的槲皮素溶液, 以其混合液(0, 2.5× 10-7, 5× 10-7, 7.5× 10-7, 10× 10-7, 12.5× 10-7和15× 10-7 mol· L-1)为样品溶液, 扣除空白, 在Δ λ =60 nm测定。
三维荧光光谱是分析蛋白质在溶液状态下构象变化的有效分析技术[13]。 设定电压(PMT)为700 V, 增益为2, 扫描速度240 nm· min-1, 等高线设置为15, 激发波长参数为200~350 nm, 发射波长参数为220~500 nm, 两者扫描间隔均为5 nm。 以蛋白溶液(5.0× 10-9 mol· L-1)为样品进行扫描, 再加入相应化合物(1.0× 10-6 mol· L-1)体系作为样品溶液, 扫描获得相应的三维荧光光谱。 记录等高线图中特征峰的峰位和峰强度变化。
室温条件下在230~500 nm波长范围内测定CAV-1溶液(1.0× 10-5 mol· L-1)和槲皮素溶液(1.0× 10-5 mol· L-1)的吸收光谱, 以及CAV-1与槲皮素摩尔比为1∶ 1时的吸收光谱。 在UV-Vis吸收测量中, 通过单独减去PBS的UV-Vis吸收光谱进行背景校正, 对这些化合物的UV-Vis吸收光谱进行了校正。
CAV-1的晶体结构至今尚未解决。 蛋白质数据库(https://www.rcsb.org)中没有CAV-1的晶体结构。 为此, 采用同源模建的方法为CAV-1寻找合适的X射线晶体结构模板[14]。
登陆NCBI网站, 输入CAV-1的序列检索号AAD23745.1进行检索, 找到CAV-1的蛋白序列, 其蛋白序列如下:
msggkyvdseghlytvpireqgniykpnnkamadelsekqvydahtkeidlvnrdpkhlnddvvkidfedviaepegthsfdgiwkasfttftvtkywfyrllsalfgipmaliwgiyfailsflhiwavvpciksflieiqcisrvysiyvhtvcdplfeavgkifsnvrinlqkei
I-TASSER(https://zhanglab.ccmb.med.umich.edu/I-TASSER/)是一种用于自动化蛋白质结构预测和基于结构的功能注释的在线分析工具[15]。 提交CAV-1蛋白的氨基酸序列, 模拟生成多个预测模型, 根据I-TASSER提供的置信度分数(C-score)及TM-score挑选合格的模型, 获得模型PDB文件。 根据所提供的配体结合位点, 与槲皮素进行分子对接模拟。
登录DockThor, 上传蛋白文件进行除水、 加氢等自动处理, 上传配体文件并进行加氢, 活性位点定义为“ Blind dDocking” , 整个蛋白被定义为受体, 最后采用蛋白的同源模型结构进行了分子对接分析。 affinity(亲和力/结合能)小于0说明槲皮素与CAV-1可以自发结合, 结合能越小说明两者之间的亲和力越大。 采用PyMOL软件作图进行可视化研究。
应用生物膜干涉技术检测CAV-1与槲皮素体外相互作用, 其采用光干涉信号, 非标记且实时监测, 最大程度保证实验真实性[16]。 在FORTEBIO Octet K2系统中操作进行生物膜层干涉(bio-layer interaction, BLI)实验, 96孔黑板中每孔加入的试剂体积为200 μ L, 反应温度设置为30 ℃。 首先选择Super Streptavidin(SSA)标记的探针四个, 设置没有固化蛋白的对照传感器, 减去以改善所研究的特异性结合/解离。 提前放入PBST缓冲液中浸湿10 min, 同时将浓度为400 μ g· mL-1的蛋白与母液浓度为10 mmol· L-1的生物素化试剂混合进行生物素化, 将混合液加入脱盐柱, 收集流穿并稀释, 获得浓度为200 μ g· mL-1的生物素化的蛋白。 准备结束后, 基线设置120 s进行平衡, 固定蛋白600 s, 并重新平衡120 s建立新的、 稳定的基线信号。 将探针转移至终浓度依次为100, 50, 25, 12.5和6.25 μ mol· L-1的槲皮素溶液中进行结合测定, 时间60 s。 将结合后的探针再次转移到缓冲液中进行解离, 时间60 s。 基于BLI原理, 以分子间相互作用大小为判断依据, 亲和力常数(KD值)数值越小亲和力越强, 而分子浓度不影响其数值变化。 从非线性回归后的整体分析进行拟合, 基线校正处理后, 确定一对结合和解离的速率常数, 从而确定一个平衡解离常数, 及响应值, 卡方(χ 2), R2判断拟合的好坏及可信度。
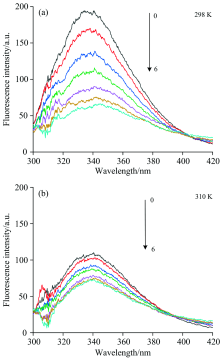
在298和310 K条件下, 蛋白(5.0× 10-9 mol· L-1)和不同浓度化合物混合液的光谱分别如图1(a, b)所示。 蛋白质浓度的变化相对较小, 被忽略。 从样品测量中减去与PBS溶液相对应的适当空白, 以校正任何背景荧光。 随着槲皮素的加入, λ max(发射)几乎没有变化, CAV-1的荧光强度逐渐降低, 表明它们导致蛋白质的荧光被猝灭, 符合静态猝灭机制。 这种形式的内在荧光猝灭可能归因于CAV-1和槲皮素分子的相互作用。 为进一步的理论计算提供了依据。
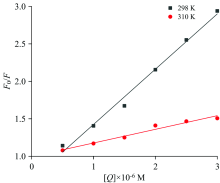
为了分析化合物与蛋白的猝灭机制, 使用Stern-Volmer方程分析化合物和蛋白质的荧光猝灭数据[17]
式(1)中, F0和F是蛋白的荧光强度和蛋白加入不同浓度的化合物后的荧光强度; KSV是猝灭常数; Kq为猝灭速率常数; [Q]是化合物的浓度; τ 0是没有淬灭剂的生物分子的平均荧光寿命(τ 0=10-8 s)[18]。 以F0/F对[Q]作图, 获得298和310 K的一系列标准曲线(图2)。
由图2的Stern-Volmer曲线, 根据直线的斜率可以得到相应温度下KSV和Kq的值。 结果如表1所示。
| 表1 298和310 K下不同化合物与蛋白的KSV和Kq值 Table 1 KSV and Kq values of different compounds and proteins at 298 and 310 K |
在298和310 K下, 蛋白的Stern-Volmer曲线均呈现良好的线性关系, 其相关系数分别为0.99和0.97。 Kq值远大于2.0× 1010 L· mol-1· s-1 [19], 并且随着温度的升高KSV呈下降趋势, 化合物对蛋白的猝灭机制可能是因二者形成了新的络合物而引起了静态猝灭。
根据结合常数和温度之间的关系来区分动态和静态猝灭。 在络合物形成(即静态结合)的情况下, 温度的升高可导致结合常数的减小, 而在动态结合的情况下, 温度的升高导致结合常数的增大[20]。 对于静态猝灭, 结合常数和结合位点由式(2)[19]计算。
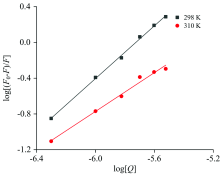
式(2)中, F0和F是蛋白的荧光强度和加入不同浓度化合物后的荧光强度; Kb是此反应中的结合常数, n为此反应中的结合位点数。 以log[(F0-F)/F]为纵坐标log[Q]为横坐标作图, 得到一系列在298和310 K下的标准曲线(图3)。
 | 图3 化合物与蛋白的结合常数与结合位点数图Fig.3 Diagram of binding constants and binding sites between compounds and proteins |
由log[(F0-F)/F]对log[Q]图, 得到相应温度下的Kb和n值。 见表2。
| 表2 298和310 K下不同化合物与蛋白的Kb和n值 Table 2 Kb and n values of different compounds and proteins at 298 and 310 K |
由于槲皮素对CAV-1的静态猝灭作用, 随着温度升高, 结合常数变小。 化合物与蛋白质的结合位点受温度影响不大, 说明化合物与蛋白质之间有很强的结合力, 从n值可以看出, 化合物与蛋白质结合时至少有一个结合位点。
进一步计算与结合相互作用相关的热力学参数以确定促进配体-蛋白质形成的主要作用力。 一般来说, 药物与生物分子结合所涉及的各种结合力包括静电力、 氢键、 疏水相互作用(包括Pi-Pi、 Pi-烷基、 Pi-酰胺)和范德华相互作用[21]。 通过使用Van’ t Hoff方程获得熵变(Δ S)、 焓变(Δ H)和自由能变(Δ G)的值[22], 分别见式(3)— 式(5)。 小分子与蛋白质之间的主要作用力可以根据Δ H和Δ S的相对大小获得。 结果见表3。
式(3)— 式(5)中, T为绝对温度(298和310 K), K为温度T下的结合常数, R为气体常数(8.314 J· mol-1· K-1)。
| 表3 298和310 K下不同化合物与蛋白的热力学参数 Table 3 Thermodynamic parameters of different compounds and proteins at 298 and 310 K |
据相关研究, 当Δ H> 0和Δ S> 0, 相互作用力主要为疏水作用力; 当Δ H< 0和Δ S< 0, 相互作用力主要为氢键、 范德华力或质子化作用力; 当Δ H≈ 0和Δ S> 0, 相互作用力主要为静电作用力。 槲皮素与CAV-1反应的Δ G, Δ H和Δ S均为负值, 表明结合过程是自发和焓驱动的, 其主要作用力是氢键和范德华力。
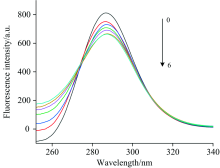
按1.2方法测定, 当Δ λ =60 nm时, 以扫描波长和荧光强度分别为横纵坐标, 得到一系列蛋白质加入不同浓度化合物后的荧光曲线(图4)。 从图4可以看出, 随着槲皮素的加入, 化合物的浓度增高, 蛋白质的荧光强度降低, 并且最大发射波长发生了轻微红移。 可见, 槲皮素的加入使CAV-1构象发生改变, 同时Trp 所在的微环境发生变化, 极性增加, 疏水性降低。 进一步证明槲皮素与CAV-1结合为静态猝灭。
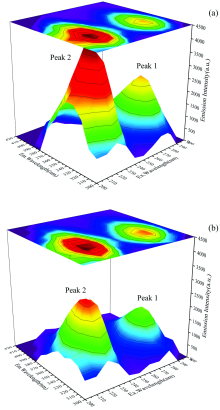
等高线图中指纹线(λ ex=230 nm, λ em=320 nm)处为蛋白质肽链骨架的振动特征峰, 等高线图中指纹线(λ ex=280 nm, λ em=350 nm)是酪氨酸和色氨酸残基的特征峰。 加入槲皮素前后CAV-1的三维荧光光谱如图5(a, b)所示。 光谱图坐标轴分别表示激发波长(Ex)、 发射波长(Em)和荧光强度。 从三维荧光光谱图结果中可以看出, 加入槲皮素后CAV-1的荧光强度显著降低, 说明CAV-1与槲皮素发生相互作用。 与荧光猝灭和同步荧光结果一致。
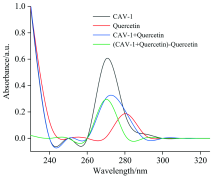
采用紫外-可见光谱研究了关于结合机理、 构象变化和蛋白质-底物复合物的形成。 动态猝灭不影响显色团的吸收光谱, 静态猝灭则相反。 芳香族氨基酸残基(Trp和Tyr)在280 nm处有明显的特征峰, 反映了氨基酸的吸收状态[23]。 图6为槲皮素、 CAV-1及其与槲皮素配合物的紫外-可见光谱, 以进一步证明CAV-1-槲皮素复合物的形成。 结果发现CAV-1紫外-可见吸收光谱的吸收峰在加入槲皮素之后强度明显下降, 表明芳香族残基与黄酮类化合物之间存在有效的相互作用[24], 并且将两者结合后的可见光谱扣除槲皮素对应光谱, 可以看出CAV-1的光谱和原生CAV-1的光谱没有重叠, 表明CAV-1与槲皮素之间形成了基态复合物, 进一步证实了CAV-1与槲皮素之间的静态猝灭机制。
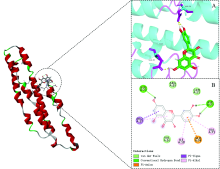
通过I-TASSER分析发现, 该蛋白是α -β 蛋白, 其中包含四个α -螺旋(红色)和两个β -链(蓝色)。 在结构组装模拟之后, I-TASSER使用TM-align结构比对程序将第一个I-TASSER模型与PDB库中的所有结构进行匹配, 获得具有最相似结构的蛋白质(TM-score=0.761), 由于结构相似, 这些蛋白质通常具有与靶标相似的功能。 基于I-TASSER结构预测的COFACTOR和COACH对目标蛋白的生物学注释, 选择具有高置信度得分(C-score=0.13)的配体(PDB Hit: 1 oczB)为对接提供配体结合位点。
分子对接技术是一种模拟配体在受体结合位点结合过程的计算方法。 获得的功能模板与槲皮素进行分子对接。 将DockThor对接结果进行“ Analyze” , 槲皮素与蛋白结合力及亲和力为-7.372 kcal· mol-1, 表明槲皮素成分对蛋白具有较好的亲和力。 选择对接结果“ Protein” 中处理好的蛋白与“ Result” 中的最佳的化合物状态“ Bastranking” , 运用Pymol进行可视化处理, 如图7所示。 分子对接结果发现槲皮素结合点位于由GLU20, ASP70, VAL16和ARG19等氨基酸位点形成的作用口袋中, 与GLN21, VAL16和ARG19产生范德华力作用, 与GLU20和ASP70形成分子内氢键, 从而影响微环境变化, 导致了其荧光性质猝灭。 此结果与热力学结果一致。
由于BLI技术灵敏度高, 可以快速实时跟踪小分子化合物与蛋白质的动态结合过程, 可以定量研究被测对象之间的亲和力特征, 本部分实验采用该技术研究槲皮素与CAV-1结合的特异性, 并量化两者之间的亲和力。 如图8所示, 纵轴和横轴分别代表不同浓度槲皮素的光移动距离(nm)和吸附/解吸时间(s)。 槲皮素和CAV-1的结合响应信号值随着槲皮素浓度的增加而增强, 表明槲皮素和CAV-1为特异性结合。 经机器自带软件ForteBio Data Analysis分析计算, 得到其分子动力学分析结果(表4)。 曲线R2=0.914 8, X2=0.075 8拟合较好, KD值为2.50× 10-5 mol· L-1, 显示出槲皮素与CAV-1蛋白较强的结合力。
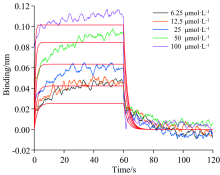 | 图8 BLI法检测槲皮素与CAV-1的结合解离曲线及拟合曲线Fig.8 BLI method detection of the combined dissociation curve and fit curve of quercetin and CAV-1 |
| 表4 BLI法检测槲皮素与CAV-1的分子动力学分析结果 Table 4 BLI method detection of molecular dynamics analysis results of quercetin and CAV-1 |
采用多种光谱技术、 分子对接模拟和BLI技术研究了槲皮素与CAV-1的相互作用机制。 根据获得的荧光数据, 发现槲皮素与CAV-1结合过程的机制是典型的静态猝灭, 并以适度的结合亲和力与CAV-1结合。 从热力学参数(Δ H和Δ S)确定, CAV-1与槲皮素作用过程由焓驱动并自发进行, 结合位点的主要相互作用类型是氢键和范德华力。 同步荧光和三维荧光光谱研究发现, 在槲皮素的作用下, CAV-1中芳香族氨基酸残基所处的微环境发生变化, 荧光光谱红移增加了Trp残基碱基的极性环境, 疏水性降低, 空间结构变得松散。 紫外-可见吸收光谱表明CAV-1和槲皮素之间形成了复合物。 分子对接确定了最佳结合模型, 发现槲皮素主要依靠氢键与范德华力结合于由GLU20, ASP70, VAL16和ARG19 等氨基酸形成的口袋中, 这支持了在热力学研究中获得的Δ H和Δ S为负值的结果。 BLI检测显示槲皮素与CAV-1的结合响应信号值随槲皮素的加入而与其浓度成依赖性增强, 表明CAV-1与槲皮素之间存在特异性相互结合, 且具有较强的结合力。 这为进一步探索槲皮素的抗动脉粥样硬化作用靶点奠定了基础。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|