作者简介: 刘宏伟, 1969年生, 湖南工学院材料科学与工程学院教授 e-mail: hwl0466@163.com
棕榈油作为全球产量、 消费量和贸易量最大的植物油品种, 不仅富含类胡萝卜素、 维生素E、 辅酶和固醇, 而且具有常温可塑性好、 易分馏且价格低廉等特性, 是人体主要脂肪来源之一。 然而, 受自然因素和人类活动的影响, 释放到环境中的重金属被棕榈树果实积累以及在棕榈油压榨精炼中受到重金属污染, 导致重金属元素的含量一旦超标, 就会对人类健康构成潜在危害。 为全面明确棕榈油中多种重金属元素的含量, 确保棕榈油的质量安全控制, 基于破乳诱导萃取棕榈油中重金属元素提出了利用微波等离子体原子发射光谱(MP-AES)进行测定的新策略。 采用5%( W/V)Triton X-114和50%( V/V)盐酸组成的表面活性酸性溶液与棕榈油样品充分混合, 于90 ℃温度对形成的油包水乳状液超声水浴40 min, 收集水相在多模式进样系统(MSIS)双重模式下采用MP-AES测定其中所含重金属元素As、 Hg、 Cd、 Pb、 Ni、 Cr。 详细评估了乳化剂、 萃取剂、 萃取温度和萃取时间等破乳诱导萃取参数对分析元素萃取效率的影响, 优化选择了分析元素的谱线波长, 利用油标对棕榈油样品进行加标回收验证了方法的准确性和精密度, 以微波消解技术处理棕榈油样品并采用电感耦合等离子体串联质谱(ICP-MS/MS)进行对比分析验证了方法的可靠性。 结果表明, 所有分析元素呈现良好的线性关系(线性相关系数≥0.999 8), 检出限(LOD)在0.025~0.29 μg·L-1之间, 加标回收率在96.5%~105%之间, 相对标准偏差(RSD)≤4.1%, 在95%的置信度水平, 方法分析结果与ICP-MS/MS无显著性差异。 破乳诱导萃取将分析元素从油相分离富集至水相中, 避免了大量基质的干扰; 在双重模式下运行MSIS, 实现了氢化物元素和非氢化物元素的同时测定; MP-AES从空气中提取氮气作为气源, 无需使用昂贵的氩气或易燃性气体, 降低了分析运行成本, 安全环保。 所建立的方法操作简单快速、 分析稳定性好、 结果准确可靠, 可满足大批量棕榈油样品中多种重金属元素的高通量检测要求, 已应用于棕榈油样品的质量控制和安全评价。
As one of the vegetable oil species with the largest production, consumption and trade in the world, palm oil is not only rich in carotenoids, vitamin E, coenzymes and sterols but also has the characteristics of good plasticity at room temperature, easy fractionation and low price, and is one of the major fat sources of the human body. However, due to the influence of natural factors and human activities, the heavy metals released into the environment are accumulated in palm tree fruits and are polluted by heavy metals in palm oil pressing and refining, resulting in the potential harm to human health once the contents of heavy metal elements exceed the standards. In order to fully clarify the content of various heavy metal elements in palm oil, and ensure the quality and safety control of palm oil, a new strategy for determination of heavy metals elements in palm oil using microwave plasma atomic emission spectroscopy (MP-AES) based on extraction induced by emulsion breaking (EIEB) was proposed. A surface-active acidic solution composed of 5% ( W/V) Triton X-114 and 50% ( V/V) hydrochloric acid was thoroughly mixed with the palm oil sample, and the formed water-in-oil emulsion was subjected to ultrasonic bath at 90 ℃ for 40 min, the formed aqueous phase was collected. The heavy metal elements As, Hg, Cd, Pb, Ni, and Cr were determined by MP-AES in the dual mode of the multimode sample introduction system (MSIS). The effects of EIEB parameters such as emulsifier, extraction agent, extraction temperature and extraction time on the extraction efficiency of analytes were evaluated in detail, and the spectral wavelengths of analytes were optimized. The accuracy and precision of the method were verified by spiked recovery of palm oil samples with oil standards. The palm oil samples were processed by microwave digestion technology and compared with inductively coupled plasma tandem mass spectrometry (ICP-MS/MS) to verify the method's reliability. The results showed that the analytes showed a good linear relationship (linear correlation coefficient was greater than or equal to 0.999 8), the limit of detection (LOD) was between 0.025 and 0.29 μg·L-1, and the spiked recovery was between 96.5% and 105%, the relative standard deviation (RSD) was less than or equal to 4.1%. At the 95% confidence level, there is no significant difference between the analytical results of the method and those of ICP-MS/MS. EIEB separates and enriches the analytes from the oil phase to thewater phase, avoiding the interference of many matrices. Running MSIS in dual mode enables simultaneous determination of hydride and non-hydride elements. MP-AES extracts nitrogen from the air as the gas source without using expensive argon or flammable gas, which reduces the cost of analysis and operation. Furthermore, it is safe and environmentally friendly. The developed method has the advantages of simple and rapid operation, good analytical stability, accurate and reliable results, and can meet the high throughput detection requirements of multiple heavy metal elements in large batches of palm oil samples, and has been applied to the quality control and safety evaluation of palm oil samples.
棕榈油是从热带木本植物棕榈树果实果肉中压榨提取的植物油, 是全球产量、 消费量和贸易量最大的植物油品种[1]。 作为“ 世界三大植物油” 之首, 棕榈油中饱和脂肪酸含量仅次于椰子油, 富含类胡萝卜素、 维生素E、 辅酶和固醇, 具有常温可塑性好、 易分馏且价格低廉等特性, 由于易被人体消化吸收, 约占世界产量90%的棕榈油用于食品行业[2]。 评价棕榈油的总体质量通常根据其有机成分来决定, 其所含无机元素虽然是次要成分, 但会影响棕榈油的品质和食用安全性, 尤其是所含重金属元素通过食物链在人体内的累积特性以及生物放大效应, 具有毒性和致癌作用[3]。 我国是棕榈油进口大国, 发展可靠和准确的分析方法来评价棕榈油中重金属的安全性具有十分重要的意义。
食用植物油中元素分析的前处理方法有基质消化法、 乳化法和溶剂稀释法[4, 5, 6]。 基质消化法包括干法灰化和湿法消解法, 是油基介质最常用前处理方法, 但基质消化法需消耗大量化学试剂, 耗时且消化条件苛刻, 样品高倍稀释对分析方法的检测限提出了更高的要求; 乳化法通过加入表面活性剂形成乳状液或微乳液, 增大了相间接触面积, 但乳化法需消耗大量表面活性剂, 乳化体系长时间的稳定性差, 仍需解决少量有机基质存在引起的干扰; 溶剂稀释法通过加入适当有机溶剂稀释样品直接分析, 缩短了样品前处理时间, 降低了样品污染和挥发性分析元素损失的风险, 但大量有机基质引入所形成的干扰复杂, 分析信号稳定性差, 样品溶液和标准溶液的一致性很难得到保证。 破乳诱导萃取法将表面活性剂与油基介质充分混合形成油包水乳状液, 经加热或离心破乳后利用酸性溶液将油相中分析元素转移至水相, 从而实现分析元素与有机基质的分离[7]。 破乳诱导萃取集分离与富集于一体, 为油基介质中的元素分析提供了简单快速的前处理技术。
基于原子光谱的分析技术, 包括原子荧光光谱(AFS)、 原子吸收光谱(AAS)、 电感耦合等离子发射光谱(ICP-OES)和电感耦合等离子体质谱(ICP-MS)法已广泛应用于食用植物油的元素分析[2, 8, 9, 10]。 其中, AFS、 ICP-OES和ICP-MS需持续使用高纯氩气, 分析成本高; AAS采用可燃和氧化性气体为气源, 安全风险大。 微波等离子体原子发射光谱(MP-AES)采用微波磁致激发等离子体技术, 使用氮气为微波等离子体(MP)气源, 运行成本低且安全性高, 已得到广泛应用, 但用于棕榈油中重金属元素的测定面临着挑战: MP-AES的基质耐受力差, 有机基质的影响更为明显; 棕榈油中重金属元素的含量低, 而MP-AES偏高的检测限难以满足分析要求; 难电离元素在MP中的电离度差, 尤其是高基质样品中信号抑制更严重, 导致这些元素的分析灵敏度低。 本文采用破乳诱导萃取对棕榈油样品进行前处理, 利用MP-AES测定棕榈油中的重金属元素As、 Hg、 Cd、 Pb、 Ni、 Cr, 旨在对棕榈油中重金属元素的准确测定提供低成本高通量分析方法。
4200型微波等离子体原子发射光谱仪, 美国Agilent公司; KQ-AS1000GDE型超声波清洗器, 昆山市超声仪器有限公司; 8800型电感耦合等离子体串联质谱, 美国Agilent公司; Milli-Q超纯水仪, 美国Millipore公司。
MP-AES工作参数: 喷雾室, 多模式进样系统(MSIS); 雾化气流速, As 0.45 L· min-1、 Hg 0.5 L· min-1、 Cd 0.45 L· min-1、 Pb 0.85 L· min-1、 Ni 0.3 L· min-1、 Cr 0.3 L· min-1; 泵速, 15 r· min-1; 读数时间, As、 Hg为5 s, 其余3 s; 重复次数, 3次; 吸入延迟时间, 10 s; 冲洗时间, 20 s; 稳定时间, 15 s。
MSIS工作条件: 样品溶液流速, 0.5 mL· min-1; 还原剂(1.5%硼氢化钠/0.5%氢氧化钠)流速, 0.5 mL· min-1; 预还原剂(2%L-半胱氨酸/4%酒石酸)流速, 2.0 mL· min-1。
1 000 mg· L-1的As、 Hg、 Cd、 Pb、 Ni、 Cr、 Y单元素标准溶液, 国家有色金属及电子材料分析测试中心; 1 000 mg· L-1的As、 Hg、 Cd、 Pb、 Ni、 Cr单元素油标溶液, 美国Conostan公司; 氢氧化钠(AR)、 硼氢化钠(AR)、 酒石酸(AR), 国药集团化学试剂有限公司; Triton X‐114(AR)、 L-半胱氨酸(生物纯), 美国Sigma-Aldrich公司; 65%(W/W)硝酸、 37%(W/W)盐酸, 德国Merck公司。
准确称取10 g棕榈油样品于离心管中, 依次加入5%(W/V)的Triton X-114 1.0 mL和50%(V/V)的盐酸1.5 mL, 充分搅拌形成乳状液, 保持90 ℃温度对乳状液超声水浴加热破乳40 min, 收集分层的水相2 mL, 用超纯水一倍稀释制得样品溶液。 采用相同步骤制得空白溶液。
采用18%(V/V)的盐酸介质配制浓度分别为0.0、 0.5、 2.0、 10、 50 μ g· L-1的分析元素系列混合标准溶液, 在MSIS的双重模式下采用MP-AES进行测定, 同时测定样品溶液和空白溶液。 测试溶液分两路进入MSIS雾化室, 一路直接进入MSIS雾化室中进行传统雾化, 另一路与预还原剂通过“ T” 型接头混合后进入MSIS雾化室, 与还原剂在MSIS雾化室中进行氢化物发生反应。 元素As、 Hg采用氢化物发生模式测定, 元素Cd、 Pb、 Ni、 Cr采用传统雾化模式测定。 在测定过程中, 所有测试溶液均在线加入1 mg· L-1的Y内标溶液。
为了在最短的前处理时间内使棕榈油样品中所有分析元素均保持最佳萃取效率, 本实验对乳化剂种类及浓度、 萃取剂种类及浓度、 萃取温度与萃取时间等破乳诱导萃取条件进行了选择和优化。
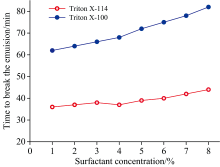
Triton X-100和Triton X-114均能形成油包水乳状液, 是破乳诱导萃取最常用乳化剂[11]。 通过考察了两种表面活性剂在不同浓度下分析元素相对信号强度(相对于分析元素最大信号强度的比值)的变化(见图1), 评估Triton X-100和Triton X-114对分析元素萃取效率的影响。 可以看出, 随着两种表面活性剂浓度的增大, As、 Hg、 Pb、 Ni的相对信号强度无明显变化, 而Cd、 Cr的相对信号强度增大, 所有分析元素的最大萃取效率均在5%~8%范围内, 表明两种表面活性剂对分析元素最大萃取效率的影响一致。 然而, 不同表面活性剂的种类和浓度影响破乳时间, 表面活性剂浓度越大, 能更有效地乳化水溶液, 但所需破乳时间更长(见图2)。 与Triton X-100相比, 相同浓度Triton X-114的破乳时间更短, 表明用Triton X-114制备的乳状液稳定性较差, 有利于后续破乳。 因此, 本实验选择5%(W/V)的表面活性剂Triton X-114为乳化剂。
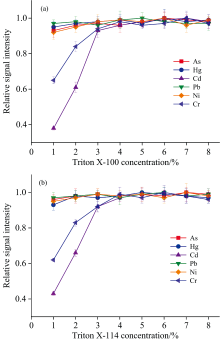 | 图1 Triton X-100(a)和Triton X-114(b)浓度对分析元素萃取效率的影响Fig.1 Effects of the concentrations of Triton X-100 (a) and Triton X-114 (b) on the extraction efficiency of analytes |
分析元素在乳状液中以自由离子、 有机分子、 有机配合物的形式存在, 无机酸作为萃取剂从乳状液中提取分析元素, 硝酸是破乳诱导萃取最常用萃取剂, 但硝酸的强氧化性不利于氢化物元素的测定, 而盐酸是氢化物发生反应常用预还原剂和载流介质, 其所含氯离子的配位作用更有利于从乳状液中提取分析元素。 考察了不同浓度盐酸对分析元素萃取效率的影响, 从图3可以看出, 非酸性条件也能将以自由离子或以微弱结合态存在的部分分析元素萃取出来, 随着盐酸的加入, 分析元素的相对信号强度快速增大, 显著提高了萃取效率, 当盐酸浓度在40%~60%范围时, 所有分析元素的相对信号强度最大, 表明盐酸已充分萃取油相中的分析元素。 因此, 本实验选择50%(V/V)盐酸为萃取剂。
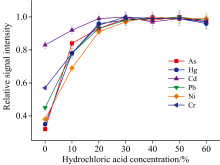 | 图3 盐酸浓度对分析元素萃取效率的影响Fig.3 Effects of the concentrations of hydrochloric acid on the extraction efficiency of analytes |
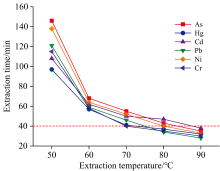
萃取温度影响表面活性剂的相分离, 提高萃取温度会加快破乳速度, 缩短萃取时间。 在确保分析元素被充分萃取的前提下, 考察了不同萃取温度对萃取时间的影响, 结果见图4。 可以看出, 提高萃取温度缩短了萃取时间, 当萃取温度在50~70 ℃范围内, 分析元素的萃取时间大幅度缩短, 随后升高萃取温度, 萃取时间的缩短幅度变小, 当萃取温度达到90 ℃时, 所有分析元素在40 min内完成萃取。 因此, 本实验选择萃取温度为90 ℃。
MP的等离子体温度比电感耦合等离子体(ICP)低1 000~3 000 K, 受低温影响MP诱导分析原子的激发态能级降低, 产生的发射光谱线数量比ICP少, 可用于分析的谱线波长选择数量也变少。 遵循分析谱线波长的选择原则, 预设分析元素的高灵敏谱线, 根据MP Expert元素谱线库所突出显示的潜在干扰, 对比分析预设谱线的灵敏度和谱线重叠干扰, 选择干扰可忽略或干扰小的高灵敏谱线为分析线, 结果见表1。 除元素Ni、 Cr受到稀土元素的轻微干扰可以忽略外, 其余分析元素均存在谱线重叠干扰, As受到了来自Fe光谱的干扰, Hg受到了来自Co、 Fe、 Mo、 W的干扰, Cd受到了来自Fe、 V、 Ti、 Mn、 Co的干扰, 虽然这些干扰元素在棕榈油中的含量很低, 但重金属元素的更低, 因此, 这些干扰不容忽视。 快速线性干扰校正(FLIC)基于空白溶液、 分析元素和干扰元素标准溶液的数据建模, 通过解卷积将谱线重叠干扰从分析谱线中自动扣除[12], 在建模过程中采集了空白数据, FLIC能同时校正背景。 因此, 本实验分别选择193.695、 253.652、 228.802、 405.781、 341.476和425.433 nm为As、 Hg、 Cd、 Pb、 Ni、 Cr的分析谱线波长, 并选择FLIC技术进行背景/干扰校正。
| 表1 分析元素谱线波长的选择及背景/干扰校正方法 Table 1 Selection of spectral line wavelengths and background/interference correction methods for analytes |
分析元素的原子化和激发会受到基质的影响, 样品溶液与标准溶液的基质粘度差异会影响分析元素的发射强度, MP-AES受较低等离子体温度的影响决定了其较低的基质耐受性[13]。 破乳诱导萃取将分析元素从油相中转移至水相中, 完全消除了有机基质的影响, 很好地解决了MP-AES基质耐受性低的难题。 本实验通过破乳诱导萃取得到的样品溶液、 空白溶液均为水溶液, 与标准溶液的基质差异小, 降低了基体效应。 通过在线加入1 mg· L-1的Y标准溶液作为内标溶液, 选择Y 371.029 nm为内标分析谱线波长, 以分析元素信号强度与内标元素的信号强度的比值补偿基质差异引起的谱线强度变化, 校正了基体效应。
采用系列混合标准溶液建立校准曲线, 并进行线性回归, 对方法的线性进行评价。 重复测定空白溶液11次, 以测定结果的3倍和10倍标准偏差对应浓度为仪器的检出限(LOD)和定量限(LOQ)。 从表2可以看出, 所有元素的线性相关系数≥ 0.999 8, 表现出良好线性关系, 各元素LOD为0.025~0.29 μ g· L-1, LOQ为0.084~0.98 μ g· L-1。 方法的线性动态范围和LOD明显优于类似研究的AAS法和ICP-OES法, 部分元素LOD接近以往文献报道的ICP-MS法[8]。
| 表2 方法的线性、 检出限(LOD)和定量限(LOQ) Table 2 The linearity and the method detection limit (MDL) of the analyte |
为评价本方法的准确可靠性, 将同一棕榈油样品分为三份, 采用本方法和ICP-MS/MS法对其中两份样品平行测定6次并进行统计学分析, 第三份棕榈油样品加入油标, 经破乳诱导萃取后采用本方法进行加标回收实验, 结果见表3。 本方法的加标回收率为96.5%~105%, 相对标准偏差(RSD)≤ 4.1%, 在95%的置信度水平, 本方法的测定值与ICP-MS/MS的测定值无显著性差异(p> 0.05), 验证了本方法的准确可靠性好, 精密度高。
| 表3 分析方法的准确可靠性(n=6) Table 3 Accuracy and reliability of analytical methods (n=6) |
采用本方法测定了对来自马来西亚和印度尼西亚的4种毛棕榈油(样品编号1—4)和4种精炼棕榈油(样品编号5—8)样品, 每种棕榈油样品平行测定6次, 结果见表4。 毛棕榈油中6种重金属元素的含量明显高于精炼棕榈油, 即使是同类棕榈油样品, 重金属元素的含量也存在较大差异, 3种精炼棕榈油中没有检出部分重金属元素。 8种棕榈油样品中重金属元素As、 Pb、 Ni的含量均远低于GB 2762—2017制定的最高限量标准, 棕榈油样品中重金属元素Hg、 Cd、 Cr的含量目前尚无国家标准, 但均处于极低水平。
| 表4 棕榈油样品分析结果(μ g· kg-1, n=6) Table 4 Analysis results of palm oil samples (μ g· kg-1, n=6) |
提出了基于破乳诱导萃取在MSIS双重模式下利用MP-AES测定棕榈油中多种重金属元素的新策略。 破乳诱导萃取将棕榈油中分析元素从油相转移至水相, 实现了分析元素的分离富集, 很好地解决了MP-AES基质耐受性低的难题。 方法的LOD为0.025~0.29 μ g· L-1, 低于类似研究的AAS和ICP-OES法, 部分元素LOD接近ICP-MS法。 MP-AES从空气中提取氮气为等离子体气源, 降低了分析运行成本。 方法操作简单快速, 安全性和稳定性好、 分析结果准确可靠, 适合棕榈油中多种重金属元素的高通量分析。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|