作者简介: 刘世杰, 1996年生, 河南农业大学食品科学技术学院硕士研究生 e-mail: 15938978937@163.com
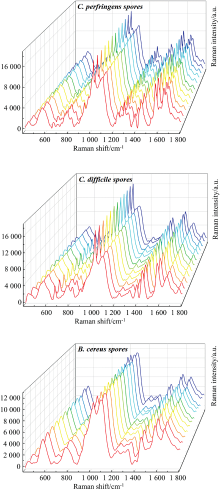
为了探究食源性致病菌芽孢的拉曼特征指纹图谱, 实现快速识别, 该研究以产气荚膜梭菌( C. perfringens)、 艰难梭菌( C. difficile)和蜡样芽孢杆菌( B. cereus)的芽孢为研究对象, 以柠檬酸钠还原法制备的AgNPs溶胶为基底材料, 用SERS技术对芽孢进行拉曼光谱检测, 解析食源性致病菌芽孢的分子结构、 不同芽孢之间的异同之处。 将3种食源性致病菌芽孢的SERS光谱与主成分分析(PCA)和系统聚类分析(HCA)相结合并进行对比分析, 实现不同种属食源性致病菌芽孢的定性识别。 结果表明, 不同食源性致病菌芽孢的SERS光谱的特异性和重现性良好。 芽孢光谱中Ca2+-DPA的拉曼振动峰数量和峰强度占主要地位, 其拉曼振动峰位置在657~663, 818~820, 1 017, 1 389~1 393, 1 441~1 449和1 572~1 576 cm-1波段。 C. difficile spores SERS光谱中Ca2+-DPA的六个特征峰峰强度均高于 C. perfringens spores和 B. cereus spores, C. perfringens spores次之。 Ca2+-DPA在1 017 cm-1(Ca2+-DPA)处拉曼峰强度在3种芽孢的SERS光谱中均最高且差异明显, 是Ca2+-DPA的主要特征峰, 也是3种芽孢的主要特征峰。 此外, C. perfringens spores在936 cm-1(磷脂N—C拉伸)、 1 294 cm-1(脂质中的CH2变形振动)、 1 609 cm-1(蛋白质中的酪氨酸)和1 649 cm-1(蛋白质中的酰胺I)显示特有拉曼振动峰; C. difficile spores在890 cm-1(=C—O—C=拉伸)显示特有拉曼振动峰。 PCA分析结果显示PC1和PC2方差贡献率分别为51.1%和39.7%, 累积贡献率达90.8%, 可以将所有样本有效区分。 HCA分析可以看出3种芽孢的SERS光谱被分为三个聚类, 3种芽孢各自聚类无交叉干扰。 结合多元统计分析不仅有效实现了3种芽孢之间的区分, 也实现了梭菌属芽孢和杆菌属芽孢的区分, 为食品安全控制提供有效手段。
In order to explore the Raman fingerprint of food-borne pathogenic bacteria spores for rapid identification. In this study, the spores of C. perfringens, C. difficile and B. cereus were used as the research objects. The SERS technology of AgNPs synthesized by the sodium citrate reduction method was used to detect the Raman spectroscopy of food-borne pathogenic bacteria spores and analyze the similarities or differences among different spores. The SERS spectra of three kinds of food-borne pathogenic bacteria spores were combined with principal component analysis (PCA) and hierarchical cluster analysis (HCA) for comparative analysis to identify different species of food-borne pathogenic bacteria spores. The results showed that the SERS spectra of different food-borne pathogen spores had sufficient specificity and reproducibility. In the SERS spectra of spores, the number and intensity of Raman vibration peaks of Ca2+-DPA were dominant, and the Raman vibration peaks were located at 657~663, 818~820, 1 017, 1 389~1 393, 1 441~1 449 and 1 572~1 576 cm-1. The intensity of six characteristic peaks of Ca2+-DPA in SERS spectra of C. difficile spores were higher than that of C. perfringens spores and B. cereus spores, followed by C. perfringens spores. The Raman peak intensity of Ca2+-DPA at 1 017 cm-1 (Ca2+-DPA) of the three spores was the highest, and the difference was noticeable, which was the main characteristic peak of Ca2+-DPA and the main characteristic peak of the three spores. In addition, C. perfringens spores showed unique Raman peaks at 936 cm-1(N—C stretching of phospholipid), 1 294 cm-1 (CH2 deformation vibration of lipid), 1 609 cm-1 (tyrosine of protein) and 1 649 cm-1 (amide Ⅰ of protein). C. difficile spores showed unique Raman peaks at 890 cm-1 (=C—O—C=stretching). PCA analysis showed that the variance contribution rates of PC1 and PC2 were 51.10% and 39.70%, respectively, and the cumulative contribution rate was 90.8%, which could effectively distinguish all samples. HCA analysis indicated that the SERS spectra of the three spores were divided into three clusters, and each cluster of the three spores had no cross-interference. The combination of multivariate statistical analysis effectively realized the distinction among the three spores and distinguished the distinction between Clostridium spores and Bacillus spores, providing an effective means for food safety control.
食源性致病菌引起的食源性疾病每年导致全球约2 000万人死亡, 2.6亿人致病, 其中多数案例与食源性致病菌芽孢菌相关, 如产气荚膜梭菌(C.perfringens)引起的气性坏疽和食物中毒、 艰难梭菌(C. difficile)引起的严重且经常致命的腹泻或伪膜性肠炎, 以及蜡样芽孢杆菌(B. cereus)引起的呕吐和腹泻综合症[1]。 芽孢是细菌营养细胞在环境胁迫下(营养匮乏、 干旱、 高温等)在胞内形成的休眠体, 对紫外辐射、 干燥、 强酸强碱和一些有毒化学物品等有极强的抵抗力, 在休眠状态下可以保持活力数年甚至数百年。 当条件有利于生长时, 芽孢感知外界萌发信号, 开始萌发, 其一旦萌发即会产生毒素, 危及人体健康, 存在极大的安全隐患。 因此, 探究快速、 高效、 无损的食源性致病菌芽孢检测方法迫在眉睫[2]。
近年来随着光谱技术的发展, 许多光谱技术被用于食品质量与安全检测, 但这些方法对食源性致病菌的检测都有一定的局限性。 例如, 荧光光谱技术, 图谱合一鉴别快速, 但缺乏化学信息的特异性, 易受元素相互干扰和重叠峰的影响[3]; 近红外光谱技术, 快捷且无损, 但不适用于水溶液的测量[4]。 拉曼光谱检测技术虽然检测信号弱, 但结合固体金属粗糙表面或者纳米溶胶悬浮液为基底(例如金、 银等贵金属), 开发表面增强拉曼光谱技术(SERS), 可实现拉曼信号的显著增强, 从而获得更多的微生物信号。 SERS作为一种生物指纹识别技术, 可以提供丰富的分子结构和组成信息, 具有无需标记、 操作简便、 检测时间短且无损等优势, 可以满足食品质量与安全领域快速检测的需求[5]。
目前, 国内外许多研究表明SERS技术在食源性致病菌检测研究方面具有巨大的优势和潜力。 Witkowska等[6]采用电化学方法将银纳米粒子沉积于FTO镀膜玻璃板作为SERS基底, 检测了五种不同食品基质中的食源性致病菌; Yang等[7]使纳米颗粒在尽可能多的点和尽可能近的部位与细菌表面, 基于SERS技术区分3株大肠杆菌DSM菌株; Li等[8]提出一种Fe3O4@PEI@bacteria复合物形式与SERS技术结合的方法识别金黄色葡萄球菌、 鲍氏不动杆菌和铜绿假单胞菌。 然而基于SERS技术对不同食源性致病菌芽孢的光谱解析及快速识别还未见报道。
因此, 以不同食源性致病菌芽孢为研究对象, 以柠檬酸钠还原法制备的AgNPs溶胶为基底材料, 用SERS技术对培养的芽孢进行拉曼光谱检测。 依据拉曼图谱间峰位归属和出峰强度差异解析食源性致病菌芽孢之间的分子结构以及不同芽孢之间的差异, 并结合多元统计分析, 实现食源性致病菌芽孢的快速识别, 为快速、 便捷地检测食源性致病菌芽孢提供有效手段。
菌株C. perfringens ATCC 13124, C. difficile ATCC 43593和B. cereus CMCC(B)63303, 来源于中国菌种保藏中心和广东环凯微生物技术有限公司。 脑心输注肉汤培养基(BHI), 液体硫乙醇酸盐培养基(FTG), 胰蛋白酶大豆琼脂(TSA), 营养琼脂(NA), 庖肉培养基, 购于青岛海博有限公司; 胰胨-亚硫酸盐-环丝氨酸琼脂培养基(TSC), 胰蛋白酶大豆琼脂(TSA), 胰蛋白酶大豆肉汤(TSB), 产芽孢培养基, 购于北京陆桥有限公司; 酵母提取物, L-半胱氨酸, 牛磺胆酸钠, 硫酸锰, 浓盐酸, 浓硝酸, 均为分析纯。
LabRAM HR Evolution激光共聚焦拉曼光谱仪, HORIBA 上海茂培科技有限公司; Winner802纳米激光粒度仪, 济南微纳颗粒仪器股份有限公司; BHC-1000IIA2 生物安全柜, 上海川一实验仪器有限公司; Hirayama HVE-50蒸汽压力灭菌锅, 广州市深华生物技术有限公司; BECKMAN COULTER高速冷冻离心机, 广州立诺自动化设备有限公司; ECLIPSE 80i生物显微镜, 日本NIKON公司; MIR-254低温培养箱, 日本SANYO公司; OSJ-UP-30L超纯水机, 济南欧莱博科学仪器有限公司, 等。
1.3.1 不同食源性致病菌芽孢的培养
产气荚膜梭菌芽孢的制备。 将冷冻的C. perfringens磁珠在TSC培养基上划线后, 在培养箱中37 ℃培养24~48 h。 从TSC平板上挑取典型的黑色菌落接种到庖肉培养基中, 37 ℃厌氧培养48 h。 取培养完成的菌液接种到新制备的FTG培养基中, 在水浴锅中75 ℃加热20 min, 并在37 ℃培养箱中培养18 h。 取该培养液接种到的FTG培养基中活化, 37 ℃培养4 h。 将培养液转接到配置好的产芽孢培养基中, 在培养箱中37 ℃厌氧培养24 h。 将培养完成的芽孢液在水浴锅中70 ℃加热25 min破坏营养细胞, 用无菌水离心(7 012 r· min-1, 20 min, 4 ℃)重复洗涤芽孢悬浮液3次。 通过相差显微镜100倍油镜进行芽孢检测, 将离心洗涤的芽孢重新悬浮于无菌蛋白胨水中, 并保存于-20 ℃环境中待用。
艰难梭菌芽孢的制备。 将冷冻的C. difficile磁珠FTG平板上37 ℃厌氧培养24~48 h。 从TSC平板上挑取单个菌落接种到已加入促芽孢生长因子(1%酵母提取物、 0.1% L-半胱氨酸和0.05%牛磺胆酸钠)的BHI肉汤中37 ℃厌氧培养5 d。 离心、 镜检与保存方法同上。
蜡样芽孢杆菌芽孢的制备。 将冷冻的B. cereus磁珠在BHI平板上划线, 在培养箱中37 ℃培养24~48 h。 挑取典型的蜡样芽孢杆菌菌落接种到胰蛋白酶大豆肉汤培养基中, 在培养箱中37 ℃培养24 h。 转接到添加50 mg· L-1 MnSO4的TSB培养基中, 之后在37 ℃下孵育7 d。 离心、 镜检与保存方法同上。
1.3.2 AgNPs溶胶的制备
把45 mg AgNO3溶解在250 mL超纯水中, 在回流下加热到沸腾。 在剧烈搅拌下滴加5 mL新鲜制备的1%柠檬酸钠溶液。 将混合物保持沸腾并搅拌90 min, 然后缓慢冷却至室温。 将得到的AgNPs保持在4 ℃避光保存备用[9]。
1.3.3 纳米材料的表征
通过紫外可见分光光度计(UV-Vis)、 纳米激光粒度仪和透射电子显微镜(TEM)对AgNPs进行表征。 UV-Vis表征和纳米激光粒度仪表征时用超纯水对纳米材料进行适当稀释后上机检测; TEM表征时将制备好的纳米金溶胶样品滴在碳支持膜, 用滤纸吸去样品表面多余的液体, 干燥固定后进行镜检。
1.3.4 载玻片的清洗
进行拉曼光谱扫描前, 将载玻片用王水(VHCl∶
1.3.5 SERS样品的制备
将培养所得的不同芽孢液各取1 mL, 离心3次后重悬备用。 将芽孢液稀释10倍和AgNPs 1∶ 1混合, 振荡均匀90 s, 取200 μ L混合液滴在处理好的载玻片上, 并将AgNPs和3种芽孢分别在载玻片上做空白对照, 放置在无菌操作台中自然晾干备用。
1.3.6 拉曼光谱检测
样品检测之前, 以520.7 cm-1峰作为基准峰使用硅片(Si)对拉曼仪器进行校正。 表面增强拉曼光谱采集使用532.8 nm的激光作为激发光源, 将激光强度设置为最大强度(15 mW), 物镜设置成100倍, 积分时间为30 s, 积分3次。 检测的光谱范围为400~1 800 cm-1, 分辨率为1 cm-1。 将制备处理好的样品进行上机检测, 之后使用LabSpec 6.0软件对样品进行光谱采集, 对每个样品分别随机采集12次。
1.3.7 数据处理
使用EXCEL 2010、 Origin 8.0与SPSS 16.0工具对数据进行分析和处理。
在100倍油镜的相差显微镜下观察产气荚膜梭菌芽孢(C. perfringens spores)、 艰难梭菌芽孢(C. difficile spores)和蜡样芽孢杆菌芽孢(B. cereus spores), 三种芽孢率均达到90%以上, 单一芽孢分布明显, 清晰可见, 中心“ 光亮” , 呈圆形或卵圆形。
按1.3.2方法制备的AgNPS溶胶颜色为灰绿色, 对其进行UV-Vis、 激光粒度和TEM表征。 由图2(a)可知, 通过UV-Vis表征, AgNPs溶胶的最大吸收单一峰在415 nm附近, 表明制备出AgNPs溶胶。 用纳米激光粒度仪对AgNPs的粒度大小进行检测, 结果表明AgNPS溶胶的粒径大小主要分布在35~55 nm范围内, 如图2(b)所示。 由图2(c)透射电镜图可知, AgNPs溶胶, 球体颗粒均一, 通过Nano Measurer计算得到AgNPs溶胶的平均尺寸约为45 nm。
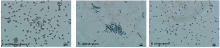 | 图1 三种食源性致病菌的相差显微镜镜检图Fig.1 Phase-contrast microscopic image of three food-borne pathogenic bacteria spores |
通过SERS技术对AgNPs、 3种芽孢和3种芽孢与AgNPs偶联的复合物分别进行12次随机拉曼数据采集, 经基线校正、 归一化和平滑处理, AgNPs对3种食源性致病菌芽孢的SERS增强效果、 3种食源性致病菌芽孢的SERS平均指纹图谱和SERS光谱拉曼位移的暂定归属如图3、 图4和表1所示。 3种食源性致病菌芽孢与AgNPs复合物进行SERS检测的结果如图3所示。 在无AgNPs偶联的情况下, 3种食源性致病菌芽孢的拉曼光谱图未出现任何显著特征峰型, 而经过AgNPs偶联的C. perfringens spores, C. difficile spores和B. cereus spores均显示出明显增强效应的拉曼光谱, 且3种芽孢的拉曼信号谱峰图之间差异明显。 因此, 采用以AgNPs溶胶为基底的SERS技术检测和区分这3种食源性致病菌芽孢是可行的。
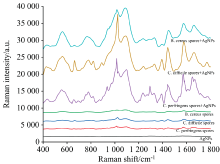 | 图3 AgNPs对3种食源性致病菌芽孢的SERS增强效果Fig.3 SERS enhancement effect of AgNPs on three food-borne pathogenic bacteria spores |
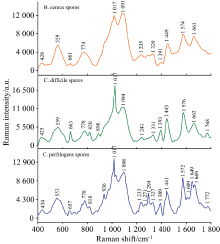 | 图4 三种食源性致病菌芽孢的SERS平均指纹图谱Fig.4 SERS average fingerprints of three food-borne pathogenic bacteria spores |
| 表1 三种食源性致病菌芽孢SERS光谱拉曼位移的暂定归属[10, 11, 12, 13] Table 1 Tentative attribution of Raman shift of SERS spectra of three food-borne pathogenic bacteria spores |
在3种食源性致病菌芽孢SERS光谱中Ca2+-DPA的拉曼振动峰数量和出峰强度占主要地位, 原因是芽孢中Ca2+-DPA浓度较高(估计为芽孢干重的5%~15%), 其拉曼振动峰位置大约在657~663, 818~820, 1 017, 1 389~1 393, 1 441~1 449和1 572~1 576 cm-1波段。 将Ca2+-DPA的六个特征峰分别编号为C1— C6, 并对C1— C6分别在3种芽孢的出峰强度进行对比, 结果如表2所示。 由表1可知, Ca2+-DPA的六个特征峰在3种芽孢SERS光谱中差异明显, C. difficile spores SERS光谱中Ca2+-DPA的六个特征峰峰强度均高于C. perfringens spores和B. cereus spores, C. perfringens spores次之。 3种芽孢的Ca2+-DPA在1 017 cm-1(Ca2+-DPA)处拉曼峰强度均最高且差异明显, 是Ca2+-DPA的主要特征峰, 也是区别三种芽孢的主要特征峰。
| 表2 Ca2+-DPA六个特征峰分别在3种芽孢SERS光谱的出峰强度对比 Table 2 Comparison of six characteristic peaks of Ca2+-DPA in SERS spectra of three spores |
3种食源性致病菌芽孢在425~434, 553~559, 774~778, 1 091~1 098, 1 233~1 236, 1 327~1 331和1 661~1 669 cm-1波段均有明显拉曼振动峰, 除1 094 cm-1在B. cereus spores出峰强度明显高于其他两种芽孢外, 其余每个波段拉曼振动峰的出峰强度在3种芽孢中基本一致。 这些拉曼振动峰分别归属于淀粉中碳水化合物的骨架模式、 蛋白质S— S拉伸、 核酸中的腺嘧啶或尿嘧啶、 核酸中的C=P— O伸缩振动、 C— H2拉伸振动、 蛋白质中的C— H变形振动和不饱和脂质中的酰胺Ⅰ 。
除此之外, 在3种食源性致病菌芽孢的SERS指纹图谱可以观察到三者拉曼振动峰数量明显不同(C. perfringens spores> C. difficile spores> B. cereus spores), 不同的拉曼振动峰归属于食源性致病菌芽孢的不同组成成分和化学键振动形式。 C. perfringens spores在936 cm-1(磷脂N— C拉伸)、 1 294 cm-1(脂质中的CH2变形振动)、 1 609 cm-1(蛋白质中的酪氨酸)和1 649 cm-1(蛋白质中的酰胺I)显示特有拉曼振动峰; C. difficile spores在890 cm-1(=C— O— C=拉伸)显示特有拉曼振动峰。 1 768~1 772 cm-1(酯的C=O基团伸缩)在C. perfringens spores和C. difficile spores均有显示, 但是不存在于B. cereus spores中。 由此可见, 3种食源性致病菌芽孢SERS光谱图谱中可以观察到一些拉曼振动峰出峰位置和出峰强度的差异, 表明以AgNPs溶胶为基底的SERS技术具有区分不同类型食源性致病菌芽孢的能力。
SERS基底的重现性对于常规分析的实际应用至关重要。 为检验基于AgNPs溶胶基底材料对五种食源性致病菌SERS检测的重现性, 使用激光共聚焦拉曼光谱仪分别对3种食源性致病菌样本随机扫描12次, 并对3种食源性致病菌芽孢在1 017 cm-1(Ca2+-DPA)处拉曼峰值的相对标准偏差(RSD)进行计算。 3种食源性致病菌芽孢SERS光谱的重复性试验结果如图5所示, 每种芽孢的12次 SERS光谱具有良好的的一致性。 经计算, C. perfringens spores在1 017 cm-1处的拉曼峰值RSD为0.96%, C. difficile spores在1 017 cm-1处的拉曼峰值RSD为0.77%, B. cereus spores在1 017 cm-1处的拉曼峰值RSD为1.58%, 表明基于AgNPS溶胶为基底材料的SERS技术检测食源性致病菌芽孢具有高度重现性, 为基于SERS技术对食源性致病菌芽孢的快速检测提供了强有力的支持。
主成分分析(PCA)可以提取3种芽孢SERS光谱中具有最高累积方差的前两个主成分 PC1和 PC2并进行PCA二维散点图绘制, 将复杂的多维空间数据转变为直观可见的分布散点图。 系统聚类分析(HCA)可以将3种芽孢SERS光谱进行先聚类再判断分析并构建树状图, 判断研究对象种群之间的相似性与差异性。
为了更好地实现不同食源性致病菌芽孢的定性识别, 避免相似的拉曼振动光谱对微生物分类和鉴定的干扰。 利用PCA和HCA分析, 评估基于AgNPs溶胶为基底材料的SERS技术检测3种食源性致病菌芽孢的图谱差异性, 分析结果如图6和图7所示。 PCA分析结果显示PC1和PC2方差贡献率分别为51.1%和39.7%, 累积贡献率达90.8%, 且PCA分析可以很明显地将3种芽孢的聚集成3个独立的簇, 每个簇独立无重复, 每种芽孢都能彼此区分开。 HCA分析可以看出3种芽孢被分为三个聚类, 3种各自聚类无交叉干扰。 在聚类距离21处C. perfringens spores和C. difficile spores被聚为一类, 相对于B. cereus spores, C. perfringens spores和C. difficile spores的SERS特征拉曼光谱较相似, 表明属于梭菌属芽孢的C. perfringens spores和C. difficile spores化学结构和组成相似性较高, 属于杆菌属芽孢的B. cereus spores在结构和组成成分上与其存在区分, 与Christie[14]等研究相似。 通过PCA和HCA分析不仅有效实现了3种芽孢之间的区分, 也实现了梭菌属芽孢和杆菌属芽孢的区分。
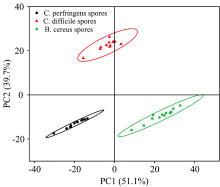 | 图6 三种食源性致病菌芽孢SERS图谱的主成分分析(PCA)二维散点图Fig.6 Two-dimensional scatter plot of principal component analysis (PCA) of SERS maps of spores of three food-borne pathogens |
利用柠檬酸钠还原法制备AgNPs溶胶的SERS增强作用, 通过激光共聚焦拉曼光谱检测可以发现与AgNPs偶联的C. perfringens spores, C. difficile spores和B. cereus spores均显示出明显增强效应的拉曼光谱图且光谱重现性良好。 3种芽孢的SERS光谱中Ca2+-DPA的拉曼振动峰数量和出峰强度占主要地位, 且在SERS图谱中可以观察到拉曼振动峰的差异, 表明以AgNPs溶胶为基底的SERS技术具有区分不同类型食源性致病菌芽孢的能力。 结合多元统计分析, 不仅有效实现了3种芽孢之间的区分, 也实现了梭菌属芽孢和杆菌属芽孢的区分, 为食源性致病菌芽孢检测和食品安全风险控制及检测提供了有效手段。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|