作者简介: 易军, 1962年生,河南省生态环境科学研究院高级工程师 e-mail: 4058978@qq.com
为明确DOM组分和总量的提取效果是否存在差异, 及是否需要分别设置提取时间, 选用常用的振荡和离心两种提取方式, 根据高速离心机与恒温振荡箱的工作上限设置提取时间梯度, 采用常用的光谱解析方法平行因子模型(PARAFAC)和荧光区域积分(FRI)分别表征设定时段内DOM组成特征的变化情况。 通过对上述两种方法解析的组分进行相关性和主成分分析得出: 使用FRI解析时类腐殖质组分与类蛋白质组分存在明显差异; PARAFAC分析类腐殖酸组分与类富里酸类组分存在明显差异, 需要分别对总量和组分设置提取时间。 以经济和提取组分分布稳定为原则, 筛选出荧光区域积分值或最大荧光强度得分值(Fmax)达到最大值的时间。 结果显示, 室温25 ℃下时, 在离心处理下采用两种方法分析得出的DOM总量与各组分的最佳提取时间均为45 min; 振荡处理下DOM总量、 类腐殖酸、 类富里酸、 类色氨酸、 类络氨酸和微生物代谢产物的最优提取时间分别为12, 21, 12, 12, 12和12 h, PARAFAC分析得出DOM总量、 C1、 C2、 C3的最优提取时间分别为12, 21, 12和39 h。 综上, 两种提取方式各有优点, 离心处理下组分与总量可采用同一提取时间。 振荡处理下区域积分值与Fmax呈现振荡大于离心, 且变化幅度较小, 提取效果较为稳定。 研究成果可为在进行三维荧光光谱测量DOM时优化提取方案提供一定的参考, 减小对后续研究产生的误差。
The judgment and assessment of preprocessing scheme for 3D fluorescence spectroscopy Optimized still depend on the total extraction volume. Since the release of the DOM during extraction with the discrepancy between components, the studies might be more reasonable if we had considered the extraction of DOM components. This paper aims to clarify the differences in the extraction of DOM components and total and whether it is necessary to set the separate extraction time. Two common extraction methods, oscillating and centrifuging, were used. The time was set as the upper limit of the high-speed centrifuge and the constant temperature shaking box. PARAFAC and FRI were used to characterize the DOM compositional characteristics at different extraction times. According to the correlation and principal component analysis, it was found that there were different interactions between the components, and the optimal preprocessing time was screened out on the condition that the regional integral value and Fmax reached the maximum. The humus-like components were strongly positively correlated with the total (p<0.05), and the protein-like components were less correlated with the total using FRI analysis. The humic acid-like components were strongly positively correlated with the total.The fulvic acid-like fractions were weakly correlated with the total amount using PARAFAC analysis (p<0.05). There were differences in the extraction of total and components, which required separate pre-treatment time settings. The choice of extraction time is premised on the economy and stability of the distribution, the reby choosing the maximum of fluorescence regional integration or fluorescence intensity score (Fmax). The results showed that the optimal extraction times for entirety, humic acid-like, fulvic-like, complexine-like, tryptophan-like substances and microbial metabolites were 12, 21, 12, 12, 12, and12 h, respectively. PARAFAC analysis showed that the optimal extraction times for entirety, C1, C2, and C3 were 12, 21, 12, and 39 h, respectively. In summary, the two extraction methods have their advantages. The same extraction time can be used for the components and the overall time under the centrifugal treatment. The regional integral and Fmax values under the shaking treatment showed more oscillation than the centrifugation, and the extraction effect is relatively stable. The research results can provide a data basis and guidance for optimizing the preprocessing scheme when measuring DOM by three-dimensional fluorescence spectroscopy.
溶解性有机物(dissolved organic matter, DOM)是一种富含芳香性和脂质类、 分子量非均匀的混合物, 含有羟基、 羧基、 羰基等活性基团, 广泛存在于天然水体(河流、 湖泊等)及其沉积物、 土壤、 污(废)水、 雨水道路径流等中, 并作为其中最为活跃的组分几乎参与所有的生物化学过程[1], 因此研究DOM的时空变化可以揭示营养物质及污染物的迁移转化规律[2]。 在以往研究中多使用溶解有机碳(dissolved organic carbon, DOC)、 溶解有机氮(dissolved organic nitrogen, DON)、 紫外吸光度系数等[3, 4]表征DOM的浓度或含量的相对大小, 但是仅限于DOM总量的表征。 近年来, 三维荧光光谱技术因其提取方法简单、 无须添加化学试剂避免了二次污染、 灵敏度高(10-9数量级)以及不破坏样品结构等优点受到广泛应用。 目前, 随着与光谱解析手段平行因子(parallel factor analysis, PARAFAC)模型和荧光区域积分法(fluorescence regional integration, FRI)等的结合, 可以进一步获取DOM的组成分布、 来源等信息[5]。 例如腐殖酸和富里酸物质是评价堆肥腐熟度的重要指标[6]。
然而由于提取对象不同, 三维荧光光谱扫描前样品的提取时间从10 min到30 h不等[7, 8, 9]。 因此, 研究者就有关三维荧光光谱的最佳提取方案开展一系列研究。 申钊颖等[10]选用总荧光强度达到最大值后趋于稳定的时刻作为湿地DOM最佳提取方案的判别标准。 赵鹏鹤等[11]在探究污泥资源化的最佳预处理温度参数时, 选用荧光峰强度最大作为标准。 Xie等[12]在研究稻田DOM的预处理条件时, 发现提取时间、 水土比、 提取剂浓度与DOM成分有关, 并选择获得荧光峰强度最大的提取方案。 这些研究集中于土壤或沉积物DOM, 并且预处理方案的选取以DOM总量的提取效果最佳, 目前关于组分提取效果的研究未见报道。 此外, DOM作为一类含碳的大分子复杂有机聚合物, 不同组分的提取释放情况不同, 总量与组分的提取时间可能存在差异, 如果仍以提取总量效果为依据, 会存在由于组分未提取完全所造成的误差。
为对比各组分和总量的最优提取时间的差异, 本研究选用腐殖酸(humic acid, HA)作为供试材料, 采用三维荧光光谱结合PARAFAC和FRI分析不同提取方式下DOM组分光学特性随时间变化情况, 根据各荧光区域积分值和最大荧光强度得分值(Fmax)筛选出最佳提取时间。 本文中得到的DOM总量与组分的最佳提取时间, 可为DOM提取方案的优化提供一定的参考。
本研究使用的HA购自天津光复试剂公司。 取1 g HA加入锥形瓶中, 加入100 mL去离子水配制样品。 一组在室温(25 ℃), 150 r· min-1恒温振荡箱内, 根据恒温振荡箱的工作时间上限设置振荡时间为0~72 h, 间隔为3 h; 另一组在4 000 r· min-1高速离心机内, 根据离心机最大工作时间设置的离心时间为0~60 min, 间隔为5 min。 静置4 h后, 将每个试样的上清液经0.45 μm水系微孔滤膜过滤得到DOM提取液, 稀释至UV260< 0.02以去除内滤效应。
采用荧光分光光度计(F4600)测量样品的三维荧光光谱。 激发光源为氘灯。 激发波长范围为220~450 nm, 步长5 nm, 发射波长200~500 nm, 步长5 nm, 狭缝宽度5 nm, PMT电压400 V, 扫描速度1 200 nm· min-1, 在1 cm石英荧光比色皿中测量。
利用MATLAB 2018对光谱数据(分析前以Milli-Q超纯水为空白扣除瑞利散射和拉曼散射的影响)进行FRI和PARAFAC解析。 通过PARAFAC识别荧光组分前, 将荧光强度归一化为激发波长350 nm处的拉曼信号强度(RU350), 用最大荧光强度(Fmax)值评估荧光峰强度。 通过FRI方法得出不同区域的积分标准体积代表各区域对应的DOM相对含量[13], FRI所划分的五个区域见表1, 相关计算公式见式(1)— 式(3)。 利用Origin2018将处理好的光谱数据绘制成等高线谱图。
式中: Ф i, n为荧光区域i的积分标准体积; Ф i为荧光区域i的积分体积; λ ex为激发波长; λ em为发射波长; I(λ exλ em)为激发发射波长对应的荧光强度; Ф T, n为总荧光区域积分标准体积; Pi, n为荧光区域i的积分标准体积占总积分标准体积比例; MFi为倍增系数, 为荧光区域i的积分面积占总的荧光区域积分面积比例的倒数。
| 表1 荧光积分区域划分范围 Table 1 Fluorescent integral area |
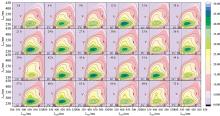
三维荧光光谱可以指示可溶性有机物的种类、 性质和相对含量等丰富信息, 从而反映提取样品中DOM的变化情况。 振荡和离心提取着HA水解的三维荧光光谱分别见图1、 图2。 结果表明, 随着提取时间的变化, DOM的光谱形状基本无明显变化, 但荧光峰强度呈现上升到下降的往复过程。
图3为离心和振荡提取下光谱区域体积积分变化情况。 荧光区域的体积积分(Ф i)可间接表征不同区域特定结构荧光组分的相对含量。 结果表明, 与离心相比, 振荡各组分的占比变化幅度较小; 在离心和振荡处理下类腐殖质组分的积分占比(P1+P2)最大, 分别占比53.41%~70.67%, 74.55%~81.77%; 类蛋白质组分占比(P3+P4)分别在25.84%~42.65%, 14.85%~21.96%; 而微生物代谢产物的积分占比(P5)均在3%左右, 说明振荡处理提取效果较稳定。
通过拆半分析、 残差分析、 平方误差和、 解释方差和核一致性分析, 确定两种提取方式DOM平行因子分析模型的最佳因子数为3, 其荧光光谱图如图5。 表2为所有组分的激发和发射波长最大值的位置, 在Open Fluor数据库中查询到三个组分的多个强匹配项(tucker congruence coefficient, TCC> 0.95), 提供了荧光成分的近似描述。 C3组分的荧光峰最大值较C1组分发生了红移, 表现出更复杂的性质。 同C1相比, C3生物生产、 降解和吸附的强度更低[14]。
| 表2 HA的DOM荧光组分特征 Table 2 Characteristics of fluorescent component in humic acid DOM |
两种提取方式下Fmax变化情况如图4所示, 振荡提取样品的Fmax为C1> C2> C3组分, 离心提取样品的Fmax为C2> C1> C3组分。 C1对整个模拟荧光得分的平均贡献率为44.03%, C2平均贡献率44.28%之间, C3平均贡献率为11.68%。
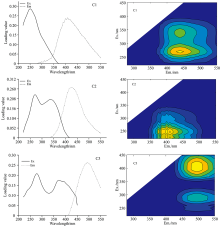 | 图5 基于PARAFAC解析出两种提取方式下HA的DOM荧光组分Fig.5 Fluorescence components of humic acid under the two extraction methods by PARAFAC model |
提取过程中振荡处理的区域体积积分值和Fmax值均大于离心, 且其占比的变化幅度小于离心处理。 说明振荡处理提取量充分且提取的组分相对较稳定。 因为高速离心机工作时间最大为60 min, 恒温振荡箱工作时间上限为4 500 min, 可以通过较长时间的振荡提取分子结构比较复杂的组分。 离心是利用转子高速旋转产生的强大离心力, 在较短时间内迫使这些微粒克服扩散产生沉降运动[20], 多用来分离不同密度的混合物。
两种提取方法的区域积分值和Fmax变化趋势基本一致, 呈现先上升后下降又恢复上升趋势, 直至上升幅度趋于平缓。 图6(a)显示, 类络氨酸与类腐殖质、 微生物代谢产物组分呈负相关, 与类蛋白质组分呈正相关。 可能是由于各组分之间存在复杂的相互作用, 导致类络氨酸变化规律与其他组分存在差异。 在提取前期DOM被不断释放含量上升; 出现下降时可能是出现絮凝现象, 当释放量大于絮凝量会出现上升, 反之则会下降。 同时, 大分子物质的絮凝能力大于小分子物质[20], 这一点在振荡提取后期(72 h)中荧光区域Ⅲ 体积积分(Ф 3)、 区域Ⅳ 体积积分(Ф 4)较初期上升, 而区域Ⅰ 体积积分(Ф 1)、 区域Ⅱ 体积积分(Ф 2)则出现下降能够得到证实。
对PARAFAC和FRI分析得到的不同提取时间下的区域积分值和Fmax进行相关性分析和主成分分析, 结果如图6、 图7所示。 DOM组分间的相关关系表明它们来源或其结构具有某种联系。 相关性结果显示, 离心处理下荧光区域积分Ф 1, Ф 2和Ф 5均与总量呈现显著正相关(p< 0.05), Ф 3, Ф 4与总量的关系较弱; C1, C2和C3均与总量呈现显著正相关(p< 0.05)。 类腐殖质组分与总量的提取情况相似, 类蛋白质与总量的提取情况存在差异, 说明各组分之间的相互作用不同, 总量的提取情况无法概括组分的情况, 需要对组分和总量分别设置提取时间。 PARAFAC和FRI解析DOM的主成分1对总方差的解释分别达到67.9%和66.0%, 第2主成分对总方差的解释分别达到32.0%和25.7%, 累积分别达到99.9%和91.7%, 说明主成分分析法对原数据的损失不大。 两种解析方法下主成分1的主要影响因子均是类腐殖质组分(Ф 2, C1), 表明类腐殖质组分与总量的提取情况相似。
分别根据区域积分值、 Fmax以及经济角度考虑, 筛选出的最佳提取时间结果见表3。 以往研究中[21], DOC的提取过程符合一级动力学模型, 与本研究中得到结果存在差异, 可能是本研究中提取时间较长, 存在分段符合动力学模型的情况。 由于本研究中每次组分提取量趋于稳定时的峰值相差较小, 从经济角度, 选择区域积分值和Fmax初期出现峰值的时间。 此外, 本研究针对总量提取时间的选取, 为体现组分的提取效果, 以各组分占比变化趋于稳定为前提, 筛选区域积分值和Fmax初期出现峰值的时间。 离心处理的组分最佳提取时间同理可得。 同时, 根据相关性分析和主成分分析发现, 类富里酸组分(区域Ⅱ 、 C2)与总量的相关性较高且是主成分1的主要影响因子, 二者具有相同的提取时间。 说明总量可与影响因子较大且相关性较强的组分选择相同的提取时间。 综上, 两种提取方法各有优点, 振荡提取的分子量大于离心处理, 提取组分比例较为稳定。 离心提取下总量与组分最佳提取时间可选为一致。
| 表3 两种提取方法下最佳提取时间结果 Table 3 Best extraction time results under two extraction methods |
PARAFAC分析和FRI方法对DOM组分的解析情况存在差异[22], 本研究根据以上两种方法识别出的组分类别存在差异, 但是通过分析得到的最佳时间呈现较高的一致性。 虽然从表3来看, 振荡处理中PARAFAC分析识别出的C3为类腐殖酸组分, 与FRI方法中的区域Ⅰ 相对应, 但是二者的最佳提取时间不同。 这是由于FRI方法把一部分类腐殖酸类物质划分入了类富里酸物质[23], 同时C3的发射波长也较同为类腐殖酸组分的C1发生红移, 结构更为复杂, 需要延长提取时间, 这一点与DOC在提取过程中得出的结论一致[21]。
同时还必须强调本研究的局限性, 因为本研究只针对这一种外源有机物的最佳提取时间, 不同类别的外源有机物组分类别及分布存在差异, 组分与总量的关系是否存在差异, 需要后续进行比较研究。 此外, 在提取方案中对组分的最佳提取剂种类、 样品浓度等可参考本文开展进一步研究。
(1)组分与总量在提取过程中DOM释放情况均存在差异, 需要分别设置提取时间。 组分的最佳提取时间筛选条件为: 以提取量变化趋于平稳为前提, 选择初期区域体积积分值或Fmax达到峰值的时间。 总量的最佳提取时间筛选条件为: 以各组分占比变化趋于稳定为前提, 筛选区域积分值和Fmax初期出现峰值的时间。
(2)FRI分析得出离心提取下最优提取时间除类络氨酸为10 min外均为45 min, 在振荡提取下总量、 类腐殖酸、 类富里酸、 类色氨酸、 类络氨酸和微生物代谢产物的最优提取时间分别为12, 21, 12, 12, 12和12 h; PARAFAC分析得出总量、 C1、 C2、 C3在两种提取方式下的最优提取时间分别为: 45, 45和45 min; 12, 21, 12和39 h。
(3)两种提取方法各有优点, 振荡提取的分子量大于离心处理, 提取组分比例较为稳定。 离心提取下总量与组分最佳提取时间可选为一致。 两种光谱解析方法得出的结果也呈现高度一致性。 总量的最佳提取时间与相关性较高且影响因子较大的组分一致, 分子结构复杂的组分需要延长提取时间。
(4)需要后续结合对不同类别的外源有机物组成成分及分布进行比较研究, 明确是否组分与总量的关系均存在差异。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|