作者简介: 范春辉, 1982年生,沈阳师范大学生命科学学院副教授 e-mail: fanchunhui@synu.edu.cn
再生水灌溉农业是实现再生水回用的有效途径, 其天然优势和操作可行性已得到普遍认可。 再生水灌溉农业能够取得良好的生态效益、 社会效益和经济效益, 但灌溉过程可能导致土壤有机质的性质异化和非定向流失, 相关问题尚没有引起足够重视。 选取溶解性有机质(DOM)为目标对象, 对灌溉过程农业土壤淋溶液DOM谱学信息差异化机制这一科学问题展开研究。 以污水源再生水和河水源地表水(参比对照)为灌溉水源, 借助一维原状土柱分析灌溉过程对土壤和淋溶液的影响, 对土壤表面形貌(SEM)、 淋溶液DOM紫外可见光谱(UV-Vis)和三维荧光光谱(3D-EEMs)进行比对, 初步掌握灌溉后土壤淋溶液DOM的基础信息。 结果表明: 灌溉后的土壤团聚体结构松散、 表面粗糙, 出现细粒组分聚集和粘结的现象。 土壤有机质随土壤深度增加逐渐减少, 土壤DOM在10~20 cm土层分布最多; 灌溉过程能够增加0~30 cm土壤有机质和0~20 cm土壤DOM含量, 证明土壤对灌溉水有机物具有截留作用。 两种淋溶液DOM的UV-Vis谱图比较相近, 均在240~270 nm区间出现吸收平台(源于DOM不饱和双键共轭结构); 相比之下, 再生水源土壤淋溶液DOM的芳香化程度更低、 结构更简单, 两种淋溶液DOM中富里酸含量高于胡敏酸。 淋溶液DOM三维荧光光谱仅出现一处荧光峰, 位于Ex/Em=260~270/420~430 nm区域, 表明有类腐殖质组分的存在。 经与前期研究结果比对, 推测氨基酸类物质、 类蛋白组分等可能被(灌溉过程)阻滞于土壤体系; 自生源(内源)DOM对土壤淋溶液DOM的贡献更大, 而外源DOM的影响程度有限。 相关结果有助于深度评估再生水灌溉过程农业土壤DOM(或有机质)的流转归趋和生态效应。
Agricultural irrigation is effective for the reutilization of reclaimed water, and the natural advantages and operational feasibility have been generally approved. Agricultural irrigation with reclaimed water can achieve acceptable ecological, social and economic benefits, while organic matters in the soil might lose or change during the irrigation process, and the related issue has received insufficient attention. Dissolved organic matter (DOM) was selected as the analysis target, and the scientific issue was to reveal the variation mechanism of DOM spectral information in leachate released from the irrigated agricultural soil. Samples of reclaimed water (from wastewater treatment plant) and surface water (from the river, for contrast) were used, and a one-dimensional undisturbed soil column was applied to study the irrigation effect on soil and soil leachate. The electronic scanning microscopy (SEM), ultraviolet-visible spectroscopy (UV-Vis) and three-dimensional excitation-emission matrix fluorescence spectroscopy (3D-EEMs) were involved in reveal the fundamental information of DOM released from soil irrigated with water samples. The results show: that soil aggregates appear lose structure and rough surface after irrigation, and small soil particles gather and stick together. The contents of organic matter decrease with the increased soil depth, and DOM content reaches maximal at 10~20 cm of the soil layer. The concentrations of organic matter (0~30 cm of soil layer) and DOM (0~20 cm of soil layer) increase after irrigation, suggesting the interception effect of water organic compounds by soil samples. The UV-Vis spectra of leachate are similar, and the unsaturated double-bond conjugate structures cause the absorption regions at 240~270 nm in DOM. The lower aromatization degree and more straightforward structure of DOM can be detected in soil leachate irrigated with reclaimed water, and the content of fulvic acid is higher than that of humic acid. The only fluorescence peak of DOM appears in theEx/Em=260~270/420~430 nm, regarded as a humus-like component. Compared to the previous results, it is deduced that amino acid-like and protein-like components might be adsorbed and retained in soil. Bio-source (endogenous) DOM plays a more important role than exogenous DOM in soil leachate. The achievements are significant to estimate further the circulation, transportation and ecological effect of DOM or organic matters in the reclaimed water-irrigated agricultural soil systems.
溶解性有机质(dissolved organic matter, DOM)是一类具有复杂组成和功能结构的活跃载体[1]; 作为连接碳基生命和无机碳的关键纽带, DOM常常参与各种生物地球化学循环, 进而调控界面组分的环境行为和生物有效性。 一直以来, DOM关键信息的识别鉴定都是领域内的讨论热点, 但其来源多样性、 性质多变性和体系多维性也增加了相关研究难度[2]。
再生水灌溉农田是实现再生水资源化利用的重要途径[3], 在美国、 澳大利亚、 以色列、 突尼斯等国得到了大力推广和成功应用, 我国的天津、 北京等城市早在十几年前也完成了再生水回灌农田的工程化示范。 再生水灌溉农业有其天然优势, 但灌溉过程对土壤DOM的淋溶效应不可忽视, 有可能一定程度上干扰土壤微生态系统平衡。 Gu等[4]认为: DOM可以被水流冲刷出土壤, 造成土壤性质和肥力改变。 Liu等[5]发现: 天然降雨(再生水的一类)能够影响土壤DOM含量, 但DOM的输出过程较为复杂。 现阶段, 研究者对污水源再生水作用下土壤DOM动态归趋关注较少, 而对于再生水灌溉过程农业土壤淋溶液DOM的性质识别, 更是几乎查不到系统性的参考资料。
对于再生水灌溉农业, 要全面关注灌溉前(成本核算、 策略优化等)、 灌溉中(效能识别、 异常现象等)和灌溉后(风险评估、 长期监控等)三个阶段可能出现的生态效应, 尤其对于“ 灌溉后” 相关问题的跟踪剖析恰恰是目前亟待弥补的研究短板。 基于前期研究[6], 以污水源再生水和河水源地表水为研究样本, 通过一维原状土柱体系模拟灌溉过程, 对土壤表面形貌、 淋溶液DOM的紫外可见光谱和三维荧光光谱进行比对, 初步掌握“ 灌溉后” 土壤淋溶液DOM的内在差异, 以期为DOM水土界面的运移转化、 灌溉过程的效能评估和再生水灌溉农业的可持续发展提供理论依据。
总有机碳分析仪(TOC-500, SHIMADZU), 原子吸收分光光度计(Z-2000, HITACHI), 扫描电子显微镜(TM3030, HITACHI), 紫外可见光谱仪(TU-1901, 北京普析通用), 荧光光谱仪(F-7000, HITACHI)。 除再生水和地表水外, 其余用水为超纯水, 化学试剂为优级纯。
再生水取自沈阳市某污水处理厂出水口, 采样时间为2021年4月, 当天天气多云、 空气质量良、 无降雨; 该污水处理厂污水接纳范围为工业废水和生活污水, 具有区域代表性。 地表水采自浑河流域沈抚段, 以闸坝为水体采样分界点, 具体位于沈阳新立堡立交桥至东陵大桥区间河段; 采样时间为2021年5月(平水期), 当天天气晴好、 空气质量良、 无降雨。 将水样装入棕色广口瓶后带回实验室, 放入4 ℃冰箱中保存。 实验土壤为原状取土钻(304不锈钢材质)获取的原状土柱, 采集地点为沈抚新区核心区农田地块(沈阳东陵公园和沈阳鸟岛南部), 7日内完成全部分析测试。 再生水、 地表水和农业土壤基本理化性质见表1(数据仅适用于本文实验样品, 不具有其他代表意义)。
| 表1 再生水、 地表水和农业土壤基本理化性质 Table 1 Physicochemical properties of reclaimed water, surface water and agricultural soil |
采用一维柱系统分析灌溉过程的淋溶行为, 其中一维柱为有机玻璃材质圆形柱, 总柱高50 cm(满足大部分农田作物主要根系的土壤下扎和分布深度), 柱内径5 cm。 基于前期研究, (蠕动泵)调控灌溉速率(3 mL· min-1)和灌溉时间(12 h); 土柱表面用锡箔纸包裹(避光), 布水板保障水体与土柱均匀接触; 柱底用尼龙筛网固定, 相关部位用胶垫密封, 确保柱中土壤不流失。 实验时, 将采集的原状土直接装柱进行后续操作。
参考《水和废水监测分析方法》[7]和《土壤农业化学分析方法》[8]测定样品基本理化性质。 为了反映灌溉过程的整体效果, 收集12 h内的全部土壤淋溶液进行分析测试。 借助水提法(水土比5:1)获取土壤DOM溶液, 将淋溶液过0.45 μm滤膜即得土壤淋溶液DOM样品, 总有机碳分析仪测定样品DOM含量(以DOC计)。 将灌溉前后的土壤自然风干, 导电胶固定后喷金0.5 min, 放入检测室观察表面形貌; 扫描电镜加速电压5 kV, 放大倍数1 000倍。 紫外可见光谱扫描波长200~700 nm, 扫描间隔1 nm, 狭缝宽1.5 nm, 扫描速度400 nm· min-1。 荧光光谱光源为150 W氙灯, 激发波长200~500 nm, 发射波长200~700 nm, 光电倍增管(PMT)电压550 V, 扫描速度1 200 nm· min-1。
实验器皿使用前经浓度为10%的HNO3浸泡24 h, 超纯水反复洗净后备用。 所用仪器均已充分预热, 以获取稳定的工作状态。 为避免二次瑞利散射的干扰, 出射光加290 nm截止滤光片; 以超纯水为空白, 样品荧光光谱数据都同时扣除空白值。 每个实验样品平行测定三次, 以均值为最终结果。 利用Origin软件处理数据并绘图。
对灌溉前后的土壤表面形貌进行分析, 结果见图1。 总体上看, 灌溉前的土壤骨骼颗粒呈现不规则团聚形态, 轮廓清晰, 棱角分明, 颗粒边缘具有一定磨圆度[图1(a)]; 团聚体中包含块状、 条状、 棒状、 片状、 粒状等多形态微粒, 或紧密重叠, 或交替排列, 结构性和完整性较好。 经再生水和地表水灌溉后, 土壤团聚体结构松散, 表面均一度变差, 细粒组分趋于定向聚集和重新粘结, 呈现更加粗糙的表观特性[图1(b, c)], 这主要源于灌溉过程的水力分散作用、 土壤颗粒的再聚集和再压实效应; 再生水灌溉和地表水灌溉对土壤形貌的影响相差不大。
灌溉前后土壤和淋溶液的有机质及DOM含量见表2。 可以看出: 农业土壤有机质的剖面分布具有一定规律, 即有机质含量随土壤深度增加逐渐降低, 体现出土壤有机质的表聚性, 同时也暗示了土壤发生学和生态气候学信息。 土壤DOM在10~20 cm剖面分布最多; 经再生水和地表水灌溉后, 0~30 cm土壤有机质和0~20 cm土壤DOM含量增幅明显, 再生水的贡献较地表水更突出, 这源于表层土壤对水中有机物的截留和累积效应[9]。 土壤其他剖面相关参数变化不大, 甚至较灌溉前有所降低; 原因在于水中大部分有机物被表层土壤吸附阻滞, 此时水体对深层土壤的冲刷和淋溶过程占据优势。 为了便于表述, 将再生水和地表水灌溉产生的土壤淋溶液分别记为A水样和B水样(下同)。 由表2可知: A水样和B水样DOM浓度分别为1.68和2.01 mg· L-1, 低于相应原始值(2.92和4.36 mg· L-1), 进一步证实了土壤对灌溉水DOM的留存作用。
| 表2 灌溉前后土壤和淋溶液的有机质及DOM含量 Table 2 Contents of organic matters and DOM in soil and soil leachate before and after irrigation |
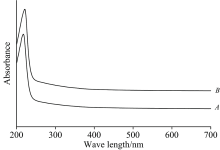
灌溉后土壤淋溶液DOM紫外可见吸收光谱见图2。 A水样和B水样DOM的UV-Vis曲线非常接近, 其中: 217 nm(A水样)和221 nm(B水样)为无机离子(硝酸盐、 溴化物等)吸收峰; 240~270 nm区间吸收平台与DOM不饱和双键共轭结构有关; 280 nm附近出现π → π * 跃迁弱吸收平台, 代表DOM木质素磺酸及衍生物等相关组分; 除此之外, 并没有检测到其他特征峰。 此结果与笔者之前证实的地表水和表层沉积物DOM图谱有相似之处[7], 暗示了异源DOM光谱表征方法的通用性和可借鉴性。
对土壤淋溶液DOM紫外可见光谱特征参数进行分析, 结果见表3。 A水样DOM的SUVA254, SUVA260和SUVA280数值都小于B水样, 分别对应A水样DOM芳香化程度更低、 疏水性有机组分含量更低和芳香化合物含量更低(结构更简单)的特性。 B水样DOM的E253/E203值大于A水样, 说明B水样DOM芳香环取代基中脂肪链所占比例较低, 芳香环上羧基、 羟基和羰基等取代基比例较高。 A水样DOM的E2/E3值略小于B水样, 表明A水样DOM相对分子质量更大; E2/E3值都大于3.5, 表明两种水样DOM中富里酸含量高于胡敏酸。 B水样DOM的E2/E4值高于A水样, 暗示B水样DOM分子缩合度更低, 而较高的E4/E6值则可能意味着B水样DOM苯环C骨架聚合程度较小[10]。
| 表3 灌溉后土壤淋溶液DOM紫外可见特征参数 Table 3 UV-Vis characteristic constants of DOM in leachate from irrigated soil |
灌溉后土壤淋溶液DOM三维荧光光谱见图3。 研究发现: 图谱中只出现一处较明显荧光峰, 位于Ex/Em=260/420 nm[A水样见图3(a)]和Ex/Em=270/430 nm[B水样见图3(b)]附近, 对应的荧光强度(无量纲)分别为1 018和1 276; 该特征峰可表征类腐殖质, 多来源于土壤或与土壤有关的有机物[11]。 两种水样DOM均未检测到类蛋白、 类氨基酸或其他组分特征峰。 笔者之前分析过污水源再生水DOM的三维荧光光谱, 谱图中发现类酪氨酸、 类色氨酸和类腐殖质特征峰; 经与本文结果比对, 推测再生水氨基酸类物质可能被(灌溉过程)截留于土壤体系。 上述结果同时表明: 自生源(内源) 可能对土壤淋溶液DOM贡献更大, 而灌溉水输入(外源)对淋溶液DOM的影响有限。
 | 图3 灌溉后土壤淋溶液DOM三维荧光光谱 (a): A水样; (b): B水样Fig.3 3D-EEMs spectra of DOM in leachate from irrigated soil (a): Water sample A; (b): Water sample B |
通过荧光指数(FI)、 腐殖化指数(HIX)、 生物源指数(BIX)和荧光效率(Feff)揭示土壤淋溶液DOM的来源特征[13], 结果如表4所示。 FI值分别为1.69(A水样)和1.84(B水样), 依据自生源临界值(FI> 1.9)和陆源临界值(FI< 1.4)进行判别, 证实土壤淋溶液DOM为混合来源, 即存在微生物代谢和人类活动的共同影响。 A水样DOM的HIX值小于4, 说明其自生源作用明显, 腐殖化特征较弱, 这与表3的SUVA254结论相符; B水样DOM的HIX值介于4~6之间, 代表DOM归属为较强生物内源和较弱陆地外源。 A水样和B水样DOM的BIX值小于1, 表明DOM具有较强自生源特征。 B水样DOM的Feff值相对更高, 推测其中含有更多活性官能团, 可能与微生物降解活动有关。
| 表4 灌溉后土壤淋溶液DOM荧光参数 Table 4 Fluorescence spectra constants of DOM in leachate from irrigated soil |
农业灌溉后土壤淋溶液DOM的指纹信息具有指示作用, 对于判断DOM微观生态位、 土壤组分水力弥散和异质圈层生态响应较为有效。 在本研究条件下, 再生水和地表水灌溉能够增加表层土壤有机质和DOM含量, 这与同类研究结果基本吻合[13]。 值得注意的是, 尽管灌溉水源(再生水和地表水)理化性质不同, 但灌溉后土壤淋溶液DOM的UV-Vis和3D-EEMs图谱比较相似。 广义的水体DOM包括类腐殖质、 类氨基酸、 糖类、 类蛋白、 木质素等组分; 其中的糖类和类蛋白易被分解, 木质素多源于特定行业(造纸、 印染等)废水和新鲜植物碎屑。 实际上, 本研究使用的两种灌溉水源DOM以类腐殖质和类氨基酸为主, 这一点已被以往研究。 类氨基酸具有丰富的功能基团和较高生物活性, 常常扮演土壤组分合成的媒介或前体, 这种特性也决定了其与土壤体系的优良结合潜力[14]。 鉴于此, 本研究土壤淋溶液DOM仅出现类腐殖质荧光峰, 以及紫外和荧光谱图的高度类似也不难理解。 相应特征参数还是暗示了DOM的微观差异, 比如芳香度、 相对分子质量、 分子缩合度和来源特征等, 说明谱学识别与化学分析结合使用才能取得全面的科学论据。
本研究结果具有一定学术价值, 但也同步衍生出如下理论问题。 第一, 灌溉过程(外源和内源)DOM在不同土层间的动态演替和截留分配, 体现了DOM的时空变异特质; 第二, 土壤和淋溶液DOM精细组分的分离和提纯, 有助于深度认知DOM的分子结构和表生行为; 第三, 淋溶液DOM光谱参数与土壤性质的相关性检验, 能够为灌溉淋溶的关键过程和驱动机制提供参考。 后续将以此为切入点, 剖析DOM的“ 水(源)— 土(介质)— 水(汇)” 循环路径, 为生态系统碳库格局、 碳流迁移等关键生物地球化学过程提供证据支持。
经污水源再生水和河水源地表水灌溉后, 农业土壤团聚体结构松散、 表面粗糙, 细粒组分趋于聚集和粘结。 灌溉过程可以增加土壤有机质(0~30 cm)和DOM(0~20 cm)含量, 推测表层土壤能够截留灌溉水中有机物。 UV-Vis谱图的240~270 nm区间出现吸收平台, 表明DOM不饱和双键共轭结构; 再生水源土壤淋溶液DOM芳香化程度低、 结构简单, 两种淋溶液DOM中富里酸含量高于胡敏酸。 3D-EEMs图谱的荧光峰为类腐殖质特征峰, 荧光参数说明土壤淋溶液中DOM内源性突出; 地表水源土壤淋溶液DOM中的Feff值略高, 暗示其中含有更多活性基团。 相关结果可以为灌溉过程土壤碳素的流转归趋和生态效应提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|