作者简介: 王玲玲, 女, 1994年生, 中国科学院西北高原生物研究所博士研究生 e-mail: m15565477168@163.com
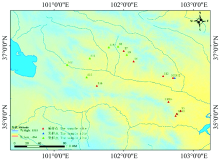
无机元素与药材的药效密切相关, 其通过对次生代谢途径中各种酶活性的调节作用而影响中药中次生代谢产物的合成, 是中药质量控制不可或缺的特征参数。 为有效鉴别蒙古黄芪产地和品质差异, 找出蒙古黄芪的特征元素及其与产地的关系。 实验采用电感耦合等离子体发射光谱(ICP-OES)测定青海省不同产地蒙古黄芪无机元素的种类与含量, 分别用SPSS 22.0和R包对数据进行聚类分析和主成分分析。 测定了黄芪中的12种元素, 主成分分析结果显示Ca, Fe, Li, P, K, Mg, Zn, AL, Na元素为蒙古黄芪的特征元素。 聚类结果表明不同产地的蒙古黄芪样品中无机元素的种类和含量与产地有一定的关联性, 当欧氏距离为8时, 可聚为三大类, S12为一类, S1, S2, S4, S5, S6, S7, S10, S11, S13, S16聚为一类, 其余的产地聚为一类, 结合ArcGIS样点分布图, 可更为直观地看出产地与其品质的关系。 此外, 建立了蒙古黄芪中无机元素的分布特征图谱, 不同产地蒙古黄芪无机元素特征图谱相似度均为0.996以上, 因此可结合指纹图谱对不同产地的蒙古黄芪进行识别分析。 从无机元素含量的主成分分析结果来看, 产于S10(互助县东沟乡纳卡村)的黄芪质量最优, 总因子得分值F最高, 其次是S7和S8, 可见, 互助县整体蒙古黄芪的品质较好。 结果表明蒙古黄芪具有丰富的矿物元素, 其含量受产地影响, 关注药材中元素的含量和种类, 不仅是对药理成分的补充说明, 更能从元素角度进一步揭示其品质优劣, 研究结果为蒙古黄芪的资源开发利用及品质鉴定提供参考依据, 为蒙古黄芪的质量安全控制提供保障。
Mineral elements are closely related to the efficacy of traditional Chinese medicine. They affect the synthesis of secondary metabolites by regulating the activities of various enzymes in the secondary metabolism pathway, which is an indispensable characteristic parameter for the quality control of traditional Chinese medicine. In order to effectively identify the quality differences of Astragalus membranaceus, the characteristic elements of Astragalus membranaceus and their relationship with the region were found out. The species and contents of mineral elements in Astragalus membranaceus from different areas in Qinghai Province were determined by ICP-OES. The data were analyzed by cluster analysis and principal component analysis (PCA) with SPSS 22.0 and R package respectively. 12 kinds of elements in Astragalus membranaceus were determined. The results of PCA showed that Ca, Fe, Li, P, K, Mg, Zn, AL, Na were characteristic elements of Astragalus membranaceus; the clustering analysis results showed that the types and contents of mineral elements in the samples were related to the producing area. When the Euclidean distance was 8, the samples could be clustered into three categories: S12 was clustered into one group, S1, S2, S4, S5, S6, S7, S10, S11, S13, S16 could be clustered into one category, the other samples were in one group. Combining with the distribution map of ArcGIS, the relationship between producing area and its quality can be seen more intuitively. In addition, the distribution characteristics of inorganic elements in Astragalus membranaceus were established. The similarity of the characteristics of inorganic elements in Astragalus membranaceus from different areas was more than 0.996. Therefore, the fingerprint can be used to identify and analyze Astragalus membranaceus from different areas. From the results of PCA of element content, the quality of Astragalus membranaceus produced in S10 (Naka village, Donggou Township, Huzhu county) was the best, the total factor score F was the highest, followed by S7 and S8, which showed that the quality of Astragalus membranaceus in Huzhu county was good. The results show that Astragalus membranaceus is rich in mineral elements, and its content is affected by the place of production. Paying attention to the content and types of elements in the medicinal materials is a supplementary explanation of the pharmacological components and can further reveal the quality from the perspective of elements. The results provide a reference basis for the development and utilization of resources and quality identification of Astragalus membranaceus and provide a guarantee for quality and safety control it.
蒙古黄芪(Astragalus membranaceus)属于豆科黄芪属多年生草本植物, 是我国传统常用的大宗中药材之一。 黄芪的药用历史悠久, 最早出现在《神农本草经》, 被列为上品。 《中国药典》(2015)表明, 黄芪具有补气升阳、 固表止汗、 化瘀通痹、 扶毒促肌等作用[1], 由于其独特的药效, 临床应用十分广泛[2]。 毛蕊异黄酮葡萄糖苷和黄芪甲苷为主要的化学活性成分, 被《中国药典》(2015)列为黄芪质量控制的指标成分。 目前, 野生黄芪资源匮乏, 为解决市场和行业需求, 市场上以人工栽培的速生芪为主, 其中栽培黄芪资源量最大, 占总资源80%以上[3]。 因此, 分析其品质对加强对蒙古黄芪资源开发和利用具有一定的应用和理论价值。
近些年, 在元素医学兴起和生物无机化学迅速发展的背景下, 人们越来越重视对中药中无机成分的研究[4]。 雷连娣等通过Logistic回归分析, 中药材黄芪中无机元素含量与海拔、 经度、 纬度、 坡度以及坡向关系密切[5]。 研究表明, 山西、 内蒙古、 甘肃等地的黄芪药材中元素含量表现出地域性差异[6]。 锌、 铜、 锰、 镁等元素可能是影响当归真伪的最主要无机元素, 从元素角度证明当归的道地性成因[7]。 因此, 明确蒙古黄芪中无机元素的组成, 分析研究不同产地栽培黄芪药材中无机元素的分布规律对其综合开发具有现实意义。 目前对黄芪的研究偏重于有机成分, 而对同省份内不同产区黄芪无机元素含量的区域性差异研究较少。 本研究收集了青海省不同产地栽培的蒙古黄芪样品, 采用等离子发射光谱(ICP-OES)测定黄芪药材中12种矿物元素含量, 并对其进行主成分分析和聚类分析, 从元素角度阐明不同产地黄芪品质差异的原因, 以期为黄芪的药效开发、 资源可持续利用和质量安全控制提供科学依据。
Optima 8000电感耦合等离子体发射光谱仪(美国Perkin Elmer公司); 工作参数: 雾化气流0.55 L· min-1, 射频功率1.3 kW, 辅助气流量0.2 L· min-1, 冷却气流量 15 L· min-1, 进样量1.5 mL· min-1。
供试品由青海省18个黄芪药材产地采集, 每个产地采集10个样品, 清洗、 晒干、 粉碎后将该产地10份样品粉混匀后备用, 共18个样品。 原植物经中国科学院西北高原生物研究所周国英研究员鉴定, 均为两年生栽培蒙古黄芪(Astragalus membranaceus (Fisch.) Bge.var.membranaceus (Bge.) Hsiao)。 样品产地信息见表1。
| 表1 样品采集地信息 Table 1 The information of sample sites |
精密称取样品0.200 g, 置于聚四氟乙烯微波消解罐中, 加入硝酸10 mL, 浸泡过夜, 加盖密封, 置于微波消解仪中消解。 待消解完全后, 开盖, 将消解罐置于赶酸器中加热赶酸, 设置温度180 ℃, 时间1.5 h。 待酸赶尽, 转移至50 mL容量瓶中定容, 然后转移至PE塑料液体瓶中标记, 待测。 同法同时制备空白溶液。
用Execl对数据进行整理, 采用R语言对数据进行主成分分析。 采用SPSS 22.0对数据进行聚类分析。 采用Origin对不同产地蒙古黄芪无机元素含量进行绘图比较。
不同产地蒙古黄芪中无机元素含量测定结果, 见表2。 结果显示, 12种无机元素中含量最高的是K, 其均值达到9 598.620 mg· kg-1。 Al, Ca, Fe, Mg, Na, P元素含量较高, 而Cu, Mn, Sr, Zn元素含量较低。 Li元素含量最低, 平均值只有0.330 mg· kg-1。 Cu属于重金属元素, 其在各样品中的含量值均不超过20 mg· kg-1, 符合药典规定。
| 表2 元素含量测定结果及指纹图谱相似度分析 Table 2 Content and Similarity analysis of distribution characteristics of inorganic elements |
不同产地之间的元素含量存在差异, 比如Al元素在各产地样本中的含量范围为42.638~767.008 mg· kg-1, Fe元素含量范围为14.221~1 000.230 mg· kg-1, Na元素含量范围为6.479~1 088.654 mg· kg-1。 结果表明不同产地间的蒙古黄芪由于土壤、 气候及当地管理措施而造成品质的差异。 即使同是一个县内的蒙古黄芪, 其元素含量波动差异也很大, 比如Al元素在民和县5个产区的差异范围是45.136~767.008 mg· kg-1, 互助县的差异范围是42.638~160.730 mg· kg-1, 湟中县的差异范围是75.795~289.263 mg· kg-1。 表明同一县内可能由于不同的栽培管理措施而造成蒙古黄芪无机元素含量的差异。
根据元素测定结果, 筛选出12种共有元素(Al, Ca, Cu, Fe, K, Li, Mg, Mn, Na, P, Sr和Zn)建立蒙古黄芪无机元素特征指纹图谱, 如图1(a, b)所示。 黄芪中各元素含量虽有差异, 但在后期鉴别过程中可根据元素分布特征曲线的变化趋势进行鉴别。 根据角余弦法计算相似度(表2)结果显示, 除乐都区芦化乡本康岭村的S12相似度值为0.797, 其余产地的药材样品均大于0.996。 说明蒙古黄芪无机元素指纹特征图谱的相似度较好。
主成分分析采用降维的思想对多个指标进行综合分析, 提取出一些潜在的综合指标来代替原来更具可观察性的指标来描述每个个体[8], 作为一种更为合理、 客观、 可靠的统计方法, 对不同地区中药质量评价的选择具有实际应用价值[9]。 采用R语言对18个产地的蒙古黄芪无机元素进行主成分分析, 以主成分特征值> 1、 累积贡献率> 80%为参考, 前3个主成分的累积方差贡献率达81.42%, 能够代替12种无机元素来评价不同产地蒙古黄芪无机元素的差异。 Ca, Fe, Li, P在第一主成分中占有较大贡献率, 方差贡献率为48.87%; 第二主成分的代表元素是K, Mg, Zn, 方差贡献率为21.73%; 第三主成分代表元素是Al, Ca, Na, 方差贡献率为10.82%。 表明, 不同产地之间这些元素存在差异, 因此可知Ca, Fe, Li, P, K, Mg, Zn, AL, Na是导致不同产地蒙古黄芪内在差异的特征元素。
从表3可知, 按总因子得分值F进行排序, 从无机元素角度, 互助县东沟乡纳卡村排名第一, 其次是互助县林川乡许家村、 互助县南门峡镇卷槽村, 可见互助县蒙古黄芪的综合品质较优。 民和县甘沟乡峡门村、 民和县满坪镇清泉村排名靠前, 而其他民和三个地方的排名靠后, 说明民和县内分布的蒙古黄芪品质差异较大。 大通县朔北乡白崖村黄芪品质排名第四, 但其采样点只有一个, 不足以代表大通县整体蒙古黄芪的品质优劣, 有待进一步研究。
| 表3 不同产地蒙古黄芪的综合评价 Table 3 Comprehensive evaluation of Astragalus membranaceus from different habitats |
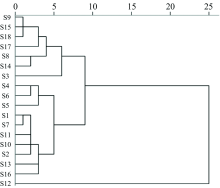
聚类分析是一种客观评价中药来源的新方法。 以组间连接法为组群合并准则, 采用SPSS对不同产地蒙古黄芪无机元素进行样本系统聚类分析, 结果见图2。 当欧式距离为4时, S12单独聚为一类; S3单独聚为一类; S4, S5和S6单独聚为一类; S8, S9, S14, S15, S17和S18聚为一类; S1, S7, S10, S11, S2, S13和S16聚为一类。 当欧式距离为8时(图3), 聚为三大类, 用红点表示S1, S2, S4, S5, S6, S7, S10, S11, S13和S16; 绿点表示S3, S8, S9, S14, S15, S17和S18; 蓝点表示S12。 这表明同一产区的蒙古黄芪无机元素与含量既有一定的关联性, 又有一定的差异存在, 可能与当地栽培方式和田间管理不同有关。
电感耦合等离子体发射光谱以高灵敏度、 检出限低、 分析速度快等优点, 被广泛应用于医药、 食品、 冶金、 环保等领域, 是无机元素分析的重要工具[10]。 本工作采用ICP-OES法、 主成分分析法和聚类分析法研究了不同产地黄芪中无机元素的差异, 将12种无机元素简化为3个主成分, 并依次对18个产地的蒙古黄芪进行综合评价, 结果显示青海省不同产地蒙古黄芪的无机元素存在差异, 而且有同种元素在不同产地的含量差异范围很大。 根据蒙古黄芪不同产地12种共有元素, 建立其无机元素指纹图谱, 为科学、 准确地判别和评价黄芪药材质量提供了研究基础。 主成分分析结果筛选出蒙古黄芪主要的特征元素是Ca, Fe, Li, P, K, Mg, Zn, AL, Na。 从元素角度分析, 互助县的蒙古黄芪综合品质较优, 民和县的蒙古黄芪品质差异较大。 聚类分析结果显示, 民和县的五个产区分别聚为三类, 可见差异较大, 这可能与当地栽培管理措施有关。
无机元素不仅影响植物的生理活动, 而且是药材的有效成分之一, 不同药材中元素分布特征不同[11]。 本研究结果显示黄芪中K, P, Ca和Mg含量相对较高, 与蒙古黄芪的药效是一致的。 K元素与黄芪降血糖作用有关[12], P, Ca和Mg元素与黄芪提高免疫力、 镇静作用有一定关系[13]。 在植物生长发育过程中, 土壤通过植物根系为植物生长提供必需的养分。 不同产地的蒙古黄芪无机元素差异最主要的原因可能是土壤差别造成的。 其次, 不同地区的光照时间和强度、 气候、 施肥和降水等生态环境因素对中草药的元素含量有直接影响。 这也证实了药用植物矿质元素的地域性特征, 即异地栽培会产生“ 质同效异” 的结果。 因此可以通过对无机元素的种类和含量测定, 并结合药材活性成分, 进行药材溯源, 从而为保障药材质量和安全提供参考依据, 同时为蒙古黄芪道地性形成机制研究提供新思路。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|