作者简介: 唐 乾, 女, 1978年生, 大连大学生命科学与技术学院副教授 e-mail: tangqian@dlu.edu.cn
在生命体内有关电子转移的研究备受关注, 其中蛋白质以及酶之间的电子转移研究已成为热点, 目前有关光诱导血红素蛋白还原的详细机理尚不明确, 电子转移也许是解释这一机理的有效途径。 通过紫外-可见吸收光谱、 稳态荧光光谱和圆二色等光谱系统地研究了体外近生理溶液环境中, 不同的紫外定波长、 pH、 游离氨基酸、 谷胱甘肽、 咪唑对Cyt b5光照还原的影响, 以阐明Cyt b5不能用传统提出的机制去解释的光还原机制。 结果表明: 在近紫外区通过直接的光激发高铁细胞色素b5 (Cyt b5)可以使其被还原成亚铁Cyt b5, 经过分析发现了Cyt b5被光还原的机制和促进条件。 用280 nm单色光照射Cyt b5溶液, 发现随着光照时间的延长, Cyt b5溶液紫外-可见光谱中Soret带由412 nm红移到421 nm, Q带556 nm处吸收峰逐渐增强。 Cyt b5被光照后发生了类似化学还原剂作用的还原反应, 同时发现了不同的光照波长、 不同的pH、 氨基酸种类以及各种其他配体等存在下对Cyt b5的还原程度影响不同。 采用280 nm波长、 在偏碱性条件下光照Cyt b5时还原程度最强; 溶液中加入谷胱甘肽和咪唑能通过提供电子和氢供体途径促进Cyt b5的光照还原反应发生; 溶液中游离Met的存在能以最大速率促进光照还原反应的发生。 基于以上结果提出Cyt b5光还原的机理是从卟啉环到三价铁的电子转移, 通过280 nm激发形成卟啉π阳离子基团和亚铁。 采用稳态荧光光谱和圆二色谱对Cyt b5光照还原发生前后进行检测, 发现光诱导蛋白发生还原后, Cyt b5主链结构逐渐伸展, 二级结构发生了一定改变, α-螺旋含量逐渐降低, β-折叠含量逐渐升高, 但是整个Cyt b5的二级结构仍以α-螺旋为主。 该研究结果不仅对了解光对含血红素蛋白(酶)的结构和功能的影响有重要的理论和实践意义, 而且对于生命体内的氧化还原反应和电子传递机制提供一定理论依据。
The study of electron transfer in life has attracted much attention, and the research on the electron transfer of proteins and enzymes has become a hot spot. However, electron transfer may be an effective way to explain this mechanism. The detailed mechanism of photoinduced heme protein reduction is still unclear. In this paper, UV-visible absorption spectroscopy, steady-state fluorescence spectroscopy and circular dichroism spectroscopy were used to study the effects of different UV wavelengths systematically, pH, amino acids,Glutathione and Imidazoleon the photoreduction of Cyt b5 in vitro near-physiological environment to clarify the photoreduction mechanisms of Cyt b5 which wasn’t proposed by the traditional methods. The results show that ferric cytochrome b5 can be photoreduced to the ferrous state by direct photoexcitation in the near-ultraviolet region. In this study, we studied the mechanism and facilitating conditions for photoreduction. Based on the sort band blue-shifted of 412 nm and absorbance intensity increase of Q band 556 nm, Cyt b5-FeⅢ in phosphate-buffered was photoreduced to Cyb5-FeⅡ similar to the action of a chemical reducing agent occurs. Considering that the fixed wavelength, pH values, amino acids and ligands of photoreduction were irradiated by 280 nm light, Cyt b5 had the strongest reduction degree. Under 280 nm alkaline conditions, Cyt b5 had the strongest reduction degree; glutathione and imidazole promoted the photoreduction reaction by providing electron and hydrogen donors; free Met in solution promoted the photoreduction reaction at the maximum rate happened. The photoreduction mechanism of Cyt c was intramolecular electron transfer, including the formation of porphyrin cation radical as an active intermediate excited by 280 nm light. In addition, results of fluorescence and CD spectra indicated that the protein-peptide chain structure, while the secondary structure of the protein changes, α-helix content decreased, β-sheet content increased.However, the secondary structure of Cyt b5 is still dominated by α-helix in the photoreduction process. Moreover, it provides a theoretical basis for the redox reaction and electron transfer mechanism in life.
电子的有效和受控运动是生物学的主要调控机制之一, 对生物体的存在至关重要[1]。 电子转移反应(electron transfer, ET)在生物系统功能中起着关键的作用[2, 3, 4]。 例如, 在光合作用中心, 光子激发和随后的电荷转移是生命过程的驱动力。
细胞色素b5(Cytochrome b5, Cyt b5)是一种与膜结合约18.6 KD的低分子蛋白, 由约133个氨基酸残基组成, 主要在高等动物肝细胞内质网膜中富集, 其功能主要是在电子传递中传递电子, 例如, Cyt b5可以接受来自NADPH-细胞色素P450还原酶[5, 6]和NADH-细胞色素b5还原酶[7]的电子, 并且可以将它们转移到许多电子受体蛋白质, 两者都是氧化还原受体。 如细胞色素c和天然受体[8], 细胞色素P450[9], 血红蛋白[10], 高铁肌红蛋白等。 这种电子传递一直是广泛研究的课题, 但Cyt b5协助电子传递的具体机制尚未完全阐明。 光还原似乎可以阐明蛋白质内的电子传递途径。 许多学者通过光激发辐射样品测定其紫外-可见吸收光谱, 研究血红素蛋白和金属卟啉的光还原反应。 国外文献报道大多集中在外源供体不存在的情况下, 血红素蛋白(如细胞色素c和细胞色素P450)的光还原。 周华伟等[11, 12]发现光诱导metMb还原的机理为光诱导分子内电子转移, 光照还原程度因入射光波长而异, 低温、 碱性有利于metMb的光照还原。 Bartocci等声称血红素轴向配体通过提供一个电子并将其转移到血红素铁中, 使铁原子还原。 但Ozaki等观察到铁配体电荷转移带的光激发不诱导光还原。 有研究认为, 芳香族氨基酸, 特别是色氨酸, 是有助于电子的转移[13]。 有报道研究了Cyt c光还原的波长依赖性, 在芳香族氨基酸吸收的光子能量范围内测定固定波长254 nm的光还原效率。 然而, 从该数据中并未得出光还原效率的波长依赖性是否遵循Cyt c中色氨酸和酪氨酸的光学吸收。 共振拉曼光谱同样可用于研究血红素蛋白质光还原, 但血红素光还原的详细机制仍然是难以捉摸的。
Cyt b5的代谢功能和结构特性已经被广泛研究, 但是关于这种细胞色素改变氧化态的机制的实验信息却很少。 因此本实验运用紫外-可见吸收、 荧光和圆二色光谱法系统地研究了溶液中不同的紫外定波长、 pH、 氨基酸、 谷胱甘肽对Cyt b5光照还原的影响, 以阐明Cyt b5还不能用传统提出的机制去解释的光还原机制。
试剂: 含牛肝微粒体细胞色素b5水溶性片段基因质粒由美国西北大学Hoffman教授惠赠; 蛋清溶菌酶和Ampicillin(购于Sigma公司); BL21-DE3感受态细胞(购于宝生物有限公司); 酵母提取物和蛋白胨(购于OXOID公司); DEAE SepharoseTM CL 6B(购于GE公司)、 SephadexTM G-100(购于Amersham公司)、 其他试剂均为分析纯; 实验用水为超纯水。
仪器: V-560紫外-可见分光光度计(日本Jasco公司); RF-6000荧光分光光度计(日本岛津公司); J-810型圆二色谱仪(日本Jasco公司)。
(1)细胞色素b5蛋白溶液的获得[14]。
转化(将含Cyt b5外源基因质粒通过热击转化至大肠杆菌BL21-DE3感受态细胞中)→ 筛选阳性克隆(选取在含Amp+的LB固体培养基上生长的红色菌落)→ 菌体培养和收集(含Amp+的LB液体培养基培养20~24 h后, 4 ℃、 5 000 r· min-1、 10 min离心收集菌体备用)→ 蛋白获取(菌体经溶菌酶和超声裂解、 透析、 DEAE-CL-6B和Sephadex G-75柱层析、 最后收集、 浓缩)→ 纯度鉴定, 最终得到纯度在96%以上的Cytb 5蛋白浓缩液→ -196 ℃液氮保存。 Cyt b5浓度测定: 根据摩尔消光系数ε 412=117 mM-1· cm-1[14], 采用朗博-比尔定律进行定量分析。
(2)UV-Vis吸收光谱
Cyt b5溶解于pH7.4, 0.05 mol· L-1的PB缓冲液进行测定。 还原态Cyt b5溶液为加入0.25 mol· L-1 Na2S2O4获得。 扫描波长: 220~700 nm, 扫描速率: 200 nm· min-1, 取三次实验平均结果等。
(3)荧光光谱测定
Cyt b5溶解于pH 7.4, 0.05 mol· L-1的PB缓冲液进行测定。 扫描波长范围: 290~450 nm, 扫描速率: 200 nm· min-1, 累计三次取平均结果。
(4)圆二色谱(CD)
Cyt b5溶解于pH 7.4, 0.05 mol· L-1的PB缓冲液进行测定。 扫描范围: 190~250 nm, 光径: 1 mm, 扫描速度: 50 nm· min-1, 取3次平均结果。
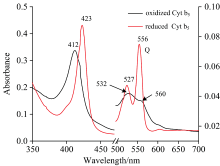
Cyt b5蛋白电子传递功能的完成通过其活性中心的血红素中心铁的价态变化来实现, 实验结果见图1。 Cyt b5-FeⅢ 的特征吸收峰波长为412, 532和560 nm, 还原态的Cyt b5-FeⅡ 的特征吸收峰波长423, 527和556 nm。 实验前对Cyt b5进行UV-Vis光谱表征(图1), 可知样品Cyt b5主要以氧化态形式存在。 光谱显示了350~700 nm范围内的三个吸收带, 412, 560和532 nm。 随后用Na2S2O4还原, 产生红线所示的吸收光谱。 还原形式的Soret带红移11 nm, Q波段峰强度增加峰位置发生移动, 在527和556 nm处形成两个吸收峰, 说明以氧化态形式存在的Cyt b5被还原。
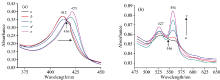
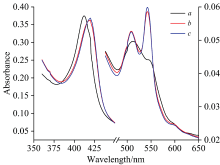
图2(a)和(b)为氙灯分出的280 nm单色光照射Cyt b5溶液的紫外-可见吸收光谱。 随着光照时间延长, Cyt b5的Soret带412 nm处吸收峰强度逐渐降低并红移到421 nm处, 其Q带532和560 nm处吸收峰强度降低, 最终在527和556 nm形成新吸收峰, 同时在416和546 nm附近出现两个等吸收点。 与图3中的结果比较可发现Cyt b5在280 nm氙灯光照后吸收光谱图与化学还原后的谱图变化趋势一致。 向Cyt b5样品中加入不同浓度的Na2S2O4溶液, 充分反应2 min后UV-Vis光谱表明, Cyt b5样品412 nm处的特征吸收峰强度随着Na2S2O4溶液浓度的增加而逐渐降低并红移至423 nm[图3(a)], 其Q带532和560 nm处的特征吸收峰逐渐增强[图3(b)]。 当加入过量Na2S2O4时, 其Q带527和556 nm吸收峰不断增强, 最终在416和546 nm附近出现两个等吸收点。 UV-Vis光谱表明在室温条件下光照Cyt b5可产生与上述化学还原过程类似现象。 光照还原Soret带峰位置未达最终还原态423 nm, 归因于少量的蛋白质发生变性。 即使在光还原Cyt b5中加入还原剂Na2S2O4其峰强度仍然比直接化学还原Cyt b5的还原峰强度要小(数据未列出)。
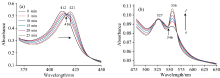 | 图2 Cyt b5光照前后的UV-Vis吸收光谱图 (a): 光照前; (b): 光照后Fig.2 UV-Vis absorption spectra of Cyt b5 with/without irradiation at 280 nm (a): Before illumination; (b): Upon illumination ccyt b5=5× 10-6 mol· L-1 |
爱因斯坦光子理论阐述: 光能量与波长呈反比; 而物质结构不同, 会吸收不同波长的光。 为了探究波长对Cyt b5光照还原的影响, 实验选用氙灯分出的不同定波长(254, 280, 412和423 nm)照射Cyt b5溶液25 min。 经不同波长光照射后, Cyt b5的Soret带412 nm处特征吸收峰强度均降低并红移, 其Q带527和556 nm处的特征吸收峰有明显增强。 在不同的波长光照射下, 随着光照时间延长527和556 nm处吸收峰强度发生变化, 但变化的趋势不同。 其中280 nm光照射时527和556 nm吸收峰强度增加的趋势最大, 即还原产物Cyt b5-FeⅡ 最多。 图4(a— d)分别为四种波长光照射Cyt b5对还原影响程度, 280 nm> 254 nm, 412和423 nm对光照还原没有影响。 由此说明Cyt b5被紫外光诱导还原, 还原程度并非与光照射能量成正比。 Cyt b5分子中有1个 Trp、 4个Tyr和3个Phe残基。 280 nm光照引起的还原反应现象最明显的原因是280 nm波长光易被Trp吸收。 光子被Trp大量吸收形成激发态, Trp通过激发能量传递至铁卟啉基团激发态, 进而引发光氧化过程。 280 nm光能被大量吸收, 能量比较高, 因此比254 nm更有利于光照氧化。 分析认为, 412、 423 nm不是芳香族氨基酸的特征吸收峰, 能量比较低, 难以激发铁卟啉基团至激发态, 与Consani 等[15]提及的Trp在肌红蛋白Trp-to-Heme能量传递过程中起重要作用的结论相吻合; 另一方面, 这些波长引发的还原速率非常慢, 氧气可能会泄露到样品中, 从而阻止蛋白质发生光还原。
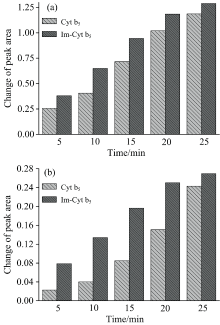
Cyt b5蛋白在不同的pH缓冲溶液中显示不同的价态和构象。 研究了pH为5.4, 6.4, 7.4, 8.0和9.0缓冲溶液中的光还原情况。 在pH为5.4缓冲溶液中, 基线有明显的漂移现象, 为了分析数据的准确性, 采用峰面积对pH作图分析。 如图5(a, b)所示分别在五个不同pH条件下, 280 nm光照对Cyt b5光还原的影响。 光照前, 560 nm处吸收峰面积随着pH的升高而略微增加, 但Soret带的特征吸收峰位置仍在412 nm处, 说明Cyt b5未发生还原反应; 光照25 min后, 随着pH由酸性到碱性的变化, Cyt b5溶液的Soret带和Q带的吸收峰面积逐渐增加, 实验范围内, 即pH值越大越容易发生光还原反应。 分析认为光还原过程中会产生部分H+, 碱性条件下OH-会中和部分H+, 因此Cyt b5在偏碱性条件下易于发生光照还原。
谷胱甘肽(GSH)在所有生物细胞中存在, 其还原性的巯基有很强的供电子能力, 可参与体内重要的氧化还原反应。 GSH的巯基有微弱的还原性, 黑暗条件下不会直接与蛋白相互作用, 采用氙灯280 nm光激发卟啉后, GSH开始参与反应并对Cyt b5的还原反应起促进作用。 光照作用明显提高了GSH的还原能力(见图6)。 GSH巯基(— SH)上的S原子带有孤电子对, 可以提供电子给FeⅢ , 当Cyt b5被光照后形成激发态的高铁血红素辅基, 电子从卟啉环转移到中心铁原子上形成亚铁血红素辅基阳离子自由基, S原子提供电子给亚铁血红素辅基, 促进了亚铁Cyt b5的形成。 以上结果表明GSH和卟啉均非光照氧化还原过程中的氧化剂或者还原剂, 类似于叶绿素光反应过程, 它们都是电子传递的“ 中间人” , 整个反应是卟啉、 GSH和铁之间的能量和电子传递过程, 此链式超快电子转移过程是在溶液中光激发铁卟啉和GSH后进行的。
图7中从Soret和Q带峰强度和峰位置可以判断出, 未加入Met时其Soret带峰位置没有发生明显变化仍为412 nm, 但是其峰强度有小幅度的下降, 其Q带在566 nm形成一个微弱的小峰; 加入Met时其Soret带峰位置发生明显改变由412 nm红移到420 nm处, 其Q带556 nm处形成一个非常明显的还原峰。 通过比较可以确定Met对光照还原有非常好的促进作用。 分析认为Met在Cyt b5被光照还原过程中产生的· OH自由基产物被Met清除, 进而促进了光照还原速率的提升[16]。
取2 μ L 0.02 mol· L-1的咪唑溶液于2 mL Cyt b5蛋白溶液中黑暗中放置30 min, 测其紫外-可见吸收光谱, 发现谱图基本没有发生变化。 图8(a, b)分别为Cyt b5在光照射前后其412和556 nm处峰面积的变化图, 由图8可知: 咪唑可促进Cyt b5光还原反应的发生。 咪唑加入Cyt b5蛋白溶液后, 可以作为光还原电子供体促进光照还原反应的进行。 咪唑的五元芳杂环中含有两个间位的氮原子, 与组氨酸结构类似可结合血红素, 其1-位氮原子的未共用电子对参与环状共轭, 导致氮原子的电子云密度有所下降, 从而1-位氮原子上的氢易以H+形式离去。 咪唑残基上的给电子基团对还原速率具有显著促进作用。
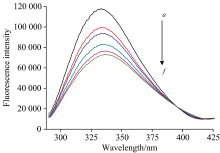
为了进一步了解连续UV光照射对蛋白质构象方面的影响。 图9为280 nm照射25 min的Cyt b5前后荧光发射光谱图。 Cyt b5的333 nm是最大发射波长, 主要由生色氨基酸残基如Trp, Tyr和Phe周围环境变化引起[16]。 随着光照时间的延长, 经280 nm单色光照射后的Cyt b5在~333 nm处的荧光发射强度降低了38%, 且最大发射波长红移到了336 nm。 表明Cyt b5芳香族氨基酸的微环境发生了改变。 Trp22(Trp位于蛋白一级结构第22位)和Cyt b5的血红素可以发生较强的能量转移过程, Trp的疏水环境遭到破坏, 亲水性越强, 能量越低[17], 即连续280 nm照射25 min后, Cyt b5中Trp的疏水区更加暴露于极性的水环境中。 这种三级构象的改变也可能是由于蛋白质二级结构的改变而引发的[18]。 由紫外可见光谱的确可以发现Cyt b5中有部分蛋白发生变性。
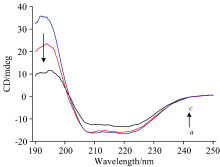
Cyt b5的CD谱(350~700 nm)能够揭示蛋白质二级机构变化的信息[19]。 如图10所示208和222 nm是Cyt b5 α -螺旋结构的特征峰, 随着光照时间的延长Cyt b5的CD谱图发生变化, 208和222 nm处负峰振幅明显减弱, CD谱图的峰强度发生一定变化, 但是形状和肩峰的位置未发生明显改变。 部分α -螺旋转变成β -折叠, 说明随着Cyt b5光照还原的发生, 蛋白质内部疏水残基基团的不断暴露, 与荧光光谱结果一致, 光照过程导致Cyt b5二级结构发生了一定改变, 但是整个Cyt b5的二级结构仍以α -螺旋为主, 说明光照时间内Cyt b5蛋白未完全变性。
利用多种光谱学技术对光照射Cyt b5还原反应的依赖性和机理进行了探究。 结果表明: 选定氙灯280 nm波长光照射下的Cyt b5溶液被还原, 且随着光照时间的延长, 还原程度越强。 选定波长280 nm光照射, 偏碱性条件利于Cyt b5的还原; Met、 GSH和咪唑的存在均能促进还原反应。 荧光光谱以及圆二色光谱结果表明, Cyt b5被光诱导还原后, 蛋白主链结构更加伸展, α -螺旋含量降低, β -折叠含量升高, 但是整个Cyt b5的二级结构仍以α -螺旋为主, 说明光照时间内Cyt b5蛋白未变性。 Cyt b5被光还原的机理为从卟啉环到三价铁的电子转移, 通过280 nm激发形成卟啉π 阳离子基团和亚铁。 以上的实验结果对于光诱导血红素蛋白质结构和功能的研究, 具有重要的理论意义和实践价值。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|