作者简介: 胡耀强, 1989年生, 广东海洋大学海洋与气象学院讲师 e-mail: yaoqiang.h@163.com
白酒是深受消费者喜爱的一种日常含酒精饮品, 酒精度是衡量其品质的关键指标之一。 简单、 快速的酒精度分析方法有助于提升白酒的检验效率。 光谱法具有响应快速、 无损分析的优点, 可为酒精度的分析提供较好的帮助。 水分子对红外光具有较好的吸收效果, 基于此特征探究了利用近红外光谱间接分析白酒中酒精度的方法。 研究发现光程对水和乙醇分子的紫外-可见-近红外吸收光谱有影响, 水分子在1 448 nm附近有一个独立的吸收峰, 此吸收峰在光程10 mm条件下出现突跃, 但当光程降低为1 mm时, 峰形变为对称且平滑状态, 可用于定量分析。 乙醇水溶液在1 000~1 800 nm范围内的吸收峰随着乙醇含量的增大呈规律性递减, 乙醇和水分子间的作用力未对二者的吸收光谱产生显著影响。 提取1 448 nm处的吸光度, 得出吸光度与酒精含量的线性方程: A=1.38-0.013 m%( R2=0.996 7), 酒精度低于20%或高于80%时的拟合效果存在较大的相对偏差。 20%~80%范围获得拟合效果优良的线性拟合方程: A=1.40-0.014 m%( R2=0.999 3)。 并通过购置的部分市售散装白酒和品牌瓶装白酒检验了该方法的可靠性, 本方法对品牌瓶装白酒的检测与瓶身标记的酒精度的相对偏差较小, 符合吸收光谱的允许误差范围, 而对部分散装白酒的检测结果与其标注的酒精度相差较大, 鉴于散装白酒在品质控制方面弱于品牌瓶装白酒, 在一定程度上说明本方法在检测白酒酒精度方面具有较好的准确度, 且具有方便、 快速、 无需辅助试剂、 线性范围宽的优点, 可作为一种快速分析白酒酒精度的测试手段。
Alcohol is a key technical indicator of liquor, a favorite of consumers as a daily drinking. A simple and fast detection method for ethanol in liquor can help to improve the efficiency of a liquor inspection. Spectroscopy with the advantages of rapid and non-destructive can provide help for the analysis of ethanol content. Based on the good absorption effect of water molecules on infrared light, this paper explored the feasibility of indirect analysis of ethanol content in liquor by near-infrared spectrophotometry. By studying the effect of the optical path on the UV-VIS-NIR absorption spectra of water and ethanol, it is found that water molecules have an independent absorption peak at 1 448 nm. This absorption peak has a mutational point under the optical path of 10 mm. However, when the optical path is reduced to 1 mm, the shape of the absorption peak becomes symmetric and smooth, bringing the possibility of quantitative analysis. The absorption peak of aqueous ethanol solution in the range of 1 000~1 800 nm regularly decreases with the increase of ethanol content. It shows that the force between ethanol and water molecules do not affect their absorption spectrum. The linear equation between absorbance and alcohol content is obtained: A=1.38-0.013 m% ( R2=0.996 7) by extracting the absorbance at 1 448 nm. However, the fitting effect has a large relative deviation when the alcohol content is lower than 20% or higher than 80%. A better linear fitting equation with an excellent fitting effect is obtained: A=1.40-0.014 m% ( R2=0.999 3) after adjusting the fitting range to 20%~80%. The reliability of this method was tested through some purchased bulk and brand liquors. The results obtained by this method show a small relative deviation with the alcohol content marked on brand bottles, which is within the allowable error range of absorption spectrum analysis. Moreover, there are large relative deviations in the test measurement results of part of bulk liquors, which may be caused by the weaker quality control of bulk liquor. To some extent, this method has good accuracy and precision in detecting the alcohol content of liquor. This method has the advantages of convenience, rapid, no auxiliary reagent and wide linear range. It can be used as a test method for quickly analyzing the alcohol content of liquor.
中国白酒历史悠久, 品种众多, 国人尤爱高浓度白酒。 粮食经蒸煮、 糖化、 发酵、 蒸馏、 勾兑得到不同酒精度的白酒, 香型和酒精度是其主要的理化指标, 带来不同的品质和口感。 目前酒精度的测量方法主要参考国标中的酒精计法和密度法, 随着现代分析仪器的发展, 气相色谱法、 近红外光谱等被应用于测量[1]。 其中气相色谱依靠自身优异的分离性能, 结合质谱等仪器能够分析白酒中的主要成分和微量成分[2, 3, 4], 但在快速测定酒精度方面效率偏低。 近红外光谱法具有分析快速、 设备要求低、 无损分析、 无需辅助试剂和载气等特点, 可实现白酒酒精度的快速测量。
近红外光频率介于可见光和中红外光之间, 波长处于780~2 526 nm之间。 近红外吸收光谱特征可以反映O— H, N— H, C— H等含氢基团的信息, 用于有机分子的定性和定量分析。 因此, 近红外光谱被广泛应用在食品、 医学、 环境等领域物质的分析[5, 6]。
根据白酒中主要成分乙醇和水的紫外-可见-近红外吸收光谱的特征, 考察光程、 酒精含量对吸收光谱的影响。 结合水和乙醇近红外吸收光谱的差异, 采用分光光度法间接测量白酒中乙醇含量, 并选取部分市售白酒作为样品检验此方法的准确性和精确度。
乙醇(分析纯)购自天津市富宇精细化工有限公司, 散装市售白酒和品牌酒, 实验用水均为一次去离子水。
紫外-可见分光光度计, PerkinElmer Lambda 750(波长扫描范围: 190~3 300 nm)。
配制不同质量百分比的乙醇水溶液, 选用光程分别为1, 2和10 mm的石英比色皿, 以空比色皿为背景, 扫描溶液在200~3 000 nm范围内的吸收光谱。
购置不同酒精度的散装白酒和常见品牌瓶装白酒, 扫描吸收光谱, 并根据1 448 nm处吸光度和白酒酒精度与酒精质量比的换算式(1)计算酒精含量
式(1), V%为体积百分数, W%为重量百分数,
水分子具有非常显著的红外吸收, 因此尝试利用近红外光对水进行定量分析。 首先, 使用最为常用的光程为10 mm的石英比色皿, 扫描水分子在200~3 000 nm范围内的吸收光谱, 发现水分子在1 200~3 000 nm范围内存在明显的吸收信号。 其中1 300~1 700 nm是一个独立于1 700~3 000 nm范围的独立吸收带, 由于吸光系数非常强, 此吸收带中大部分范围的吸光度已超过10, 为无效值。 为此, 更换更短光程的石英比色皿, 通过扫描吸收光谱, 在1 300~1 700 nm扫描到一个形状较为理想且吸光度值在合适范围内的近红外吸收峰, 如图1所示。 该峰的极大值对应波长为1 448 nm, 此波长下不同光程时水的吸光度见表1。 此吸收峰是水分子中O— H的反对称和对称伸缩振动吸收峰, 也可以是O— H和氢键的第一倍频区[7]。 Kang Jun采用2 mm光程扫描水的吸收光谱, 得到1 448 nm附近的吸收峰吸光度已大于2.5, 高于分光光度计的测量最佳范围。 且我们在使用2 mm光程扫描水的吸收光谱时, 发现2 mm光程在1 449 nm处存在一个吸光度的突变值, 吸光度突增至3.192, 这对后续的定量分析造成较大干扰。 而当使用1 mm光程的比色皿进行光谱扫描时, 水分子在1 448 nm处的吸光度值降低至1.403, 相比较而言, 吸光度进入到一个更加合适的范围内, 且吸收峰的峰形平滑, 对称性较好。 尽管水分子的摩尔吸收系数仅为0.253 L· mol-1· cm-1, 远低于携带不饱和键的分子中π → π * 跃迁的摩尔吸收系数[8, 9], 但恰好适宜水溶液中水含量的定量分析。
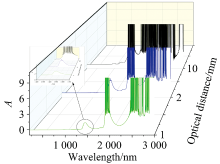 | 图1 光程对水的紫外、 可见、 近红外光谱的影响Fig.1 Effect of optical distance on ultraviolet-visible-near infrared spectral images of water |
| 表1 不同光程下水在1 448 nm波长处的吸光度 Table 1 Absorbances of water at 1 448 nm with different optical distances |
为考察水分子该吸收峰应用在白酒中酒精含量的定量分析的可行性, 采用1和10 mm光程扫描无水乙醇的吸收光谱。 从图2中可以看到, 在10 mm光程条件下, 乙醇分子在1 800~3 000 nm范围内存在一条宽且强的近红外光吸收带, 且吸光度超过有效值, 无法用于乙醇的定量分析。 但在1 000~1 800 nm范围内, 存在两个明显的吸收峰, 其中1 650~1 850 nm的吸收峰发生分裂, 不适宜用于定量分析。 而1 250~1 650 nm的吸收峰峰形较好, 1 448 nm处的吸光度为1.330。 当采用1 mm光程比色皿获取无水乙醇的吸收光谱时, 上述两处吸收峰吸光度明显降低, 1 448 nm处的吸光度降低至0.116(表2), 远低于同一波长下水的吸光度。 因此, 可以采用1 mm光程、 1 448 nm波长处的吸光度对乙醇水溶液尝试进行定量分析测试。
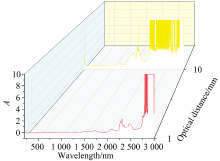 | 图2 光程对乙醇的紫外、 可见、 近红外光谱图的影响Fig.2 Effect of optical distance on ultraviolet-visible-near infrared spectral images of ethanol |
| 表2 不同光程下乙醇在1 448 nm波长处的吸光度 Table 2 Absorbances of ethanol at 1 448 nm with different optical distances |
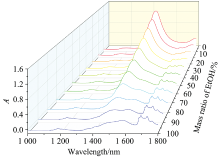
配置不同质量比的乙醇溶液, 扫描溶液在1 000~1 800 nm范围的近红外光谱, 绘制出图3, 可以看出系列溶液的光谱曲线呈现出规律性递变。 当溶液中水含量较多时, 光谱曲线以水分子的吸收曲线特征为主。 随着乙醇含量的逐渐增大, 光谱曲线向乙醇分子吸收特征曲线过渡。 这在一定程度上说明乙醇与水的分子间相互作用力并未对彼此的近红外吸收光谱特征产生显著影响。 这一系列溶液在1 448 nm处的吸光度随着其中水的质量比呈现均匀递变。 因此, 可利用此处吸收峰尝试间接定量分析白酒等乙醇溶液中的酒精含量。
从表1和表2中可以看出水的摩尔吸光系数远大于乙醇的摩尔吸光系数, 乙醇水溶液在1 448 nm处的吸光度主要由水分子贡献。 将图3中不同质量比的乙醇水溶液的吸光度列于表3中, 溶液的吸光度整体均处于合适范围内。 并采用线性拟合方程对吸光度与乙醇质量比之间的相关性进行分析, 结果如图4所示。 当全部浓度范围均纳入线性拟合方程, 所得线性方程为A=1.38-0.013m%(R2=0.996 7)。 从拟合曲线图和相关性系数可以看出, 1 448 nm处吸光度与乙醇水溶液中含水量具有很好的的线性相关。 但当乙醇含量大于80%时, 拟合曲线明显偏离测定的吸光度[图4(a)]。 中国白酒的度数多处于20%~80%之间, 采用此区间的吸光度进行重新拟合, 得到了相关性更高、 拟合效果更好的线性方程: A=1.40-0.014m% (R2=0.999 3)[图4(b)]。
| 表3 不同质量比乙醇水溶液在1 448 nm波长处的吸光度 Table 3 Absorbances of ethanol aqueous solutions with different mass ratios at 1 448 nm |
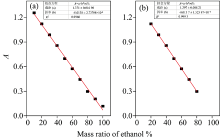 | 图4 乙醇水溶液在1 448 nm处吸光度拟合曲线 (a): 0~100%; (b): 20%~80%Fig.4 Absorbance fitting curves of ethanol aqueous solutions at 1 448 nm (a): 0~100%; (b): 20%~80% |
从拟合效果看, 酒精含量在20%~80%区间内, 酒精水溶液在1 448 nm处的吸光度和酒精含量呈良好的线性负相关关系。 为检验该方程的可靠性, 采用式(2)和式(3)计算本方法的检测限
式中, σ 为标准偏差; S为拟合曲线斜率, μ为吸光度平均值。
由表4中乙醇吸光度的六次平行测量结果和式(3)计算得出乙醇的测量标准偏差σ 为4.7× 10-5, 结合式(2)得出乙醇的检出限为0.011。 分光光度法的灵敏度与目标分子的摩尔吸光系数成反比[10]。 因水和乙醇无法发生类似染料分子内部的π → π * 跃迁[11, 12], 水和乙醇在1 448 nm处的摩尔吸光系数分别仅为0.253和0.067 8 L· mol-1· cm-1, 使该方法的灵敏度远低于测定染料。
| 表4 乙醇吸光度的六次重复测量结果 Table 4 Absorbance values of ethanol obtained by measurement repeated 6 times |
不同的中国白酒往往通过不同的谷物和酿造工艺酿制而成, 因此含有不同类型的有机物[1, 13, 14, 15], 其中的芳香分子可以发生π → π * 跃迁, 可能会对本方法测定白酒酒精度带来干扰, 因此需要扫描其吸收光谱分析这些微量有机物对本方法带来的干扰。 购置部分市售散装白酒和品牌瓶装白酒, 扫描得到它们的UV-VIS-NIR吸收光谱, 如图5(a)和(b)所示。 部分白酒样品在200~300 nm范围的吸收光谱曲线存在明显不同, 这可能是样品中多种有机物分子共同作用的结果。 但这十种测试样品在1 300~1 700 nm范围内的吸收光谱的峰形相似且峰值相同, 无干扰峰出现, 表明白酒中多种微量的有机分子并不会干扰本方法对白酒酒精度的测试。
 | 图5 部分市售品牌(a)和散装(b)酒的紫外-可见-近红外吸收光谱Fig.5 Absorption spectra of some brand liquors (a) and bulk liquors (b) |
为进一步检验本方法的可靠性, 提取样品吸收光谱在1 448 nm处的吸光度, 结合线性拟合方程和式(1)反推样品酒精度, 结果如表5所示。 品牌白酒的测试酒精度与标注酒精度相对偏差普遍偏小, 散装白酒的相对偏差较大, 考虑到可能受到散装白酒品质控制不足的影响。 这在一定程度上表明本方法在测定白酒酒精度方面具有较好的可靠性。
| 表5 校验样本的预测结果 Table 5 Predicted results of verified sample |
通过研究光程对于水、 乙醇吸收光谱的影响, 利用水在1 300~1 700 nm范围内的近红外吸收峰, 探究了近红外分光光度法间接定量测定白酒中乙醇含量的可靠性。 通过线性拟合得到了相关性非常好的线性方程: A=1.40-0.014m% (R2=0.999 3)。 本方法线性范围宽、 检测限低, 基本涵盖市售白酒的酒精度范围, 但灵敏度略低, 不足以分析白酒中微量有机物。 由于水分子的摩尔吸收系数较低, 该方法不适合乙醇及其他水溶液中微量水的测定。 整体而言, 本方法在测量白酒酒精含量方面具有样品需要量少、 无需添加任何辅助试剂、 无需稀释、 分析速度快的特点。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|