作者简介: 方 平, 1994年生, 吉林农业大学中药材学院硕士研究生 e-mail: 2502891316@qq.com
杨 鹤, 女, 1983年生, 吉林农业大学中药材学院实验师 e-mail: he612@163.com
方 平, 杨 鹤: 并列第一作者
主要针对不同光质对人参种苗叶片生长影响的研究, 从而探究人参工厂化育苗的优良光质, 为提高种苗质量提供基础依据。 试验设置六组处理, 分别为白光(W, 作为对照)、 蓝光(B, 450~470 nm)、 红光(R, 625~655 nm) 、 绿光(G, 510~530 nm)、 黄光(Y, 585~605 nm)、 红蓝光(RB, R/B=4:1), 白光作为对照光源。 试验结果表明, 不同光质下生长的人参种苗叶片在外观形态、 生理特性和细胞结构上都显现明显的差异。 在叶面积的生长过程中, 红蓝光和白光下的叶面积较大, 红光次之, 蓝光下最小; 在叶绿素含量的分布中, 添加蓝光的处理组明显高于对照组, 说明蓝光对叶绿素的合成有关键作用, 红光下叶绿素含量最低, 表明红光不利于叶绿素的合成。 蓝光、 黄光和白光下叶绿素荧光电子效率较高, 而在气孔特性上, 绿光、 红光和白光的气孔数量较多, 单个气孔面积蓝光和红蓝光下较大。 通过电镜下叶片超微结构的观察发现, 不同光质对叶片的细胞结构产生了明显的影响, 主要表现在线粒体和叶绿体的分布以及叶绿体的结构上, 其中白光和蓝光照射下的线粒体和叶绿体数量较多, 叶绿体片层结构垛叠数上也更紧凑丰富。 另外, 不同光质下生长的幼苗叶片衰老进程也产生了明显的差异, 蓝光、 红蓝光照射下衰老速度较快。 综上所述, 不同光质对于人参种苗叶片生长的影响各不相同, 蓝光和红蓝复合光照射具有较多的优良性状和较好的生理参数, 因此在应用和实践上还需要根据具体的需求制定相应的光质配比策略, 以达到壮苗丰产的目的。
FANG Ping and YANG He: joint first authors
The present study is mainly aimed at studying the effect of different light quality on the growth of ginseng seedling leaves, to explore the excellent light quality of ginseng factory seedlings, and provide a basis for improving the quality of ginseng seedlings. The experiment set up six groups of treatments, namely white light (W, as a control), blue light (B, 460~480 nm), red light (R, 615~635 nm), green light (G, 510~530 nm), yellow light (Y, 585~605 nm), red and blue (RB, R/B=4:1), white light as the contrast light source. The study results showed that the leaves of ginseng seedlings grown under different light qualities had obvious changes in appearance, physiological characteristics and cell structure. In the process of leaf area growth, the leaf area under red, blue and white light is larger, next is red light and the smallest under blue light. In the distribution of chlorophyll, the treatment of adding blue light is significantly higher than the control, indicating the Blue light plays a key role in the synthesis of chlorophyll. Moreover, it is the lowest under red light. The electron efficiency of chlorophyll fluorescence is higher under blue, yellow and white light. In terms of stomata characteristics, there is more stomata numbers in green, red and white light, and the area of a single stomata is larger under B and RB light. Through observation of leaf ultrastructure under an electron microscope, it is found that different light qualities significantly impact the cell structure of leaves, mainly in the distribution of mitochondria and chloroplasts and the structure of chloroplasts. White light and blue light have more mitochondria and chloroplasts, and the number of stacks of chloroplast lamella structure is also more compact and rich. In addition, the senescence process of the seedling leaves grown under different light quality also had obvious differences. The B and RB treatment senescence speeds were fast. In summary, different light qualities have different effects on the growth of ginseng seedling leaves, but blue light and red-blue composite light have more excellent characteristics and better physiological parameters. However, in application and practice, it is also necessary to formulate corresponding light quality ratio strategies according to specific needs to achieve the purpose of strong seedlings and high yield.
光是影响植物最重要的生态因子之一, 它对植物生长的影响主要体现在光质、 光强和光周期三个方面, 植物会随着这三个方面环境光条件的改变而作出相应的生物响应。 光质量比光的强度和光周期更复杂地参与植物的形态和生理反应[1]。 已有研究表明, 不同光质的光对植物影响广泛, 不仅影响植物萌芽[2], 根、 茎、 叶的生长[3, 4, 5], 叶片衰老[6], 还影响基因表达[7]以及次生代谢[8]等。 在已有的光质对植物生长发育影响的研究中, 各实验所关注的光谱波段不尽相同, 光质的处理方式也各异。 各实验中不同光质对植物影响效应的结果不完全相同, 甚至得出相反的结论, 这可能归因于光质处理方式、 植物材料、 植物生长时期和环境条件如光辐射的不同。 随着光电技术的迅速发展, 作为辅助光的发光二极管(light-emitting diode, LED)技术已经被引入植物保护栽培方面, 并且已显示出巨大的进步。 有研究发现黄瓜在100B(100%蓝光)处理下地上部干重和叶面积最大, 而番茄则是在25B处理下最大; 有研究表明刺五加在蓝光下叶绿素含量上升而在红光下叶绿素合成受到抑制。 植物种类以及植物对不同光质效率的差异为人工调节光谱合理栽培植物提供了科学依据和研究方向。
人参(Panax ginseng C.A.Meyer)为五加科人参属多年生宿根性草本植物, 具有滋补强壮、 补气养血等多种功效, 产地主要分布于朝鲜、 前苏联及中国东北地区的森林地带。 人参是喜阴凉气候的药用植物, 常生长于林下环境, 对光照条件有严格的要求, 因此人参生长光环境的研究对于人参高产稳产以及改变种植方式具有重要意义。 目前, 人参光照环境领域已经有颇多研究, 如研究人参在不同光质环境下的光合特性, 并认为在低光强下, 蓝光和红光的光合作用和光合效率最高; 魏帛轩等研究发现人参在红蓝光补光下光合作用效果最好[9]。 本工作有针对性地使用LED光质来提高人参产品质量和产量[10]。
具备LED光源的植物工厂可以提供高精度和标准化的人参种苗用于种植, 而研究植物对光质量的响应以设计植物工厂的照明特征来优化种苗培育, 对于提高种苗质量和节省能源有重要意义。 本工作通过比较不同光质下人参种苗叶片的生理特性和超微结构, 研究不同光质对人参种苗生长发育的影响。
人参种子来自吉林省吉林市永吉县吉林农业大学人参种植基地, 选取大小一致的人参种子进行试验。 不同光质的LED植物灯购自广东省宸华照明有限公司。
试验在吉林农业大学温室培育基地的LED光照培养室内进行, 供试材料为人参种子培育的一年生种苗。 人参种子于2021年3月22日播种在育苗盘内(6× 6× 10, 长× 宽× 高), 每个育苗盘内播种三粒种子, 培养基质为蛭石:草炭土:有机土(2:4:4)。 待长至叶片将要展开时, 移入6种不同LED光源下培养, 分别为白光(W, 作为对照)、 蓝光(B, 450~470 nm)、 红光(R, 625~655 nm) 、 绿光(G, 510~530 nm)、 黄光(Y, 585~605 nm)、 红蓝光(RB, R/B=4:1), 白光作为对照光源。 调节光源与幼苗的距离, 使光量子密度在各处理组中保持一致, 均调至100 μ mol· m-2· s-1。 每个处理组设置三次重复, 每次重复100株幼苗。 培养条件: 白天温度(25± 2) ℃, 晚上温度(20± 2) ℃。 光照时间14 h· d-1。
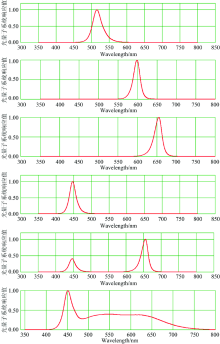
LED光源系统由广东宸华照明有限公司制造, 光谱分布如图1(a— f)所示。
光质处理60 d后, 每个处理随机取20株幼苗用直尺测定每片叶片的长和宽, 叶面积使用WindDIAS 图像分析系统测量。 叶绿素含量用无水乙醇-丙酮法测定。
叶绿素荧光使用OS5-FL调制式叶绿素荧光仪(美国Opti2science公司)测定其荧光参数。 选取正常生长的叶片, 进行暗适应40 min。 然后进行测定。 根据测定数据, 进行以下计算
计算出可变荧光Fv, 式(1)中可变荧光和最大荧光之比(Fv/Fm)被称为PSⅡ 的最大光化学效率。
PSⅡ 有效光化学量子产量(yield)=(F'm-Fs)/F'm (2)
通过PSⅡ 的相对电子传递速率(ETR)
式(3)中, I为入射到叶面的光强; a为叶片吸收光的比例, 通常为84%; f为光能在PSⅡ 分配的比例, 在C3植物中通常为50%。
| 表1 不同光质的光谱峰值波长 Table 1 Spectral peak wavelengths for different light qualities |
气孔特性的观察: 每个处理随机选取3株植株, 选取人参掌状复叶中间小叶进行观察, 先用脱脂棉蘸水轻轻擦拭叶片上、 下表皮以去灰尘。 30 min后, 在下表皮中部靠近主脉的两侧快速涂上一层薄薄的透明指甲油, 待风干结成膜后, 用透明胶带的载玻片压在叶片上, 然后轻轻剥下叶片, 使指甲油印膜粘在透明胶带上, 用中性树胶封片, 制成临时片, 在正置荧光显微镜下观察, Leica显微摄影系统拍照, 采用LAX软件进行气孔大小和气孔面积的测量。
叶片超微结构观察处理方法: (1)固定取材1 mm3组织若干块, 立刻固定到2.5%戊二醛24 h, 把固定液倒掉入PBS缓冲液中6 h, 切片组织加入1%锇酸后固定2 h; (2)脱水30%乙醇10 min, 50%乙醇10 min, 70%乙醇醋酸铀(包埋前染色)3 h或过夜, 80%乙醇10 min, 95%乙醇15 min, 100%乙醇两次50 min, 环氧丙烷30 min; (3)浸透环氧丙烷1:环氧树脂1, 2 h, 纯环氧树脂3 h; (4)纯环氧树脂包埋后入45 ℃烤箱12 h, 72 ℃烤箱24 h; (5)取出包埋块修块后超薄切片(片厚70 nm, 切片机型号为leica UC-7)铜网捞片; (6)电子染色(铅染色); (7)拍照: 用日本电子透射电镜拍照。
对照组与处理组的数据定量为均值± SE, 并进行方差分析(ANOVA), p≤ 0.05认为存在显著差异, 以上数据采用SPSS 22和Origin 2018b软件进行统计分析和绘图。
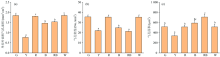
图2表明, 不同光质影响了人参幼苗叶片的形态发育和叶绿素分布, 并且差异明显。 在叶长和叶宽中, 不同光质对叶长和叶宽的影响呈现了一致的变化。 红光明显高于其他几种光处理和对照, 其次是对照和红蓝复合光处理, 对叶长和叶宽影响最小的是蓝光和黄光。 从叶面积来看, 与对照白光相比, 蓝光和黄光有明显的抑制叶片延伸的作用。 与相关报道结果一致, 发现增加蓝光比例对烟草叶面积的增加有明显的抑制作用, 增加红光比例, 叶片的长、 宽和叶面积与白光相比无显著差异。 根据在不同光质对烟草叶片生长上的影响来看, 黄光处理下的叶长叶宽叶面积指数较白光低, 也低于其他处理组, 也与本试验结果一致。 从图1结果可以看出, 添加红光可以有效解除蓝光对叶片延伸的抑制效果。 从图3(a)可以明显看出, 蓝光、 黄光、 绿光照射叶片影响较小, 红光照射叶片较长, 白光, 红蓝复合光照射的叶片较大, 并且黄光下叶片展叶迟缓, 在光照处理三十天时, 还尚未完全展叶。 从图3(b)可以看出, 叶片生长角度也有差异, 红光向上延伸, 并带有卷曲, 叶片生长异常, 垂直角度最大, 红蓝光次之, 而蓝光叶片几乎水平生长, 由此可以看出, 不同光质对人参叶片的延伸角度是有影响的。 另外, 从株型来看, 白光、 红蓝光、 和蓝光下的幼苗株型紧凑, 更为健壮。
 | 图3 不同光质处理30 d时的叶片形态和株型Fig.3 Leaf morphology and plant after 30 days of different light quality treatments |
光合色素是接受和转化光能的基础, 对植物生长有重要作用。 图2(d— g)表明了不同光质下人参叶片中叶绿素a、 叶绿素b、 叶绿素a/b和总叶绿素的分布情况。 由图可见, 不同光质对叶绿素a、 叶绿素b、 叶绿素a/b和总叶绿素的影响呈现了几乎一致的变化规律, 即蓝光下色素含量最大, 红蓝复合光和白光次之, 绿光和黄光下色素含量较小, 红光下色素含量最低。 从图3(a)中可以明显看出不同光质下的叶片颜色深浅不一, 蓝光下的叶片绿色最深, 红光下颜色最浅。 根据有关报道在一品红的研究中发现, 蓝光下叶绿素含量较高, 这与本实验的结果一致。 Jang等[1]通过研究不同比例红蓝光下种苗的叶绿素含量发现, 单色蓝光下最大, 而单色红光下含量最小, 也与本试验的结果一致, 说明蓝光对于叶绿素的启动合成具有主导作用。
从图4(a, c)可以看出, ETR、 PS(Ⅱ )的变化规律相同, R、 RB处理两组的值明显较小, 远远低于其他组和对照, 而B、 Y、 W处理三组的值明显大于其他组, 说明B、 Y、 W三组处理的PSⅡ 光合电子传递效率较高, 叶片捕获和利用光的能力强。 RB、 R两组处理下qN值较大, 说明这两组光质处理下叶片PSⅡ 热耗散大, 光能利用率低。 相关研究发现正常植物Fv/Fm比值在0.75~0.85之间, 但在逆境条件下, 这一效率值明显降低。 本试验Fv/Fm在R、 RB处理下较低[见图4(b)], 均低于0.75, 说明R、 RB光下处理的幼苗叶片受到胁迫, 光合电子传递效率降低, 而B、 Y、 W三组处理下Fv/Fm较高, 表明在B、 Y、 W三种光质处理下叶片的潜在量子效率高。
 | 图4 不同光质对幼苗叶片荧光特性的影响Fig.4 The effect of different light quality on the fluorescence characteristics of seedling leaves |
不同光质下生长的人参幼苗叶片气孔特性如图5(a, b, c)所示。 Y光处理下的气孔密度、 气孔面积、 单位叶面积气孔面积都较小, 说明光合速率小, 光合能力弱, 从图3(a, b)可以看出, 植株株型细长弱小, 生长迟缓。 G、 R、 W三种光处理下, 气孔密度、 单位叶面积气孔面积变化规律相同, 并且每个处理之间没有显著性差异, 但是显著高于其他三种处理, 说明这三种光处理下的叶片气体交换能力强。 RB、 B两种光处理下的叶片气孔面积较大, 但是气孔密度和单位叶面积气孔面积较小, 并且在实验中发现RB、 B两种处理下的气孔形态狭长, 开度较大, 说明单个气孔的气体交换效率高。
从图6可以看出, 在不同光质下处理的叶片呈现出不同的形态和深浅不一的颜色。 在处理120 d后, 黄光下的叶片绿色较深, 叶片幼嫩, 叶片狭长, 叶面积较小。 白光下的叶片绿色稍浅, 有泛黄的小斑点, 叶片厚而宽大。 红蓝复合光下的叶片只有靠近叶脉处的绿色较深, 有较多泛黄的大斑点, 叶片整体呈现黄绿色, 叶片健壮厚实宽大。 绿光下的叶片绿色很浅, 已经有部分区域泛黄枯萎, 叶片狭长, 薄而弱。 红光和蓝光下的叶片已经完全接近衰老期, 大部分已经泛黄, 只有很少的绿色部分, 并且在衰老时伴随叶面积的缩小, 可能是由于缩水导致。 另外, 蓝光的衰老期要早于红光。
图7是人参幼苗叶片在不同光质下处理120 d时的超微结构观察图。 由图7可以看出, 在120 d时, 不同光质处理下的叶片在内部超微结构上有显著的不同。 图W1, W2和W3是白光处理下的叶片细胞显微结构, 从图W1可以看出, 部分细胞结构完整, 叶绿体数量多, 近圆形, 其中淀粉粒较多, 细胞内线粒体丰富, 图W2中叶绿体结构完整, 淀粉粒较大, 出现少量嗜锇颗粒, 基质、 基粒片层结构完整, 但结构较松散, 说明叶绿体已经开始解离。 图W3是正在溶解的叶绿体, 大部分是淀粉粒, 叶绿体的片层结构已经溶解。 图Y1, Y2和Y3是黄光处理下的叶片细胞显微结构, 从图Y1中可以看出, 细胞结构完整, 但细胞体积较小, 叶绿体体积较大, 线粒体分布较少。 图Y2和Y3可以看出, 叶绿体饱满, 呈纺锤形, 靠近细胞壁, 被膜清晰完好, 基质基粒片层结构紧凑, 淀粉粒小而少, 出现少量嗜锇颗粒, 叶绿体功能区体积占比较大, 属于正常生长期, 未见溶解。 图R1, R2和R3是红光处理下的叶片细胞显微结构, 图R1表明, 红光下叶片细胞中的叶绿体少而小, 从图R2和R3中可以看出, 叶绿体基质基粒片层结构稀疏, 有少量淀粉粒和嗜锇颗粒出现, 部分叶绿体被膜溶解。 图RB1, RB2和RB3是红蓝复合光处理下的叶片细胞显微结构, 图RB1可以看出, 细胞内叶绿体数量较多, 体积大, 线粒体分布较多, 图RB2中可以看出, 叶绿体基粒片层分布较多, 基质片层较少, 结构松散, 嗜锇颗粒较多, 有少量淀粉粒, 图RB3是正在溶解的叶绿体, 只剩下少量的片层结构, 淀粉粒较大。 图B1, B2和B3是蓝光处理下的叶片细胞显微结构, 从图B1, B2和B3中可以看出, 蓝光下的叶绿体在处理120 d时已经几乎完全溶解, 细胞内只剩下大量的淀粉粒和少量残存的叶绿体组织, 叶片已经完全衰老。 图G1, G2和G3是蓝光处理下的叶片细胞显微结构, 图G1可以看出, 细胞内叶绿体数量多体积小, 有少量线粒体分布, 图G2和G3可以看出, 叶绿体内嗜锇颗粒较多, 淀粉粒数量多而小, 基质基粒片层结构不清晰, 垛叠结构较少而薄。 从以上结果可以看出, 不同光质对叶片细胞的显微结构产生了显著的影响, 其中, 白光和红蓝复合光下的细胞线粒体较多, 叶绿体形状规则, 体积较大, 数量较多, 故叶片生长较为健壮, 而红光、 黄光、 绿光下的细胞线粒体分布较少, 叶绿体形状多为纺锤形, 数量和体积较小, 片层结构松散, 垛叠结构较少, 这可能是叶片外观薄而弱小的原因, 但是从图中可以看出, 这三种光下的叶绿体结构完整, 衰老程度迟缓, 所以在处理120天时, 叶片看起来仍然嫩绿, 这在黄光下尤其明显。 蓝光下的叶片细胞衰老最快。 研究表明, 不同光质不仅影响叶片细胞内叶绿体和线粒体的数量分布和形状大小, 而且还影响叶片的衰老进程, 其先后顺序为B> RB> R> W> G> Y。
试验表明不同光质处理下的人参幼苗叶片在生理特性和显微结构上都产生了显著的变化。 在叶形态的生长发育过程中, 光质参与了叶片形态的塑造, 试验结果表明, 对照组和红蓝复合光有利于叶片的延伸生长, 这两种光处理下叶面积最大, 生长也较为健壮, 说明复合光有利于人参幼苗的生长发育。 而蓝光在叶片的生长中, 有抑制叶片生长的效果, 叶面积最小, 根据Herná ndez[11]等在黄瓜幼苗红蓝光配比的研究中发现, 蓝光比例越高, 黄瓜幼苗叶面积越小, 蓝光的这种效应与增加光强的效应类似, 光强越大, 叶片扩展受到抑制越强。 不同光质也影响了叶片中叶绿素的分布, 蓝光下的叶绿素含量明显高于其他处理, 说明蓝光对于叶片中叶绿素的合成有关键作用。 而红光的效应正好相反, 红光下的叶绿素含量最低, 有抑制现象。 叶绿素荧光参数表明叶片对于光能的转换利用效率, 从试验结果可以看出, B、 Y、 W三组处理在这些参数中表现较优, 气孔特性显示出叶片对于气体交换能力的大小, 在试验中发现, 在单位叶面积气孔面积和气孔密度上, G、 Y、 W三组处理数值较高, 说明气孔数量较多, 而单个的气孔面积却是RB处理下的最大, 说明红蓝复合光下气孔较大, 有利于气体交换。 不同光质对叶片细胞的显微结构均产生了显著的影响, 其中, 白光和红蓝复合光下的细胞线粒体较多, 叶绿体形状规则, 体积较大, 数量较多, 故叶片生长较为健壮, 而红光、 黄光、 绿光下的细胞线粒体分布较少, 叶绿体形状多为纺锤形, 数量和体积较小, 片层结构松散, 垛叠结构较少, 这可能是叶片外观薄而弱小的原因, 但是从图中可以看出, 红光、 黄光、 绿光下的叶绿体结构完整, 衰老程度迟缓, 这可能是由于植物对这三种光生长响应速度较慢导致。 研究表明不同光质不仅影响了叶片细胞内叶绿体和线粒体的数量分布和形状大小, 而且还影响了叶片的衰老进程。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|