作者简介: 颜康婷, 女, 1997年生, 华南农业大学电子工程学院、 人工智能学院博士研究生 e-mail: keeping_ykt@163.com
针对农业生产中阿维菌素过度使用造成的农作物农药残留超标问题, 利用JASCO FP8300荧光分光光度计对阿维菌素农药溶液进行荧光光谱检测, 分析阿维菌素原药溶液及制剂溶液的荧光光谱特征, 为实现阿维菌素的快速检测提供数据参考。 实验首先通过分析原药溶液和两种来自不同生产厂家的制剂溶液的三维荧光光谱, 对比荧光特征峰的位置异同, 判断阿维菌素荧光特征峰的区域为Ex=250~290 nm, Em=280~320 nm, 最佳激发波长为270 nm。 接着, 选定Ex=270 nm作为最佳激发波长对原药溶液及制剂溶液进行二维荧光光谱检测, 得到相应的二维荧光光谱数据。 根据光谱数据, 分析阿维菌素荧光特征峰处荧光强度值随着溶液浓度变化的规律, 将相关数据拟合, 得出关于阿维菌素荧光特征峰值与对应溶液浓度值的预测模型。 由数据分析结果得知, 阿维菌素原药溶液在10~35 mg·L-1浓度范围内预测模型的 R2为0.999, 预测结果的均方根误差RMSE为0.359 mg·L-1; 两种不同厂家生产的阿维菌素制剂溶液在10~35 mg·L-1浓度范围内预测模型的 R2分别为0.935, 0.985, 预测结果的均方根误差RMSE分别为1.945和0.858 mg·L-1。 实验表明, 制剂中其他填充剂及助剂等成分不会造成制剂中阿维菌素有效成分的荧光效应失效, 并且能够通过荧光强度值来反映阿维菌素的浓度, 进一步验证了利用荧光光谱对阿维菌素含量进行检测的可行性。
Excessive use of abamectin in agricultural production causes excessive crop pesticide residues. This study used a JASCO FP8300 fluorescence spectrophotometer to detect abamectin pesticide solution.The fluorescence spectrum characteristics of the abamectin technical solution and preparation solution were analyzed to provide a data reference basis for the rapid detection of abamectin. The experiment first analyzed the three-dimensional fluorescence spectra of the technical solution and two preparation solutions from different manufacturers. It is determined that the fluorescence characteristic peak area belonging to the abamectin is Ex=250~ 290 nm, Em=280~320 nm, and the best excitation wavelength is 270 nm. Therefore, 270 nm was selected as the best excitation band for two-dimensional fluorescence spectrum detection. According to the two-dimensional spectral data, the fluorescence intensity of abamectin fluorescence characteristic peak was analyzed with the change of solution concentration, and the prediction model of them was obtained by fitting relevant data. According to the results of data analysis, the R2 of the prediction model of abamectin technical solution was 0.999, and the root means square error (RMSE) of the prediction results was 0.359 mg·L-1 in the concentration range of 10~35 mg·L-1. Besides, the R2 of the abamectin preparation solution prediction model produced by two different manufacturers within the concentration range of 10~35 mg·L-1 were 0.935 and 0.985. Moreover, the root means square error (RMSE) of the predicted results were 1.945 and 0.858 mg·L-1. The results showed that the fluorescence effect of abamectin in the preparation could not be lost due to other fillers and additives. In addition, the concentration of abamectin could be reflected by the fluorescence intensity value, which further verified the feasibility of using the fluorescence spectrum to detect the content of abamectin.
阿维菌素属十六元大环内酯化合物, 是一种具有杀虫、 杀螨、 杀线虫活性的广谱性杀虫剂。 常用于防治果树红蜘蛛、 蓟马, 蔬菜菜青虫、 小菜蛾等虫害, 能达到较高的防治效果。 但阿维菌素的过度使用会造成农作物的农药残留量超标, 影响消费者身体健康及生态环境[1]。 因而, 实现对阿维菌素农药残留的快速检测对于保证农产品的食品安全和发展绿色农业具有重要的研究意义。 目前, 常用于阿维菌素农药含量检测的方法为高效液相色谱法(HPLC)、 液相色谱-串联质谱法(LC-MS)等[2]。 这些检测方法的灵敏度、 准确度高, 但前期处理复杂, 耗时长, 不利于实现对农产品农药残留的在线实时检测。 而荧光光谱分析具有选择性好、 灵敏度高、 检出限低的特点, 且其不需复杂的前期处理, 操作简单, 有利于实现对农作物农药残留的在线快速检测[3, 4, 5, 6, 7]。
本研究对阿维菌素原药溶液及两种来自不同生产厂家的阿维菌素制剂溶液进行荧光分析, 通过三维荧光光谱及相关Excitation Emission Matrix(EEM)数据, 分析原药及制剂溶液荧光特征峰区域。 通过获得的最佳激发波长, 扫描二维荧光光谱数据, 获得荧光强度值随溶液浓度变化的规律, 建立预测模型, 从而检验荧光分析对阿维菌素含量进行快速检测的可行性。
荧光扫描仪器: FP8300荧光分光光度计(日本JASCO); 纯水制备系统: Milli-Q Direct纯水/超纯水一体化系统(皇河仪器科技有限公司)。
阿维菌素原药(湖北康宝泰精细化工有限公司)采用一种即溶于水的有机化合物DMSO作为溶剂进行溶解得到母液, 再取不同量的母液加纯水稀释获得24个浓度梯度的阿维菌素原药溶液。 实验中使用两种来自不同生产厂家(制剂1: 河南勇冠乔迪农业科技有限公司、 制剂2: 河北中保绿农作物科技有限公司)的阿维菌素制剂, 剂型为乳油, 有效成分含量均为1.8%。 阿维菌素制剂通过不同比例的制剂: 纯水配比获得23个不同浓度的阿维菌素制剂溶液。 阿维菌素原药溶液及制剂溶液相关浓度配制如表1所示。
| 表1 阿维菌素原药及制剂溶液配制浓度梯度 Table 1 Concentration gradient of abamectin technical and preparation solution preparation |
实验中激发波长(Ex)扫描间隔为5 nm, 发射波长(Em)扫描间隔为10 nm, 每个样品重复扫描三遍取平均值; 进行荧光检测的具体步骤为: 超声波充分震荡溶液, 使用移液枪分别从不同阶梯浓度的阿维菌素溶液中吸取3 mL的溶液至10 mm× 10 mm× 42 mm的石英器皿中; 再将石英器皿置于荧光分光光度计中指定的位置; 操作JASCO Spectra Manager软件进行荧光光谱扫描获取EEM数据及二维荧光光谱数据。
三维荧光光谱具有独特的指纹性[8, 9, 10, 11], 为分析阿维菌素原药的荧光效应, 实验对6个阶梯浓度阿维菌素原药溶液(10, 15, 20, 25, 30和35 mg· L-1)进行三维荧光光谱扫描。 其中, 20 mg· L-1的阿维菌素原药溶液的三维荧光光谱图如图1所示。
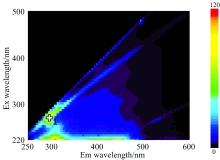 | 图1 20 mg· L-1阿维菌素原药溶液三维荧光光谱图 1: Ex/Em=270 /297 nm; Int.=111.772Fig.1 Three-dimensional fluorescence spectrum of 20 mg· L-1 abamectin technical solution 1: Ex/Em=270 /297 nm; Int.=111.772 |
从三维荧光光谱图及EEM数据分析可知, 6个浓度梯阿维菌素原药溶液在Ex: 250~300 nm, Em: 280~320 nm处出现荧光特征峰区域, 其中荧光峰1的激发波长均为Ex=270 nm。 因此, 选定Ex=270 nm作为阿维菌素原药溶液的最佳激发波长, 对6个阿维菌素原药溶液进行二维荧光光谱扫描, 相关数据如表2所示。 分析可知, 6个浓度梯度的阿维菌素原药溶液在Ex=270 nm, Em=297.5~298 nm处获得荧光峰特征峰值, 荧光强度值随着阿维菌素原药溶液浓度的增加而增强。 此结果与Ji等[12]在基于荧光光谱的水果汁阿维菌素残留检测的研究结果相近。
| 表2 阿维菌素原药溶液二维荧光光谱相关数据 Table 2 Two-dimensional fluorescence spectroscopy data of abamectin technical solution |
其中, 实验采用DMSO作为溶剂对阿维菌素原药母液进行配制, 为讨论DMSO的荧光效应, 对纯水及纯水+DMSO溶液进行三维荧光光谱扫描。 分析可得, 纯水荧光强度值为55.9, 纯水+DMSO的荧光强度值为54.5。 两种溶液的荧光强度值均小于阿维菌素原药溶液荧光强度值, 因而不会对实验分析造成影响。
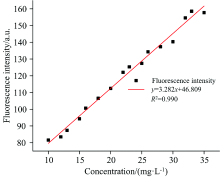
为进一步讨论阿维菌素荧光峰处荧光强度与溶液浓度的关系, 以Ex=270 nm为最佳激发波长对阿维菌素原药溶液校正集进行二维荧光光谱扫描, 获得发射波长范围为285~600 nm的发射光谱图。 利用Origin 2019b对阿维菌素原药溶液的浓度、 荧光强度相关数据进行线性回归拟合, 结果显示其皮尔逊相关系数r=0.995, R2=0.990, 拟合结果如图2所示。 由拟合结果可知, 利用Ex=270 nm作为最佳激发波长进行二维荧光光谱扫描, r=0.995, 说明阿维菌素原药溶液浓度可以解释利用最佳激发波段扫描得到的荧光特征峰值处荧光强度99.5%的变异性, 两者存在线性关系。
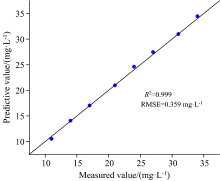
利用验证集对预测模型的预测精度进行检验, 采用origin 2019b对阿维菌素原药溶液验证集中的预测值及实测值进行线性拟合分析, 结果如图3所示。 拟合结果R2=0.999, RMSE=0.359 mg· L-1。 接近1的R2及较小的RMSE说明拟合效果良好, 表明该预测模型对于浓度范围10~35 mg· L-1内的阿维菌素原药溶液具有良好的预测精度, 能够通过荧光峰值处的荧光强度来反映对应的溶液浓度值。
2.2.1 阿维菌素制剂溶液荧光峰分布规律
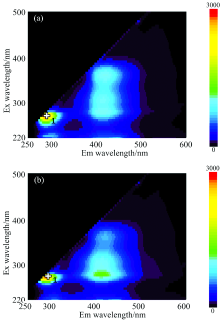
实验分别对两种阿维菌素制剂的三个阶梯浓度的溶液进行三维荧光光谱扫描(1∶ 2 100, 1∶ 1 000, 1∶ 650), 其中制剂: 纯水配比为1∶ 1 000的三维荧光光谱扫描结果如图4所示。
由图4可知, 阿维菌素制剂溶液三维荧光光谱图出现两个较明显的荧光特征峰区域(1: Ex=250~290 nm, Em=280~320 nm; 另一个区域在Ex=250~400 nm, Em=380~470 nm)。 对比可知, 荧光峰1与阿维菌素原药溶液三维荧光光谱中所出现的荧光峰1相似, 判断为阿维菌素有效成分的荧光效应。 而在另一个荧光特征峰区域在阿维菌素原药溶液的三维荧光光谱中并未出现, 认为是阿维菌素制剂中的其他成分, 填充剂或助剂所产生。 比较阿维菌素原药、 制剂溶液的三维荧光光谱可知, 制剂中的阿维菌素有效成分依然保持其荧光特性, 并产生了跟阿维菌素原药溶液相似的荧光峰1, 对应Ex均为270 nm。
2.2.2 阿维菌素制剂溶液荧光强度变化规律
以Ex=270 nm作为最佳激发波长分别扫描5个浓度阿维菌素制剂溶液(10.02, 15.45, 20.88, 24.64和32.16 mg· L-1)得到二维荧光光谱, 相关数据如表3所示。 分析可知, 随着阿维菌素制剂溶液浓度的增大, 荧光峰1荧光强度值呈负增长状态, 与阿维菌素原药中溶液浓度与荧光强度值的正相关关系不同。 查阅相关资料可知, 在进行溶液的荧光检测时会存在浓度效应[13], 其会造成内滤效应、 溶质间相互作用等现象从而影响溶液荧光强度。 经分析, 认为阿维菌素制剂溶液中出现的负增长趋势是由于溶液内滤效应引起。 即当溶液浓度过高时, 溶液中的杂质对入射光的吸收作用增强, 降低激发光的强度。 阿维菌素制剂溶液中除了阿维菌素有效成分外, 其余杂质成分较多, 因而阿维菌素有效成分浓度相当的原药溶液与制剂溶液相比, 制剂溶液的内滤效应会更加明显。
| 表3 阿维菌素原药溶液二维荧光光谱相关数据 Table 3 Relevant data of two-dimensional fluorescence spectroscopy of abamectin technical solution |
为进一步讨论阿维菌素制剂溶液浓度与相应荧光强度值之间的关系, 以Ex=270 nm为最佳激发波长对阿维菌素制剂溶液校正集进行二维荧光光谱扫描, 利用origin 2019b分别对两个校正集中15个样品的浓度及对应的荧光强度值进行拟合分析。
查阅资料, 溶液荧光强度的理论计算公式为: If=2.303YfI0ε bc。 其中If为荧光强度, Yf为物质的荧光量子产率, I0为入射光强度, ε 为摩尔吸光系数。 在一定的频率及强度的激发光照射下, 溶液荧光强度和溶液的浓度呈线性关系; 如果ε bc≥ 0.05时, 则荧光强度和溶液的浓度不呈线性关系, 应考虑幂级数中的二次方甚至三次方[13]。
对实验数据拟合: 制剂1进行二次多项式拟合分析, 制剂2进行线性拟合分析, 均符合关于溶液荧光强度的理论计算分析, 拟合结果如图5所示。 制剂1、 2的拟合结果R2分别为0.969和0.963, 表明模型的拟合结果较好, 制剂溶液浓度与对应荧光强度具有良好的相关性。
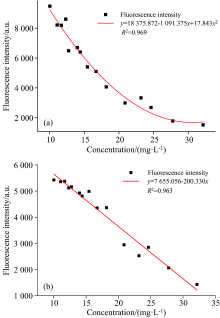 | 图5 阿维菌素制剂溶液拟合曲线 (a): 制剂1; (b): 制剂2Fig.5 Fitting curve of abamectin preparation solution (a): Formulation 1; (b): Formulation 2 |
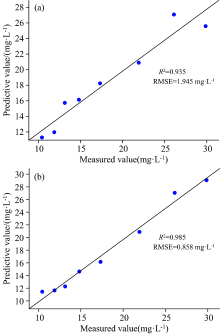
利用验证集中8个浓度梯度阿维菌素制剂溶液分别对两种制剂的预测模型的预测精度进行检验, 其分析结果如图6所示。 制剂1、 2验证集中预测模型的浓度预测值与实测值线性拟合结果分别为, R2=0.935, R2=0.985, RMSE=1.945 mg· L-1, RMSE=0.858 mg· L-1。 接近1的R2和较小的RMSE表明, 通过最佳激发波长Ex=270nm进行二维荧光光谱扫描获取相关数据进行预测模型建立, 利用预测模型对阿维菌素制剂溶液进行溶液浓度值预测具有较好的预测精度。
综合以上分析, 发现阿维菌素原药溶液及阿维菌素制剂溶液的三维荧光光谱图在Ex约为250~290 nm, Em约为280~320 nm区域内均出现了荧光特征峰区域。 在组分更为复杂的阿维菌素制剂溶液中阿维菌素有效成分仍然能表现出荧光效应, 但其会受到内滤效应的影响而呈现区别于阿维菌素原药溶液的变化规律; 阿维菌素原药及两种制剂溶液验证集中预测值与实测值线性拟合的R2分别为0.999, 0.935和0.985, RMSE分别为0.359, 1.945和0.858 mg· L-1, 具有较好的预测精度。
(1)阿维菌素原药溶液的三维荧光光谱图出现明显荧光峰1, 其荧光峰区域范围约为Ex=250~290 nm, Em=280~320 nm。 荧光峰1的峰值均在Ex=270 nm取得。 确定Ex=270 nm为阿维菌素的最佳激发波长, 此荧光峰区域为阿维菌素的荧光特征峰区域。
(2)阿维菌素制剂溶液的三维荧光光谱图出现两个明显的荧光峰区域(1: Ex=250~290 nm, Em=280~320 nm; 另一区域: Ex=250~400 nm, Em=380~470 nm)。 荧光峰1与阿维菌素原药溶液产生的荧光特征峰相近, 判断为制剂中阿维菌素有效成分产生的荧光效应。 另一荧光特征峰区域判断为制剂溶液中其他填充剂及辅助剂所产生的荧光效应。
(3)由阿维菌素原药溶液及两种不同生产厂家生产的阿维菌素制剂溶液所出现的相同荧光特征峰区域Ex=250~290 nm, Em=280~320 nm, 可以判断阿维菌素有效成分的荧光效应在组分更为复杂的制剂溶液中能够不被其他成分所掩盖。 以此荧光峰区域内的最大荧光强度与对应溶液浓度建立关系, 能够得到相应的预测模型。 本研究进一步验证了利用荧光光谱检测阿维菌素含量的可行性, 为实现农业生产中阿维菌素农药残留的快速检测提供数据参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|