作者简介: 张传英, 女, 1996年生, 天津大学生命科学学院硕士研究生 e-mail: zhangchuanying@tju.edu.cn
丹酚酸B(SAB)是丹参中主要的水溶性成分之一, 具有广泛的生物活性。 血清白蛋白是哺乳动物体内血浆中含量最为丰富的蛋白质, 约占血浆总蛋白的60%, 能与许多内源及外源性物质相结合, 发挥存储和转运的作用。 丹酚酸B进入人体后, 必然先与血液中的蛋白质相结合, 然后才被转运到其受体结合部位, 进而发挥其药理作用。 为更好地了解丹酚酸B在体内的分布、 转运及代谢, 在模拟生理条件下, 采用荧光光谱法、 圆二色光谱法和核磁共振波谱法等方法研究丹酚酸B与牛血清白蛋白(BSA)的相互作用机制。 结果表明: 丹酚酸B与牛血清白蛋白的结合能有效地导致牛血清白蛋白的内源荧光猝灭, 猝灭机制为以静态猝灭为主的联合猝灭方式。 荧光光谱分析表明两者的结合常数分别为7.51 ×105(288 K), 7.40 ×105(298 K)和5.57 ×105(308 K) L·mol-1, 达到105 L·mol-1数量级, 且随着温度的升高逐渐降低。 Scatchard方法确定牛血清白蛋白与丹酚酸B相互作用时结合位点数约为1, 说明两者之间可形成1∶1型非共价复合物。 位点标记竞争实验表明丹酚酸B在牛血清白蛋白亚结构域IIA(Site I)的疏水腔内相结合。 三维荧光光谱法和圆二色谱法实验结果显示, 结合丹酚酸B后牛血清白蛋白中色氨酸和酪氨酸所处的微环境发生了一定的变化(即峰位置发生红移, 色氨酸和酪氨酸残基周围微环境疏水性减小, 极性增强), 而二级结构和和三级结构的变化较小。 此外, 利用核磁共振波谱技术比较一定浓度的丹酚酸B在不同浓度的牛血清白蛋白溶液中的化学位移变化情况, 研究表明H5”和H6”所在的苯环在牛血清白蛋白与丹酚酸B相互作用过程中发挥着重要的作用。 该研究有助于了解丹酚酸B在机体内的作用机制以及对血清白蛋白结构和功能的影响, 为丹酚酸B类新药的研发提供一定的理论参考。
As the main water-soluble active ingredient from Salvia miltiorrhiza, salvianolic acid B (SAB) has a wide range of biological activities. Serum albumin is the most abundant protein in plasma (about 60%) and can bind with various endogenous and exogenous compounds, which can play a role in the storage and transport of compounds. When SAB enters into the human body, it must be combined with the protein in the blood system and then transported to its receptor site and played its pharmacological effects. Thus, in order to better understand the distribution, transport and metabolism of SAB in vivo, the interaction of SAB with bovine serum albumin (BSA) has been investigated using fluorescence spectra, circular dichroism (CD) and nuclear magnetic resonance spectra (NMR) under simulated physiological conditions. The results showed that the binding of SAB to BSA could quench the intrinsic fluorescence of BSA through the combined quenching mechanism (static and dynamic), but the static quenching was the primary one. The binding constant was 7.51×105 L·mol-1 (288 K), 7.40×105 L·mol-1 (298 K) and 5.57×105 L·mol-1 (308 K), respectively. It was found to be in the order of 105 L·mol-1 and decreased with the increasing temperature. The results of site marker competitive experiments indicated that SAB specifically bound to Site I of BSA in the hydrophobic pocket of sub-domain IIA. The stoichiometric ratio between BSA and SAB was calculated by using the Scatchard equation, and the result suggested that the SAB can form a 1∶1 type non-covalent complex with BSA. The three-dimensional fluorescence and CD studies indicated that SAB induced some microenvironmental changes of tryptophan and tyrosine in BSA. That was, the binding of SAB to BSA brought the tryptophan and tyrosine residues to a more hydrophilic environment, while the changes of secondary and tertiary structures of BSA were relatively small. Furthermore, the chemical shift of SAB at various concentrations of BSA was studied using NMR spectra, and the results showed that the benzene ring of H5” and H6” in SAB played a vital role in the binding process during the BSA-SAB complexation. This research will be helpful for understanding the mechanism of SAB in vivo and the influence of the binding of SAB to the conformation and function of serum albumin in biological processes, and can provide some theoretical basis for the development of SAB related new drugs.
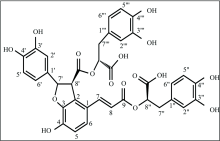
丹酚酸B(Salvianolic acid B, SAB)(图1), 一为缩酚酸类多羟基化合物, 可从唇形科多年生草本植物丹参的干燥根及根茎中提取得到[1]。 作为丹参中含量最高的水溶性成分, SAB具有很强的抗氧化性和清除自由基功能, 是目前已知的抗氧化作用最强的天然产物之一[2]。 目前, 对SAB生物活性已进行广泛的研究, 但对其在体内的生物行为如吸收、 运输、 分布及排泄等还知之甚少。 开展SAB的药代动力学研究, 将会对SAB的疗效机制研究及临床用药提供帮助。
血清白蛋白是血浆中含量最丰富的蛋白质(大约占60%), 能够与许多物质相结合, 起到存储和转运作用[3]。 药物从给药部位进入人体后, 在循环系统中都要不同程度地与血清白蛋白发生可逆结合。 而结合后的药物不易穿透毛细血管壁, 故使其不能到达病灶部位, 进而影响其发挥疗效。 此外, 结合小分子后血清白蛋白的空间构象和生理功能都会受到影响, 这对于理解蛋白结构与功能间的关系, 以及解释某些生理过程具有很大的促进作用[4]。 因此, 研究天然产物与蛋白质之间的相互作用已成为生命科学和临床医学等领域的研究热点[5]。
目前, 关于SAB与血清白蛋白的相互作用研究已有一些报道。 Chen等利用光谱法研究SAB与人血清白蛋白(HSA)的相互作用, 发现SAB对HSA的猝灭为静态猝灭[6]。 王月荣等运用电化学方法研究SAB与牛血清白蛋白(BSA)的结合, 发现两者之间形成结合比约为2: 1的复合物[7]。 而关于用核磁共振波谱和三维荧光光谱研究SAB对血清白蛋白构象的影响以及分析SAB在血清白蛋白上的结合位点等研究还未见报道。 通常利用荧光光谱技术可以得到小分子与蛋白质互作过程中的一些机制参数, 如结合常数、 主要结合力、 结合部位及蛋白结构变化等。 圆二色光谱则可以表征蛋白质的构象在结合小分子前后是否发生改变, 而核磁共振波谱技术可以分析小分子的哪些基团与蛋白发生了相互作用。 本工作以BSA为模型蛋白, 运用荧光光谱、 圆二色光谱和核磁共振波谱研究SAB与BSA的相互作用, 获得两者在互作过程中的结合机制信息, 并考察SAB的结合对BSA空间构象的影响。 这些研究对于从分子水平上理解SAB在血液中的存储转运机制以及药理作用具有重大的指导意义。
Fluorolog3型稳态、 瞬态荧光光谱仪(法国Horiba Jobin Yvon公司); Cary Eclipse型荧光光谱仪(美国Varian公司); J-810型圆二色谱仪(日本Jasco公司); AVANCE III 600 MHz型核磁共振谱仪(瑞士Bruker公司)。
BSA购于Sigma公司, 用PBS缓冲液(pH为7.4, 含0.1 mol· L-1的NaCl)配制浓度为1.0× 10-5和1.0× 10-4 mol· L-1的两种储备液, 避光置于4 ℃冰箱保存; 布洛芬和洋地黄毒苷购于Sigma公司, 华法林购于中国药品生物制品检定所, 三者均溶于二甲基亚砜(DMSO)溶液, 配制浓度为2.5× 10-3 mol· L-1的储备液; 其余试剂均为分析纯; 实验用水均为二次蒸馏水。
1.2.1 荧光光谱测定
配制10种不同浓度的BSA-SAB混合液, 使得SAB与BSA的摩尔浓度比分别为0, 1, 2, 3, 4, 5, 6, 8, 10, 12。 BSA在所有反应体系中最终测试浓度均为5.0× 10-6 mol· L-1。 置于恒温水浴中保温10 min, 然后于荧光光谱仪上进行检测。 激发和发射狭缝宽度为2 nm, 激发波长分别为280和295 nm, 发射波长范围分别为290~500和305~500 nm。 考虑内滤光效应的影响, 实验所测数据都进行荧光校正。 配制5种不同浓度比的BSA-SAB混合液, 在295 nm处测定样品的瞬态荧光光谱, 然后用仪器自带软件计算得到荧光寿命。 分别测定BSA与BSA-SAB体系的三维荧光光谱, 激发波长范围为200~360 nm, 发射波长范围为230~550 nm, 波长间隔为10 nm。
1.2.2 位点标记竞争实验
在比色管中加入3 mL的BSA-SAB混合液, 使其摩尔浓度比为1∶ 4(BSA浓度为5.0× 10-6 mol· L-1, SAB浓度为2.0× 10-5 mol· L-1), 然后依次加入不同量的位点标记试剂(华法林、 布洛芬、 洋地黄毒苷), 在280 nm激发波长下测定体系的荧光强度。
1.2.3 圆二色光谱测定
远紫外圆二色实验: 配制5种不同浓度比的BSA-SAB混合液, 蛋白终浓度为2.5× 10-6 mol· L-1, 在室温下扫描其圆二色谱图。 比色皿池径为2 mm, 扫描波长为200~260 nm。 在测试过程中SAB溶液作为空白背景被自动扣除。 近紫外圆二色实验: 配制4种不同浓度比的BSA-SAB混合液, 蛋白终浓度为1.0× 10-5 mol· L-1, 在室温下将样品置于10 mm的石英比色皿中, 扫描其260~320 nm波长范围内的圆二色谱图。
1.2.4 核磁共振波谱测定
用重水配制3种不同摩尔浓度比(0, 0.01, 0.1)的BSA-SAB混合液, 使得SAB的终浓度为2.5× 10-3 mol· L-1。 在室温下孵育2 h使其充分反应, 然后分别采用5 mm核磁管进行1H NMR实验。
2.1.1 荧光猝灭机理
图2(a)为BSA与SAB相互作用的荧光光谱图。 由图可见, SAB在280 nm激发下不发射荧光(曲线0)。 SAB的加入使得BSA在345 nm处的荧光强度逐渐降低, 且峰位置出现明显的红移, 表明SAB的存在下BSA荧光发生猝灭。 此外, 在453 nm左右出现了一个等强度发射点, 这是由于BSA与SAB之间形成了不发射荧光的复合物所造成的。 这些变化说明BSA与SAB之间发生相互作用, 使得蛋白色氨酸和酪氨酸残基微环境的结构发生改变。
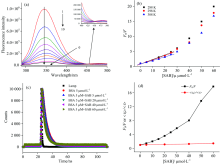 | 图2 298 K温度下BSA-丹酚酸B体系的荧光光谱图(a), Stern-Volmer曲线图(b), 时间分辨荧光衰减曲线图(c)和BSA-丹酚酸B体系的内源荧光强度和荧光寿命的Stern-Volmer曲线图(d)荧光猝灭通常可分为三种类型: 静态猝灭、 动态猝灭以及动静态联合猝灭[4]。 为了确定猝灭机制, 利用Stern-Volmer方程对荧光数据进行分析[3]Fig.2 (a) Fluorescence quenching spectra of BSA-SAB system at 298 K, (b) the Stern-Volmer plots of BSA-SAB system, (c) the time-resolved fluorescence decay of BSA-SAB system, (d) the Stern-Volmer curves for the intrinsic fluorescence intensity and fluorescence lifetime of BSA-SAB system c(BSA)=5 μ mol· L-1, c(SAB)/(μ mol· L-1), 1~10: 0, 5, 10, 15, 20, 25, 30, 40, 50, 60. Curve 0 represents the fluoresecence emission spectrum of SAB only |
式(1)中, F0和F分别为SAB加入前后BSA的荧光强度; Ksv为Stern-Volmer猝灭常数; kq是双分子猝灭过程的速率常数; τ 0是在无猝灭剂存在下的荧光分子的平均荧光寿命(一般为10-8 s); [Q]是SAB的浓度。 根据式(1), 以F0/F对[Q]作图[图2(b)]。 由图可见, Stern-Volmer曲线在高浓度时是向上偏向y轴的曲线, 说明BSA的荧光猝灭既涉及静态猝灭又涉及动态猝灭。 因为如果只存在单独一种猝灭方法, Stern-Volmer曲线应该是线性的。 此外, 在低浓度区域内, 可以看出Stern-Volmer曲线是线性的, 故可计算得到Ksv和kq(表1)。 由表可知, Ksv值随着温度的升高逐渐变小, 且所有温度下的kq值都远远大于最大扩散碰撞猝灭速率常数2× 1010 L· mol-1· s-1, 说明SAB对BSA的猝灭以是静态猝灭为主[4]。
| 表1 BSA-丹酚酸B体系的猝灭常数、 猝灭速率常数和结合常数 Table 1 Stern-Volmer quenching constants, bimolecular quenching rate constants and binding constants of BSA induced by SAB |
为了进一步确定BSA的猝灭机制, 测定蛋白质的荧光寿命被测定。 平均荧光寿命可通过式(2)求出[4]
式(2)中, < τ > 为平均荧光寿命, A1和A2为双指数衰减曲线中的振幅, τ 1和τ 2为相应的衰减时间常数。 图2(c)为BSA-SAB体系的瞬态荧光寿命曲线, 拟合得到的荧光衰减参数见表2。 从表2中可知, 随着SAB浓度的增加, BSA的平均荧光寿命逐渐降低, 故可推测猝灭过程不是单纯的静态猝灭, 因为单一的静态猝灭是不会改变体系的荧光寿命, 也说明蛋白荧光基团(色氨酸和酪氨酸残基)的微环境发生了改变。 图2(d)是BSA的荧光寿命比/荧光强度比与SAB浓度的关系。 从图中可看出, < τ 0> /< τ > 与浓度的曲线远远低于Stern-Volmer曲线, 说明静态猝灭在整个蛋白荧光猝灭中占据主要的地位。 根据公式F0/F=(< τ 0> /< τ > )(1/f)可计算得到激发态分子非静态的比重f[8]。 对于BSA-SAB体系, f值为8.15%, 即静态猝灭在BSA荧光猝灭中占的比重为91.85%, 故表明静态猝灭是主要的猝灭方式。 综上所述, 可以得出SAB导致BSA荧光猝灭的方式是以静态猝灭为主的联合猝灭方式。
| 表2 BSA-丹酚酸B体系的荧光寿命参数 Table 2 Fluorescence lifetime data for the interaction of BSA with SAB |
2.1.2 结合常数与结合位点数
蛋白质与小分子的相互作用过程, 假设蛋白上存在n个等同的独立结合位点, 则结合常数和结合位点数可由Scatchard方程求出[9]
式(3)中, r是每摩尔蛋白质结合的药物摩尔数, Df是游离药物的浓度, K和n分别是平衡结合常数与结合位点数。 根据线性方程的截距和斜率, 计算出K和n值, 结果见表1。 由表可知, BSA与SAB结合可形成1∶ 1型的复合物。 结合常数K的数量级在105, 且随着温度的升高逐渐减小, 说明结合力适中, 复合物的稳定性随温度升高而减弱。
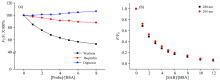
血清白蛋白能够与许多小分子结合。 研究发现血清白蛋白能够在三个区域(Site Ⅰ , Site Ⅱ 和Site Ⅲ )与小分子发生结合。 现在已确定这三个位点的特异性配体: 华法林主要结合在Site Ⅰ ; 布洛芬结合在Site Ⅱ ; 洋地黄毒苷结合位点为Site Ⅲ [9]。 在位点标记竞争实验中, 可通过加入不同类型的位点标记物, 分析位点标记物对小分子与蛋白相互作用的影响, 进而判断出小分子的结合部位。
根据Sudlow提出的方法[4], 以标记物取代百分数F2/F1× 100对标记物与蛋白的摩尔浓度比[Probe]/[Protein]作图。 从图3(a)可见, 荧光强度随着华法林浓度的增加而不断降低, 而布洛芬和洋地黄毒苷的加入, 对体系的荧光影响不明显, 说明华法林与SAB发生竞争, 即SAB在BSA上的结合位置是亚结构域Ⅱ A(Site Ⅰ )。
为确定色氨酸和酪氨酸残基在相互作用过程中是否直接参与反应, 测定BSA在不同激发波长(280和295 nm)的荧光光谱。 当激发波长为280 nm时, 蛋白的荧光来自于色氨酸和酪氨酸残基; 而在295 nm激发下, 仅仅只有色氨酸残基才发射荧光[4]。 从图3(b)可见, 在两种激发波长下BSA的荧光猝灭曲线基本上重叠, 表明酪氨酸残基不参与荧光猝灭, 即蛋白的荧光仅来自于色氨酸残基。 BSA中只含有两个色氨酸残基Trp-134和Trp-213, 其中Trp-134位于蛋白分子的表面, 处于亲水环境中, 荧光强度常被水分子猝灭, 而Trp-213位于BSA亚结构域Ⅱ A的疏水空腔中。 因此, 蛋白的内源荧光主要来源Trp-213残基。 故可间接说明SAB主要在BSA的亚结构域Ⅱ A处结合。
2.3.1 三维荧光光谱
图4(a)和(b)为SAB加入前后BSA的三维荧光光谱图。 从图可见, 每个三维光谱图都有4个峰, 其中像“ 山脊” 的两个峰分别为瑞利散射峰Peak a(λ em=λ ex)和二阶瑞利散射峰Peak b(λ em=2λ ex)。 另外两个典型的峰为Peak 1和Peak 2(反映色氨酸和酪氨酸残基的光谱行为)[10]。 加入SAB后, BSA-SAB体系的Peak a峰强度增加(由161.5升至238.3), 这可能是由于BSA-SAB复合物的形成导致体系中颗粒的粒径增大, 散射效应增强造成的[10]。 而Peak 1和Peak 2的荧光强度均降低(Peak 1降低45%; Peak 2降低48%)且峰位置发生了红移(Peak 1从347 nm红移到350.5 nm; Peak 2从347 nm红移到349 nm), 表明SAB的加入导致BSA的色氨酸和酪氨酸残基的微环境(疏水性减小, 极性增加)发生变化。
 | 图4 BSA(a)与BSA-丹酚酸B体系(b)的三维荧光光谱图Fig.4 The three-dimensional fluorescence spectra of free BSA (a) and BSA-SAB system (b) (a): c(BSA) = 5 μ mol· L-1; (b): c(BSA)=5 μ mol· L-1, c(SAB)=10 μ mol· L-1 |
2.3.2 圆二色谱
图5(a)是BSA-SAB体系的远紫外CD光谱图。 单纯的BSA以及与不同浓度SAB作用后BSA在208和222 nm附近都有两个明显的负特征峰(cotton效应), 此为典型的α -螺旋结构特征[12]。 随着SAB的加入, 结合小分子的BSA的远紫外CD光谱只发生很微小的改变, 特别是两个特征峰的形状及峰位置未发生明显的变化, 表明BSA中α -螺旋结构的含量几乎没有变化, 仍然以α -螺旋结构为主。 其中, α -螺旋结构含量可由式(4)和式(5)计算[12]
式中, cp为BSA的摩尔浓度, n为BSA氨基酸残基数, l为样品池的厚度, MRE208是BSA在208 nm处的平均残基椭圆率。 计算结果表明, 加入SAB后, BSA的α -螺旋含量从53.41%降到52.52%。 表明SAB结合BSA后基本上不会对其二级结构产生明显的影响。
图5(b)为加入不同浓度的SAB后BSA的近紫外CD光谱图。 在262和268 nm附近的两个负峰以及290 nm处的肩峰, 对映着蛋白质中芳香族氨基酸残基以及二硫键微环境的变化[4]。 由图可见, 随着SAB的加入, BSA近紫外CD图谱中这三个峰的改变非常小, 表明SAB的加入不会使BSA的三级结构发生显著的变化。
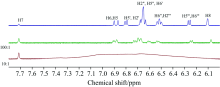
核磁共振波谱方法由于具有非侵入性、 无损性且不影响结合反应的平衡等优点, 在蛋白质与小分子相互作用方面受到越来越多的关注。 本研究中, 以观测SAB核磁信号为基础, 研究BSA与SAB的结合机制。 图6为SAB与BSA相互作用的1H NMR谱图。 从图可见, 当SAB与BSA的摩尔比为10∶ 1(红线)时, 由于BSA溶液的粘度太大, 使SAB的核磁谱图中峰变宽以至于不能区分, 出现变宽效应[13], 故在以下分析中不再考虑。 当它们的摩尔比为100∶ 1时, 化学位移发生改变, 质子信号变宽, 一些尖峰合并, 表明BSA与SAB发生相互作用。 特别是H5” , H6” 和H8的化学位移向高场移动, 说明H5” 和H6” 所在的苯环与BSA的芳香族氨基酸发生π — π 相互作用, 而其他氢质子的化学位移向低场移动, 是由复合物形成过程中的磁去屏蔽效应造成的[8]。 因此, 在SAB与BSA结合过程中, H5” 和H6” 所在的苯环发挥着重要的作用。 此外, 苯环是SAB上的主要疏水性基团, 而苯环在两者相互作用中发挥着重要作用, 故可以判断BSA与SAB之间存在着较强的疏水作用力。
利用荧光光谱、 圆二色光谱和核磁共振波谱法等技术研究了BSA与SAB之间的结合机制。 结果表明, SAB能够明显地猝灭BSA的内源荧光, 猝灭机制为以静态猝灭为主的联合猝灭。 SAB在BSA亚结构域Ⅱ A的疏水腔(Site Ⅰ )中与其发生相互作用, 形成1∶ 1的复合物。 三维荧光光谱和圆二色光谱结果表明, SAB的加入不会使BSA的二级结构和三级结构发生明显的变化, 但会使色氨酸和酪氨酸所处的微环境发生改变。 此外, H5” 和H6” 所在的苯环在BSA与SAB结合反应中发挥着重要的作用。 本研究有助于了解活性小分子与生物大分子之间相互作用的本质, 也为药物筛选和临床用药提供一定的参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|