作者简介: 陈健, 1996年生, 江西农业大学工学院硕士研究生 e-mail: 554850830@qq.com
采用同步荧光技术结合化学计量学方法实现了鸡肉中甲磺酸达氟沙星(DFM)和氧氟沙星(OFL)残留的快速检测。 首先, 分析了DFM标准溶液、 OFL标准溶液、 空白鸡肉提取液和含DFM和OFL的鸡肉提取液的同步荧光光谱, 确定了鸡肉中DFM和OFL残留的检测波长差(Δ λ)分别为130和200 nm, 荧光激发峰分别为288和325 nm。 其次, 采用单因素试验考察了氢氧化钠溶液浓度和表面活性剂种类对荧光强度的影响, 确定了鸡肉中DFM和OFL残留的最佳检测条件为: 氢氧化钠溶液浓度0.1 mol·L-1和SDS溶液浓度0.1 mol·L-1。 最后, 利用线性回归和偏最小二乘回归(PLSR)及多元线性回归(MLR)算法分别建立了鸡肉中DFM和OFL残留的预测模型。 试验结果表明, 与基于线性回归和MLR的DFM残留预测模型相比, 基于PLSR的DFM残留预测模型的综合评价更好, 其预测集决定系数($R^{2}_{p}$)为0.978 3, 预测集均方根误差(RMSEP)为1.934 2 mg·kg-1, 相对预测误差(RPD)为5.876 5。 与基于线性回归和PLSR的OFL残留预测模型相比, 基于MLR的OFL残留预测模型的综合评价更好, 其$R^{2}_{p}$为0.895 0, RMSEP为3.859 8 mg·kg-1, RPD为2.509 1。 该方法操作简单、 耗时短, 可用于鸡肉中DFM和OFL残留的快速检测。
The rapid detection for danofloxacin mesylate (DFM) and ofloxacin (OFL) residues in chicken were achieved through synchronous fluorescence technology coupled with chemometric methods. First of all, the synchronous fluorescence spectra of DFM standard solution, OFL standard solution, chicken extract without antibiotics and chicken extract containing DFM and OFL were analyzed, and the wavelength difference (Δ λ) of DFM and OFL were respectively determined as 130 and 200 nm, and the fluorescence excitation peaks of DFM and OFL were respectively determined as 288 and 325 nm for the detection of DFM and OFL in chicken, respectively. Subsequently, the effects of the concentrations of sodium hydroxide solution and the type of surfactant on the fluorescence intensities were investigated through the single factor test. The best detection conditions of DFM and OFL residues in chicken were as follows: the concentration of sodium hydroxide solution of 0.1 mol·L-1, and the concentration of SDS solution of 0.1 mol·L-1. Finally, the prediction models of DFM and OFL residues in chicken were established using linear regression, partial least squares regression (PLSR), and multiple linear regression (MLR), respectively. The experimental results showed that the comprehensive evaluation of DFM residues’ prediction model of based on the PLSR algorithm was best among these algorithms. The coefficient of determination for the prediction set ($R^{2}_{p}$) and the root mean square error for the prediction set (RMSEP) were 0.978 3 and 1.934 2 mg·kg-1. The ratio of prediction to deviation (RPD) was 5.876 5. The comprehensive evaluation of the prediction model of OFL residues based on the MLR algorithm was best among these algorithms. The $R^{2}_{p}$, RMSEP, and RPD were 0.895 0, 3.859 8 mg·kg-1, and 2.509 1, respectively. The adopted method was simple and fast, and could to realize the rapid detection of DFM and OFL residues in chicken.
喹诺酮类抗生素(Quinolones)是一类人工合成的广谱抗生素, 在家禽饲养和疾病的防治中被广泛应用[1]。 我国的家禽养殖向着规模化、 集约化方向发展, 抗生素发挥着越来越重要的作用, 但抗生素的不规范、 不合理使用导致禽肉抗生素残留的问题也日趋严重[2]。 甲磺酸达氟沙星(danofloxacin mesylate, DFM)和氧氟沙星(ofloxacin, OFL)是常用的喹诺酮类抗生素, 其残留进入人体可能引起癌症、 基因突变等[3]。 因此, 建立一种快速、 经济的鸡肉中DFM和OFL残留的检测方法是一项十分有意义的工作。 基于对消费者安全的考虑, 农业农村部限定了鸡肉中喹诺酮类抗生素的最大残留限量, 其中达氟沙星的最大残留限量为200 μ g· kg-1, OFL被禁用[4, 5]。
目前, 液相色谱法[6, 7]、 液相色谱和质谱联用法[8, 9]等方法可用于鸡肉中喹诺酮类抗生素残留的检测, 这些方法虽然有较高的灵敏度, 但仪器昂贵、 运行成本高且需要较高的操作水平[10]。 同步荧光技术同时扫描激发和发射单色器波长, 同时利用了化合物的吸收特性和发射特性, 具有简化光谱、 窄化谱带、 减弱背景干扰和降低散射光等优点[11]。 近年来, 李月秋等[12]应用同步荧光技术检测猪肉中头孢噻呋抗生素的残留量, 蔡其洪等[13]应用同步荧光技术检测火腿肠、 猪肉、 鱼肉、 鸭肉和鸡肉中氟罗沙星抗生素的残留量。 本研究以鸡肉为载体, DFM和OFL抗生素为研究对象, 应用同步荧光技术尝试建立一种鸡肉中DFM和OFL残留快速检测的方法。
荧光分光光度计(Cary Eclipse, 美国瓦里安); 电子天平(FA1004B, 上海上平仪器有限公司); 纯水机(全自动RO, 湖南科尔顿水务有限公司); 超声波清洗器(JK-50B, 合肥金尼克机械有限公司); 漩涡混合器(VORTEX-5, 海门市其林贝尔仪器有限公司); 振荡器(KJ-201BS, 江苏康健医疗用品有限公司); 低速离心机(JW-1024, 安徽嘉文仪器装备有限公司); 组织捣碎匀浆机(JJ-2B, 江苏省金南仪器厂); 石英比色皿(1 cm光程, 宜兴市晨伟玻璃仪器厂)。
鸡胸肉(南昌市某大型超市); DFM和OFL(≥ 98%, 上海源叶生物科技有限公司); 乙腈、 甲酸和氢氧化钠(分析纯, 西陇科学股份有限公司); 十二烷基硫酸钠(分析纯, SDS, 金克隆北京生物技术有限公司); 溴代十六烷基三甲胺(分析纯, CTAB, 金克隆北京生物技术有限公司); 壬基酚聚氧乙烯醚系列(7)醚(分析纯, NP-7, 上海麦克林生化科技有限公司); 有机相针式滤器(0.45 μ m, 上海安谱实验科技股份有限公司)。
(1)抗生素储备液的配制: 取5.0 mg的DFM(或OFL)标准品溶于50 mL超纯水, 可得到100 mg· L-1 DFM(或100 mg· L-1 OFL)储备液, 于4 ℃下储存。
(2)抗生素工作液的配制: 取0.15 mL的DFM(或OFL)储备液, 用超纯水稀释至15 mL得到1.0 mg· L-1 DFM(或OFL)工作液, 于4 ℃下储存。
(3)根据文献[14]中的快速溶剂萃取法提取空白鸡肉, 略作修改, 具体如下: 称取均质的鸡胸肉1.0 g, 置于10 mL离心管中, 加入2%甲酸-乙腈溶液4 mL, 涡旋1 min, 然后, 于离心机上以4 000 r· min-1的速率离心5 min, 将上清液移入另一个10 mL离心管中, 将离心残渣用4 mL 2%甲酸-乙腈溶液再提取一次, 合并上清液, 混匀, 过0.45 μ m滤膜, 用2%甲酸-乙腈定容至10 mL, 得到空白鸡肉提取液。
(4)根据文献[14]中的快速溶剂萃取法提取鸡肉中DFM和OFL的残留, 略作修改, 具体如下: ①加标鸡肉的制备: 称取均质的鸡胸肉1.0 g, 置于10 mL离心管中, 分别添加0.01, 0.04, 0.08, 0.10, 0.12, 0.16, 0.20, 0.24, 0.28, 0.32, 0.36, 0.40和0.44 mL 的DFM储备液和0.01, 0.04, 0.08, 0.10, 0.12, 0.16, 0.20, 0.24, 0.28, 0.32, 0.36, 0.40和0.44 mL的OFL储备液, 两者浓度随机组合, 涡旋1 min。 ②鸡肉中抗生素的提取: 再加入2%甲酸-乙腈溶液4 mL, 涡旋1 min, 然后, 于离心机上以4 000 r· min-1的速率离心5 min, 将上清液移入另一个10 mL离心管中, 将离心残渣用4 mL 2%甲酸-乙腈溶液再提取一次, 合并上清液, 混匀, 过0.45 μ m滤膜, 用2%甲酸-乙腈定容至10 mL。 得到含DFM和OFL的鸡肉提取液: DFM浓度为0.1, 0.4, 0.8, 1.0, 1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0和4.4 mg· L-1(分别对应于鸡肉中含有1.0, 4.0, 8.0, 10.0, 12.0, 16.0, 20.0, 24.0, 28.0, 32.0, 36.0, 40.0和44.0 mg· kg-1 DFM), OFL浓度为0.1, 0.4, 0.8, 1.0, 1.2, 1.6, 2.0, 2.4, 2.8, 3.2, 3.6, 4.0和4.4 mg· L-1(分别对应于鸡肉中含有1.0, 4.0, 8.0, 10.0, 12.0, 16.0, 20.0, 24.0, 28.0, 32.0, 36.0, 40.0和44.0 mg· kg-1 OFL)。
为了采集标准溶液以及鸡肉提取液的同步荧光光谱, 分别取500 μ L DFM标准溶液(1.0 mg· L-1)、 OFL标准溶液(1.0 mg· L-1)、 空白鸡肉提取液和含DFM和OFL的鸡肉提取液(1.0 mg· kg-1 DFM, 1.0 mg· kg-1 OFL)于不同的石英比色皿中, 再先后加入130 μ L SDS缓冲液(0.1 mol· L-1), 670 μ L氢氧化钠溶液(0.1 mol· L-1), 采集波长差Δ λ =130和200 nm处的同步荧光光谱。
(1)为了探究不同氢氧化钠溶液浓度对同步荧光强度的影响, 向石英比色皿中依次加入500 μ L含DFM和OFL的鸡肉提取液(1.0 mg· kg-1 DFM, 1.0 mg· kg-1 OFL), 130 μ L SDS溶液(0.1 mol· L-1), 670 μ L氢氧化钠溶液(0.001, 0.01, 0.1, 0.2, 0.3和0.4 mol· L-1), 设置5个平行组, 采集Δ λ =130和200 nm处的同步荧光光谱。
(2)为了探究不同表面活性剂对同步荧光强度的影响, 向石英比色皿中依次加入500 μ L含DFM和OFL的鸡肉提取液(1.0 mg· kg-1 DFM, 1.0 mg· kg-1 OFL), 130 μ L CTAB表面活性剂(0.019 mol· L-1)或SDS表面活性剂溶液(0.1 mol· L-1)或NP-7表面活性剂(5.33 mmol· L-1), 670 μ L氢氧化钠溶液(0.1 mol· L-1), 设置5个平行组, 采集Δ λ =130和200 nm处的同步荧光光谱。
向石英比色皿中依次分别加入500 μ L的含不同浓度DFM和OFL的鸡肉提取液, 130 μ L SDS溶液(0.1 mol· L-1), 670 μ L氢氧化钠溶液(0.1 mol· L-1), 设置5个平行组, 采集Δ λ =130和200 nm处的同步荧光光谱。
荧光光谱仪参数设置如下: 激发波长扫描范围为240~450 nm, 激发、 发射狭缝宽度均为5 nm, PMT电压为700 V。
在建立预测模型之前, 使用The Unscrambler X 10.4(挪威CAMO公司)软件对原始光谱进行基线偏移, 以消除原始光谱的基线漂移。 其次, 使用该软件对基线偏移后的光谱进行主成分分析(principal component analysis, PCA), 以减少模型输入变量的个数。 为了建立线性回归模型, 拟合鸡肉中DFM残留浓度和荧光激发峰强度(Δ λ =130 nm, 荧光激发峰288 nm)之间的关系、 拟合鸡肉中OFL残留浓度和荧光激发峰强度(Δ λ =200 nm, 荧光激发峰325 nm)之间的关系。 此外, 使用The Unscrambler X 10.4软件, 以前3个主成分得分为输入, 分别建立基于偏最小二乘回归(partial least squares regression, PLSR)和多元线性回归(multiple linear regression, MLR)算法的鸡肉中DFM残留的预测模型; 以前3个主成分得分为输入, 分别建立基于PLSR和MLR算法的鸡肉中OFL残留的预测模型。 其中, PLSR采用交叉验证(cross validation)结合Kernel PLS算法; 采用基于杠杆率校正(leverage correction)的MLR算法。 计算预测集决定系数(coefficient of determination for the prediction set,
DFM和OFL具有相似的化学结构, 进而有类似的荧光特性。 为了实现辨别的目的, 须要找到合适的Δ λ 。 图1给出了DFM和OFL标准溶液的同步荧光光谱图, 从中看出, DFM和OFL荧光光谱有明显区别, 在Δ λ =130 nm时, 可由282 nm处宽谱峰辨别出DFM。 在Δ λ =200 nm时, 可由318 nm处宽谱峰辨别出OFL。 图2给出了鸡肉提取液的同步荧光光谱图。 从中看出, 鸡肉中DFM和OFL的荧光激发峰相对标准溶液中DFM和OFL的荧光激发峰发生红移现象。 含DFM和OFL的鸡肉提取液在Δ λ =130 nm处有位于288 nm处DFM的荧光激发峰, 在Δ λ =200 nm处有位于325 nm处OFL的荧光激发峰, 而空白鸡肉提取液在这些位置处未出现宽谱峰。 综上所述, 鸡肉中DFM和OFL残留可通过Δ λ /激发波长130/288 nm和200/325 nm实现同时检测。
由图3(a)可知, 随着氢氧化钠溶液浓度增加, DFM的荧光强度呈先增强, 后减弱的趋势。 对于OFL而言, 荧光强度也呈先增强, 后减弱的趋势。 产生荧光强度变化的原因可能是氢氧化钠溶液浓度的增加, 体系pH会升高, 进而影响了DFM和OFL的质子离解平衡[15], 影响了它们的荧光强度。 在氢氧化钠溶液浓度为0.1 mol· L-1时, DFM和OFL的荧光强度最大。 因此, 0.1 mol· L-1为氢氧化钠溶液最佳的加入浓度。
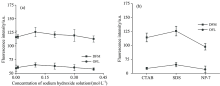 | 图3 不同条件对荧光强度的影响 (a): 氢氧化钠溶液浓度; (b): 表面活性剂Fig.3 Effects of difference conditions on the fluorescence intensities (a): Concentration of sodium hydroxide solution; (b): Surfactants |
表面活性剂具有荧光增敏的效果, 被广泛应用于荧光检测。 表面活性剂达到临界胶束浓度时能形成胶束, 使DFM和OFL分子处于有序的微环境, 减少了分子间的碰撞概率[16]。 在本试验中SDS在体系中浓度为10.0 mmol· L-1, 大于其临界胶束浓度8.0 mmol· L[17]。 由图3(b)可知, 在加入SDS表面活性剂时, DFM络合物的荧光强度最大。 另一方面, 在加入SDS表面活性剂时, OFL络合物的荧光强度最大。 因此, 选用SDS表面活性剂。
PCA是一种经典的多元统计分析技术, 其中心目的是将光谱的数据降维。 表1给出了前4个主成分的方差贡献率和累计方差贡献率。 从中可见, DFM和OFL前3个主成分的累计方差贡献率均达到了90%。 随着主成分数增大, 其方差贡献率逐渐减小。 通常主成分数大于90%的累计方差贡献率就能代表原始变量的大部分信息[18]。 因此, 选择前3个主成分进行PLSR和MLR分析。
| 表1 前4个主成分的方差贡献率和累计方差贡献率 Table 1 Variance contribution rate and cumulative variance contribution rate for the first four principal component |
含DFM和OFL的鸡肉提取液样本共13个, 随机选取7个样本作为训练集, 以建立预测模型, 剩余6个作为预测集, 以分析模型预测结果, 预测集的数据都落在训练集的范围之内, 如表2所示。
| 表2 鸡肉中DFM和OFL残留的样本统计结果 Table 2 Statistical results of samples of DFM and OFL residues in chicken |
MLR是一种经典的多元校正方法, 以多个变量的光谱矩阵为基础建立模型。 PLSR是一种应用广泛的多元校正方法, 在分解光谱矩阵和浓度矩阵时, 考虑了两者相互之间的关系[19]。 为了评价鸡肉中DFM和OFL的残留, 分别建立了基于线性回归、 PLSR和MLR算法的鸡肉中DFM和OFL残留的预测模型, 并进行验证, 3种模型预测统计结果如表3所示。 由表可见, 基于线性回归的DFM残留预测模型的
| 表3 鸡肉中DFM和OFL残留的模型预测统计结果 Table 3 Statistical results of prediction model of DFM and OFL residues in chicken |
综合上述的信息得出基于PLSR的DFM残留预测模型和基于MLR的OFL残留预测模型的综合评价更好, 因此本试验分别用PLSR和MLR算法建立鸡肉中DFM和OFL残留的预测模型, 检测鸡肉中DFM和OFL残留的检出限均可达1.0 mg· kg-1, 并绘制了鸡肉中DFM和OFL残留的样本关系图(见图4)。 本方法能够满足鸡肉中DFM和OFL残留快速同时检测要求, 对后续研究具有一定的参考价值。
采用同步荧光技术结合化学计量学方法, 建立了鸡肉中DFM和OFL残留快速检测的方法。 试验结果表明, 采用同步荧光技术可有效的分辨出鸡肉提取液、 DFM和OFL的荧光特征峰, 使鸡肉中DFM和OFL残留被同时检测, 简化了检测步骤, 为鸡肉中抗生素残留的快速检测提供技术支持。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|





