作者简介: 黄维波, 1995年生, 暨南大学生物矿化与结石病防治研究所硕士研究生 e-mail: 928269956@qq.com
植物多糖的化学结构与尿液中的结石抑制剂葡胺聚糖相似, 有可能用于预防和治疗肾结石。 天然多糖由于分子量和分子体积过大, 导致其应用受到限制。 研究了四种分子量分别为49.6, 16.2, 8.2和3.8 kDa的降解龙须菜多糖GLP1, GLP2, GLP3和GLP4对草酸钙(CaOx)晶体生长的调控作用。1H NMR,13C NMR和气相色谱-质谱(GC-MS)谱分析表明四种GLPs由β-D-半乳糖和6-O-硫酸基-3,6-α-L-吡喃半乳糖组成。 X射线衍射(XRD)检测表明, 在各GLPs存在下, 诱导了二水草酸钙(COD)晶体形成, COD的衍射峰出现在晶面间距 d=0.617, 0.441, 0.277和0.224 nm处; 而没有多糖存在时只生成一水草酸钙(COM)晶体, COM的衍射峰出现在 d=0.593, 0.364, 0.296和0.235 nm。 由于COD比COM更容易排出体外, COD的形成有利于降低结石形成的风险。 傅里叶变换红外光谱(FTIR)检测表明, 随着GLP分子量减小或GLP浓度增加, 草酸根中羧基的不对称伸缩振动 νas(COO-)和对称对称伸缩振动 νs(COO-)都发生了不同程度的蓝移, 其中 νas(COO-)从1 618 cm-1增加到1 642 cm-1, νs(COO-)从1 318 cm-1增加到1 328 cm-1, 即GLP4诱导的全部是COD晶体。 扫描电子显微镜(SEM)检测表明, 随着GLP分子量减小, 不但晶体中COD的比例增加, 而且晶体的分散程度增大, 晶体更加圆钝。 随着GLP分子量减小或GLP浓度增加, 其诱导生成的CaOx晶体表面电荷越负, Zeta电位绝对值越大, 这有利于抑制晶体的聚集。 电感耦合等离子体发射光谱仪(ICP)检测表明, 四种GLPs均可以增加溶液中可溶性Ca2+的浓度, 同时减少CaOx沉淀的生成量。 在浓度为1.0 g·L-1多糖存在时, 上清液中可溶性Ca2+的摩尔浓度分别为: GLP4 (37.88 μmol·L-1)>GLP3 (19.70 μmol·L-1)>GLP2 (16.05 μmol·L-1)>GLP1 (10.55 μmol·L-1)。 结果表明, 四种GLPs均可以抑制COM生长, 诱导COD生成, 降低晶体的聚集程度, 增加晶体表面的Zeta电位绝对值和溶液中可溶性Ca2+浓度, 减少CaOx晶体的生成量, 且GLPs的调控活性与其分子量呈负相关。 这些结果提示GLPs特别是分子量最小的GLP4有可能是防治CaOx结石的潜在药物。
Plant polysaccharides’ chemical structures are similar to that of glucosaminoglycan, a stone inhibitor in urine; thus plant polysaccharides may be used to prevent and treat kidney stones. However, the applications of natural polysaccharides are limited due to their large molecular weights and volume. In this study, the effects of four degraded Gracilaria lemaneiformis polysaccharides (GLP1, GLP2, GLP3 and GLP4) with molecular weights of 49.6, 16.2, 8.2 and 3.8 kDa, respectively, on crystal growth of calcium oxalate (CaOx) were studied.1H NMR,13C NMR and gas chromatography-mass spectrometry (GC-MS) spectra showed that the four GLPs were composed of β-D-galactose and 6-O-sulfate-3,6-α-L-galactopyranose. X-ray diffraction (XRD) patterns showed that GLPs induced the formation of calcium oxalate dihydrate (COD) crystals, and the diffraction peaks of COD appeared at crystal plane spacing d=0.617, 0.441, 0.277 and 0.224 nm. However, only calcium oxalate monohydrate (COM) crystals were formed in the absence of polysaccharide, and the diffraction peaks of COM appeared at d=0.593, 0.364, 0.296 and 0.235 nm. Because COD is more easily excreted out from the body than COM, COD formation is beneficial to reduce the risk of stone formation. Fourier-transform infrared spectroscopy (FTIR) showed that the asymmetric stretching vibration νas(COO-) and symmetric stretching vibration νs(COO-) of carboxyl groups from oxalate had different degrees of blue shift as the molecular weight of GLP decreased or GLP concentration increased, in which νas(COO-) increased from 1 618 to 1 642 cm-1 and νs(COO-) increased from 1 318 to 1 328 cm-1. That is, GLP4 induced full COD crystals. Scanning electron microscope (SEM) examination showed that as the molecular weight of GLP decreases, the proportion of COD increased, and the dispersion degree of the crystal increased, making the crystal much blunter. As GLP molecular weight decreased or GLP concentration increased, the surface charges of CaOx crystals induced by GLPs changed to be more negative. The greater absolute value of Zeta potential is conducive to inhibiting crystal aggregation. The inductively coupled plasma emission spectra (ICP) results revealed that the four GLPs increased the concentration of soluble Ca2+ ions ( c(Ca2+)) in the solution and decreased the amount of CaOx precipitation. At a concentration of 1.0 g·L-1, the c(Ca2+) in the supernatant were GLP4 (37.88 μmol·L-1)>GLP3 (19.70 μmol·L-1)>GLP2 (16.05 μmol·L-1)>GLP1 (10.55 μmol·L-1), respectively. The four GLPs can inhibit COM growth, induce COD formation, reduce the aggregation degree of crystals, increase the absolute value of Zeta potential on crystal surface and the concentration of soluble Ca2+ ions in solution, and reduce the amount of CaOx crystal formation. The regulatory ability of GLP was negatively correlated with its molecular weight. All these results showed that GLPs, especially GLP4 with the smallest molecular weight, might be potential drugs for the preventing and treating CaOx stones.
肾结石的主要组分草酸钙(CaOx)存在两种形式: 一水和二水草酸钙(COM和COD), 其中COM结石是COD结石的两倍[1]。 常见的防石药物包括噻嗪类利尿药、 枸橼酸盐和别嘌呤醇等, 这些药物都不能彻底治疗肾结石。 因此, 开发高效、 低毒、 廉价的新型防石药物仍然具有重要的科学和现实意义。
植物多糖不但具有抗氧化等生物活性[2, 3, 4], 而且其化学结构与尿液中的结石抑制剂葡胺聚糖(GAG)相似, 有可能用于预防和治疗肾结石[5, 6]。 然而, 天然多糖由于分子量和分子体积大, 不利于其跨越多重细胞膜障碍进入生物体内发挥生物学活性, 导致其应用受到限制[2]。
龙须菜(Gracilaria lemaneiformis)属红藻门江蓠科江蓠属, 广泛分布于海域环境[7]。 龙须菜多糖(GLP)属于琼胶类型, 即由β -D-半乳糖和3, 6-内醚-α -L-半乳糖交替相连接的琼二糖构成的线性聚合物。 由于以前龙须菜养殖规模较小, 目前对于GLP的研究仅有少量报道, 如抗氧化、 抗肿瘤、 降血糖以及免疫调节等[7, 8]。 GLP对CaOx晶体的影响及其抑制肾结石形成均未见报道。
采用双氧水对分子量为622 kDa的龙须菜原多糖(GLP0)降解, 获得了4种分子量分别为49.6, 16.2, 8.2和3.8 kDa的降解多糖GLP1, GLP2, GLP3和GLP4, 研究它们调控CaOx晶体生长的差异, 期望为探讨肾结石的形成机理、 开发防石新药提供实验依据。
龙须菜多糖(GLP0)由北京普博欣生物科技有限责任公司提供。 参照文献[3]对GLP0进行降解和纯化。 过氧化氢(H2O2)等常规化学试剂均为分析纯, 购自广州化学试剂公司。 实验用水均为二次蒸馏水。
D/max2400X射线粉末衍射仪(日本理学)。 OPTIMA-2000DV电感耦合等离子体发射光谱仪(ICP)(美国PE公司)。 XL30型环境扫描电子显微镜(荷兰Philips公司)。 傅里叶变换红外吸收光谱仪(EQUINOX55, Bruker, 德国)。 核磁共振仪(Varian Bruker-300 MHz, 德国)。 氘代水(D2O, 99.9%, sigma)。
称取完全干燥的多糖样品20 mg, 溶于装有0.5 mL氘代水(D2O)的核磁管中, 完全溶解后, 在核磁共振光谱仪的磁场中进行检测。
参照文献[9], 将10 mg多糖加入2.5 mol· L-1三氟乙酸(2 mL)中, 在121 ℃密闭容器中水解90 min。 加入乙酸酐1 mL在100 ℃密封条件下乙酰化2.5 h, 乙酰化产物用二氯甲烷萃取。 干燥后进行GC-MS测定。 采用HP-5MS毛细管柱(15 m× 250 μ m× 0.25 μ m), 程序升温至310 ℃。 氦气作为载气, 柱流速0.6 mL· min-1。 乙酰化产物通过在GC-MS中的碎片离子和GC中的相对保留时间鉴定。 鉴定峰和通过峰面积评估。 标准的单糖(鼠李糖、 阿拉伯糖、 岩藻糖、 木糖、 甘露糖、 葡萄糖和半乳糖)作为参照物。
在c(Ca2+)=c(Ox2-)=10 mmol· L-1的过饱和溶液中, 加入浓度在0~2.0 g· L-1的多糖。 反应10 min后, 在37 ℃恒温条件下静置2 h, 离心分离。 用ICP测定上层清液中的可溶性Ca2+浓度, 底层CaOx沉淀在真空干燥器中干燥后称重, 并取一定量的CaOx样品进行XRD, FTIR和SEM检测。
CaOx中一水草酸钙(COM)和二水草酸钙(COD)的相对百分含量根据XRD谱采用K值法计算
式中ICOM和ICOD分别为COM的主衍射峰$(\overline{1} 01)$晶面和COD的主衍射峰(200)晶面的强度。
FTIR检测: 取2 mg的已干燥的CaOx样品, 与200 mg KBr充分混匀, 用玛瑙研钵进行研磨, 研磨至看不见金属光泽的粉末, 压片, 采用红外光谱仪于4 000~400 cm-1 波数范围内扫描。
SEM检测: 称取上述CaOx沉淀1 mg, 分散在10 mL无水乙醇中, 在低功率下超声3 min后, 点样在10 mm× 10 mm的玻片上, 于50℃下烘干, 样品喷金后用扫描电镜观察晶体的尺寸与形貌。
称取上述在不同条件下得到的CaOx沉淀各10 mg, 分散在30 mL二次蒸馏水中, 悬浮液超声10 min后分别用Zeta电位分析仪测量其Zeta电位。
采用不同浓度的H2O2对原始多糖GLP0进行降解, 得到了4种不同分子量的降解多糖(表1)。 随着c(H2O2)增加, 多糖的分子量下降。 降解前后GLPs中的硫酸基(— OSO3-)含量约13.5%, 各多糖之间相差较小, 说明采用H2O2降解没有使多糖的— OSO3-基含量发生显著的改变。
| 表1 4种不同分子量GLPs多糖的理化性质 Table 1 Physical and chemical properties of four GLPs with different molecular weight |
(1)1H和13C NMR分析
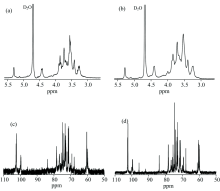
由图1(a)和(b)可知, 各降解GLPs的1H NMR谱相似, 说明H2O2降解不会破坏GLP的结构。 在δ =4.43 ppm和δ =5.30 ppm处仅有两个峰, 且δ =4.43 ppm (d, J=7.9 Hz)为β -D-半乳糖的H1的化学位移, δ =5.30 ppm(s, J=0 Hz)为3, 6-α -L-吡喃半乳糖的H1的化学位移[10]。 而FTIR谱图930 cm-1处的峰很弱, 说明基本上不含内醚型的半乳糖。 因此GLP由β -D-半乳糖和6-O-硫酸基-3, 6-α -L-吡喃半乳糖组成, 与文献[11, 12]报道的有所区别。
根据13C NMR中δ 处于95~110 区间峰的个数和化学位移值可推测出低聚糖及其糖苷中所含单糖的个数和糖苷键的构型[9, 13]。 从图1(c)可知在异头碳区域δ (95~110 ppm)主要有两个峰, 即: δ 102.2 ppm对应于β -D-半乳糖的端基碳C-1, δ 98.2 ppm对应于3, 6-α -L-吡喃半乳糖的端基碳C-1。 GLP的13C NMR对应的化学位移如表2所示。
| 表2 GLPs的13C NMR谱化学位移 Table 2 Chemical shift corresponding to 13C NMR spectra of GLPs |
(2) GLP中各单糖组成分析
GLPs中各单糖色谱峰的保留时间[图2(b— e)]与标准单糖海藻糖、 木糖、 甘露糖及半乳糖的保留时间[图2(a)]一致, 其主要由半乳糖组成(约74.24%~88.11%), 海藻糖、 木糖和甘露糖的含量较低(表3)。
| 表3 四种分子量GLPs的单糖组成 Table 3 Monosaccharide composition of four GLPs with different molecular weights |
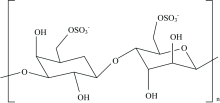
根据以上光谱分析可以看出, H2O2降解没有导致GLP0的去硫酸化和主要结构改变。 GLP的结构式如图3所示, 与文献[14]基本一致。 即GLP多糖主要由含有硫酸基团的3-连接β -D-吡喃半乳糖和4-连接α -L吡喃半乳糖单位交替链接组成的琼胶和卡拉胶多糖以及少量的葡萄糖、 3.6-内醚半乳糖。
参照图4的实验流程, 制备了不同分子量GLPs调控下的CaOx晶体, 并对所制备的晶体进行了XRD, FTIR, SEM和Zeua电位等检测与表征。
(1) XRD谱
图5(a)为多糖浓度为1.0 g· L-1时不同GLPs诱导生成的CaOx晶体的XRD谱。 没有多糖存在的空白组只生成一水草酸钙(COM)晶体[图5(a)], 其在晶面间距d=0.591, 0.364, 0.296和0.235 nm的衍射峰分别归属于COM的$(\overline{1} 01)$, (020),$(\overline{2} 02)$和(130)晶面。 而在各GLPs存在下, 诱导了二水草酸钙(COD)晶体形成, COD的衍射峰出现在晶面间距d=0.617, 0.441, 0.277和0.224 nm处, 分别归属于COD的(200), (211), (411)和(213)晶面。 随着GLP分子量降低, COD的的衍射峰强度增加, 即COD的百分含量增加。 定量计算表明, 在浓度为1.0 g· L-1的GLP1, GLP2,GLP3和GLP4存在下, COD的比例依次为35.65%, 67.9%, 74.9%和100%。
(2) FTIR谱
图5(b)为上述晶体的FTIR谱。 在3 000~3 600 cm-1处的宽峰由O— H的伸缩振动引起, 其中COM晶体分裂成五个小峰[图5(b)中a— c], 而COD为一个大峰[图5(b)中d— e], 其强度亦比COM强, 归因于COD比COM多含有1个水分子所致。 在1 618和1 318 cm-1处为草酸根的不对称伸缩振动ν as(COO-)和对称伸缩振动ν s(COO-)。 在指纹区COM的吸收带出现在956, 884和667 cm-1处, 而COD晶体在916和616 cm-1处。
随着GLP分子量减小, 诱导的COD百分含量增加, ν as(COO-)和ν s(COO-)都发生了不同程度的蓝移, 其中ν as(COO-)从1 618 cm-1增加到1 642 cm-1, ν s(COO-)从1 318 cm-1增加到1 328 cm-1, 表明GLP4诱导的全部是COD晶体, 与XRD结果基本一致。
图6为4种不同分子量GLP调控下生成CaOx晶体的SEM。 没有多糖存在时生成的晶体全部为COM晶体[图6(a)], 形貌不规则, 存在聚集现象。 而在1.0 g· L-1多糖存在下, 4种GLPs调控得到得晶体均是COM与COD共存。 随着GLP分子量减小, 不但COD比例增加, COD晶体分散程度增大, 而且COD更加圆钝, 如图6(b— e)所示。
图7(a)— (d)为在不同浓度下4种GLPs诱导的CaOx晶体的XRD谱。 随着多糖浓度增加, 归属于COD的衍射峰增强, 即其诱导的CaOx晶体中COD百分含量增加[图7(e)]。
图8(a, b)分别为不同浓度下GLP1和GLP4存在下生成的CaOx晶体的FTIR谱。 随着GLP浓度从0.5 g· L-1到2.0 g· L-1, CaOx晶体中ν as(COO-)和ν s(COO-)都发生不同程度的蓝移, 表明生成的CaOx晶体中COM百分含量在不断下降, 而COD含量则逐渐增加。 相比较GLP1, GLP4在此浓度范围内导致的ν as(COO-)和ν s(COO-)发生的蓝移程度更大, 表明分子量更小的GLP4诱导生成的COD晶体百分比更多。
Zeta电位可作为粒子间排斥力大小的量度, 晶体表面Zeta电位绝对值越大, 说明晶体表面的电荷密度越大, 晶体间的排斥力越大, 晶体在溶液中的分散性越好, 越不易聚集, 越有利于抑制CaOx晶体的聚集。 4种不同分子量GLPs诱导生成的CaOx晶体的Zeta电位如图9所示。
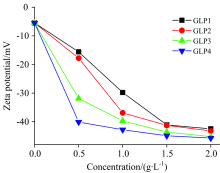 | 图9 不同分子量GLPs对CaOx晶体的Zeta电位的影响Fig.9 Zeta potential of CaOx crystals induced by different molecular weights of GLPs |
(1) 分子量的影响: 在相同浓度时, 分子量越小的多糖, 其诱导的CaOx晶体Zeta电位绝对值越大, 归因于小分子量多糖暴露更多的带负电荷的活性基团。
(2) 多糖浓度的影响: 相同多糖, 随着其浓度增加, Zeta电位绝对值越大, 即诱导生成的CaOx晶体表面电荷越负。
采用ICP检测了在不同浓度GLPs存在下, 上清液中可溶性Ca2+物质量和CaOx沉淀的质量[n(Ca2+)], 见图10(a, b)。 随着多糖浓度的增加, 上清液中可溶性Ca2+的浓度增加而诱导生成的CaOx沉淀的物质的量[m(CaOx)]相应减少。
而对于不同多糖, 在相同浓度时, 分子量越小, 上清液中钙离子的含量越大, 生成的沉淀量越少。 如在浓度为1.0 g· L-1时, 上清液中可溶性钙离子的摩尔浓度分别为: GLP4 (37.88 μ mol· L-1)> GLP3 (19.70 μ mol· L-1)> GLP2 (16.05 μ mol· L-1)> GLP1 (10.55 μ mol· L-1)。 即随着多糖含量增大或分子量降低, 其螯合钙离子的能力增强, 被络合的Ca2+增加, 导致溶液中可溶性Ca2+浓度增加, 生成的CaOx晶体沉淀量减少, 这些均有利于抑制CaOx结石的形成。
多糖具有抗氧化、 抗癌、 抗疲劳等生物活性, 而影响多糖性质的因素包括多糖的分子量、 多糖中酸性基团含量、 单糖组成、 主链结构和糖苷键的连接类型等, 特别是分子量和酸性基团含量对多糖的生物活性影响较大。
当多糖分子量较大时, 其分子体积较大, 多糖缠绕作用大, 水溶性低, 多糖溶液的粘度大, 裸露在外的活性基团减少, 不利于多糖生物活性的发挥。 例如, Sun等[15]采用微波技术对分子量为2 918 kD卟啉多糖进行降解, 得到3种分子量分别为256.2, 60.66和6.55 kDa的降解多糖, 实验表明降解后的多糖具有更强的抗氧化能力。
多糖分子内含有较多的活性基团如硫酸基(— OSO3-)和羧基(— COO-)等, 这些活性基团能够通过清除自由基达到抗氧化的目的; 且活性基团含量越多, 其活性越强。 例如, Ma等[16]探究了4种— OSO3-基含量分别为17.9%, 13.3%, 8.2%和5.5%的海藻多糖DSPs的抗氧化活性, 发现随着硫酸基含量的增加, DSPs清除自由基的能力和还原活性均增加。
从1H NMR, 13C NMR谱[图1(a, b)]和GC-MS结果(图2)可知, 对龙须菜多糖进行降解并没有改变多糖的结构及单糖组成, 4种GLPs的— OSO3-基含量(表1)也相近, 因此影响上述4种GLPs调控CaOx晶体生长的因素主要是多糖的分子量。
XRD, FTIR(图5)和SEM(图6)表明, GLPs诱导了COD形成, 且随着GLP分子量降低, 其诱导生成的COD百分含量增加。 GLP因为含有约13.5%的— OSO3-基而带负电荷, COM晶体的$(\overline{1} 01)$晶面带正电荷, 且COM晶体表面的吸附位点比COD晶体表面多[17], 因此, GLP可以静电作用吸附在COM晶体表面, 阻止了钙离子在COM表面的沉积, 抑制COM晶体的生长。 而COD表面为电中性, 因此多糖可以在诱导COD晶体形成的同时, 抑制COM晶体的生长[18]。 由于COD晶体与肾上皮细胞的粘附力比COM弱得多, 因此COD比COM容易排出体外, 即诱导COD形成比诱导COM形成可以降低CaOx肾结石的形成风险。
SEM观察还表明, GLPs抑制了晶体的聚集。 与空白组相比, 在不同分子量GLPs诱导下, CaOx晶体的聚集程度逐渐下降, 且随着多糖分子量的降低而降低。 因为随着GLP分子量降低, CaOx晶体表面Zeta电位变得更负(图9), 即晶体表面的负电荷增加, 从而增加了晶体间的排斥力, 有利于预防晶体的聚集。
但随着GLP分子量降低, 多糖链缩短, 分子结构展开, 使得多糖在溶液中的溶解度增大, 并具有更高的自由度, 从而增加了多糖的生物活性[13, 19]。 例如, 低分子量GLP可以螯合溶液中更多的Ca2+, 增加溶液中可溶性Ca2+浓度, 降低溶液的过饱和度, 减少CaOx晶体沉淀量, 从而抑制CaOx晶体的形成。 各GLPs对肾上皮细胞的保护修复作用还在进一步研究中。
对分子量为622 kDa的原始龙须菜多糖(GLP0)进行降解, 得到了分子量分别为49.6, 16.2, 8.2和3.8 kDa的4种降解龙须菜多糖GLP1, GLP2, GLP3和GLP4。 采用1H NMR, 13C NMR, GC-MS, XRD, FTIR和Zeta电位仪等方法比较研究了四种降解多糖对CaOx晶体生长的调控作用。 四种GLPs均可以抑制COM晶体生长, 减少生成的CaOx晶体质量, 增加溶液中可溶性Ca2+浓度和晶体表面的Zeta电位绝对值, 减小晶体之间的聚集, 诱导COD的生成并使晶体变得更加圆钝, 随着多糖分子量减小, 多糖的活性增强。 GLPs的上述作用均有利于减少CaOx肾结石形成的风险。 研究结果表明, GLPs特别是分子量最小的GLP4有可能是一种潜在的抗结石药物。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|