作者简介: 胡晶静, 1994年生, 浙江大学环境与资源学院硕士研究生 e-mail: 21714023@zju.edu.cn
近年来, 纳米材料对环境和人类健康的潜在风险已经引起了人们的广泛关注。 纳米颗粒尺寸小、 反应活性高, 当其进入机体后很可能与体内的生物大分子相互作用, 使其原来的理化性质发生改变, 更容易被细胞识别、 吞噬, 进而对组织、 器官等产生危害; 作用过程中生物大分子也会受到纳米颗粒的影响, 可能导致其生理结构受到损伤, 并干扰其特定功能的正常执行; 因此研究纳米材料与蛋白质的相互作用对探究其生物安全性具有重要意义。 实验通过多种光谱手段研究了碳量子点(CQDs)对人血清白蛋白(HSA)结构与功能性质的影响以及两者的相互作用机制。 荧光光谱与紫外-可见吸收光谱结果显示, CQDs通过与HSA结合形成复合物导致蛋白质荧光猝灭; 结合常数 KA与结合位点数 n的计算结果表明CQDs在HSA上只有一个结合位点, 且同步荧光和位点竞争实验发现, 这个结合位点接近HSA中ⅡA亚结构域上的色氨酸残基; 根据Förster共振能量转移(FRET)理论计算出两者的作用距离 r=2.89 nm<8 nm, 表明HSA与CQDs之间通过非辐射能量转移导致蛋白质内源性荧光猝灭; 根据Van’t Hoff方程计算得到HSA-CQDs体系的热力学参数, 由热力学参数计算结果推断相互作用过程中主要有氢键和范德华力参与; 根据共振光散射(RLS)、 三维荧光光谱和圆二色光谱(CD)结果显示, 相互作用会导致HSA的二级、 三级结构发生改变, 蛋白质中α-螺旋结构含量增加, HSA进一步卷曲折叠, 使色氨酸残基所处微环境的疏水性增大; 而结构变化还进一步影响着蛋白质的聚集状态和一些生理功能, 使得相互作用后HSA的聚集程度和类酯酶活性降低, 不利于蛋白质的团聚, 自由基清除能力略有提高。 该研究可为纳米材料的生物与环境安全评价提供参考依据, 也为探究纳米颗粒-蛋白质相互作用提供了一套较为系统的光谱分析方法。
The potential risk of nanomaterials to the environment and human health has caused widespread concernin recent years. Because of their small size and high reactivity, nanoparticles are likely to interact with biological macromolecules in vivo when they enter into the organisms. Therefore their original physical and chemical properties will change. Then, they are easily recognized and phagocytized by cells, and further bring about harm to the tissues and organs. In the process of interaction, biomacromolecules are also affected by nanoparticles, which may cause damage to their structure and interfere with the normal performance of their specific functions. Therefore, the toxic effect of nanomaterials on biomacromolecules is an important theoretical basis for studying their biosafety. Structure and function changes of human serum albumin (HSA) when exposed to carbon quantum dots (CQDs) and the mechanism for their interaction were studied by a variety of spectroscopic methods. According to fluorescence spectra and UV-Vis absorption spectra, CQDs quenched the intrinsic fluorescence of HSA by forming non-fluorescence complexes. Calculation results of binding constant ( KA) and the number of binding sites ( n) showed that there was only one binding site for CQDs on HSA, and synchronous fluorescence spectrum and binding sites competition experiment revealed this binding site was close to the only tryptophan residuein HSA, which located in ⅡA subdomain of protein. Based on Förster resonance energy transfer (FRET) theory, binding distance r between CQDs and HSA was calculated to be 2.89 nm, which is less than 8 nm, indicating that there was a high possibility of fluorescence quenching caused by non-radiative energy transfer between CQDs and HSA. From the calculated thermodynamic parameters, it can be inferred that hydrogen bonds and van der Waal’s force played an important role in the interaction of HSA with CQDs. According to the results of resonance light scattering(RLS) spectra, three-dimensional fluorescence spectra and circular dichroism (CD) spectra, CQDs could change the secondary and tertiary structure of HSA, causing α-helix conformation content of protein increase, promoting HSA further curling and folding, making hydrophobicity of microenvironment around tryptophan residue increase. Structural changes further affected the aggregation state and some physiological functions of protein, resulting in the decrease of the aggregation degree and esterase-like activity of HSA and a slight improvement of its free radical scavenging ability. This work can provide a reference for the evaluation of biological and environmental safety of nanomaterials, and it also provides a relatively systematic set of spectral analysis methods for exploring the interaction between nanoparticles and proteins.
纳米材料的生物学效应及其应用的安全性越来越受到人们的重视, 目前已发展成为一门名为“ 纳米毒理学” 的新学科。 纳米材料的接触途径主要包括: 口鼻吸入、 皮肤接触; 生物医学方面的注射、 服食等[1]。 血清白蛋白是生物体内含量最丰富的蛋白质之一, 也是研究广泛、 结构明确的一种典型蛋白质。 目前, 科学家研究最多的白蛋白是人血清白蛋白(HSA)和牛血清白蛋白(BSA), 它们是血浆中重要且含量丰富的载体蛋白[2]。
碳量子点(CQDs)作为一类新型碳纳米材料, 具有光学性能良好、 稳定性好、 制备成本低等优点, 在传感、 催化、 医疗等多个领域均有巨大的应用潜力[3]。 然而, 应用的增加也导致其面临的生物安全性问题随之而来。 近年来, 由于已知的纳米颗粒可能改变蛋白质的结构和功能这一特征, 蛋白质-纳米颗粒相互作用所产生的影响已在纳米医学和纳米毒理学领域得到广泛探究, 这是纳米材料生物毒性研究的重要基础[4]。 目前, 有关金属纳米材料与蛋白质之间相互作用的研究已有很多报道, 但对于碳纳米材料的研究相对较少[4, 5]。 因此研究毒性相对较弱的CQDs与HSA之间的相互作用, 探究其作用机制及可能存在的毒性效应十分必要。
通过荧光光谱、 紫外-可见吸收光谱、 圆二色谱等手段及一些生化实验对体外CQDs与HSA之间的相互作用以及相互作用对HSA结构和生理功能的可能影响进行探讨, 通过光谱学方法评估环境中CQDs对生物大分子的潜在毒性效应。
F-2500(HITACHI, Japan)荧光分光光度计; Cary Series(Agilent, USA)紫外-可见分光光度计; FL-SP920(Edinburgh Instruments, UK)荧光光谱仪用于荧光寿命的测定; J-815(JASCO, Japan)圆二色谱仪。
HSA(Sigma公司, USA); CQDs为实验室自行制备; 保泰松(phenylbutazone)、 乙酸对硝基苯酯(pNPA)、 硫黄素T(Th T)、 新亚铜试剂、 CuCl2、 Ellman试剂(阿拉丁公司, 中国); 布洛芬(ibuprofen)(麦克林, 中国)。 实验所用试剂均为分析纯, 且使用前未经过进一步纯化。 实验用水均为超纯水。
1.2.1 CQDs的制备
根据文献通过水热法制备得到CQDs[6], 并检测其中各元素含量占比以确定CQDs的大致分子量, 从而计算其摩尔浓度。
1.2.2 储备液制备
配制0.02 mol· L-1, pH≈ 7.4的Tris-HCl缓冲溶液(含0.1 mol· L-1 NaCl溶液)。 称取一定量HSA, 用缓冲液配制浓度为2.0× 10-5 mol· L-1的HSA储备溶液, 于4 ℃冰箱保存。
1.2.3 荧光光谱
比色管中加入一定体积HSA, 然后加入不同体积CQDs储备液, 用缓冲液定容至刻度, 使溶液中CQDs最终浓度为0, 0.27, 1.08, 2.71, 5.42, 10.84, 16.27, 21.69, 27.11× 10-6 mol· L-1。 激发波长为285 nm, 激发和发射狭缝均为10 nm, 扫描295~500 nm范围内的发射光谱。 为消除内滤效应, 使用式(1)对荧光强度F进行校正[7]。
其中Fobs和Fcor分别为校正前后的荧光强度, Aex和Aem为混合体系在激发和发射波长处的吸光度。
在波长差Δ λ 为15和60 nm条件下分别扫描260~310和250~300 nm波长范围内的同步荧光光谱。
以激发波长280 nm, 发射波长340 nm检测HSA荧光寿命, 所得时间分辨荧光光谱根据多指数衰变函数关系[式(2)]进行拟合[8], i值一般取2。
$I(t)=\sum_{i}A_{i}e^{-t/\tau_{i}}$(2)
三维荧光测定时激发波长扫描范围在200~450 nm, 发射波长为200~500 nm。
在λ ex=λ em的条件下测定220~700 nm波长范围HSA的共振光散射光谱。
1.2.4 紫外-可见吸收光谱
溶液配制同1.2.3, 以缓冲溶液为参比扫描200~400 nm波长范围的吸收光谱。
1.2.5 圆二色谱
扫描波长范围190~260 nm时HSA的圆二色光谱, 平行扫描三次求其平均值。
1.2.6 HSA生理功能测定
1.2.6.1 类酯酶活性测定
将HSA与不同浓度CQDs混合培养30 min, 然后加入pNPA, 于400 nm处测定反应产物吸光度。
1.2.6.2 自由基清除能力测定
操作同1.2.6.1, 将pNPA(乙酸对硝基苯酯)改为Ellman试剂, 室温下混合培养, 测定体系在412 nm处的吸光度。
荧光光谱是研究蛋白质与小分子相互作用的重要手段, 可帮助理解HSA与CQDs结合的作用机制。 HSA的内源性荧光主要源于其组分中的色氨酸(Trp)和酪氨酸(Tyr), 且其分子结构中仅含有一个色氨酸(Trp-214), 位于蛋白质Ⅱ A亚结构域的疏水腔中[9]。
2.1.1 荧光猝灭机制
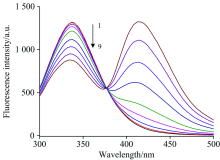
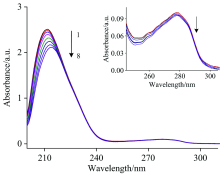
图1显示了随着CQDs浓度增加HSA荧光光谱的变化。 可以看出, CQDs会引起HSA的荧光猝灭, 且随着浓度增加猝灭程度逐渐增大, 最大发射波长发生338→ 335 nm(3 nm)的蓝移。 由此判断CQDs与HSA发生了相互作用, 导致蛋白质氨基酸残基所处微环境发生一些改变。
荧光猝灭通常包括动态、 静态以及动静态结合猝灭机制[10], 其中动态猝灭由激发态荧光分子与猝灭剂之间扩散碰撞导致, 而静态猝灭则由荧光团与猝灭剂结合形成无荧光复合物引起。 通过Stern-Volmer方程对其进行描述[7, 9]
其中, F0与F分别为猝灭剂加入前后体系的校正荧光强度, Kq为猝灭速率常数, Ksv为Stern-Volmer猝灭常数, [Q]为猝灭剂浓度, τ 0为无猝灭剂时生物大分子的平均寿命(一般取10-8 s)。 猝灭机制可根据Ksv对温度的不同依赖关系以及蛋白质荧光寿命的变化加以判断。 温度升高会导致扩散碰撞粒子数增加, 使蛋白质荧光寿命减小, 动态猝灭常数增大, 但猝灭过程的最大扩散碰撞速率常数不会超过2.0× 1010 L· mol-1· s。 发生静态猝灭时, 升高温度会降低所形成复合物的稳定性, 荧光寿命基本不变, 但猝灭常数将减小[11]。 为判断猝灭机制, 做不同温度下F0/F对[CQDs]的Stern-Volmer曲线, 结果见表1。 曲线线性关系良好且随温度升高斜率减小, 由此判断猝灭过程主要为静态猝灭。 且所得猝灭速率常数均大于动态猝灭的最大扩散碰撞速率常数, 同样表明猝灭机制属于静态猝灭。
| 表1 不同温度下HSA-CQDs体系的猝灭常数(Ksv)和猝灭速率常数(Kq) Table 1 The Stern-Volmer quenching constants (Ksv) and quenching rate constants (Kq) of HSA-CQDs system at different temperatures |
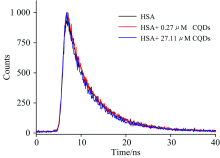
蛋白质荧光寿命的变化也能有效反映猝灭机制, 图2为不同条件下HSA的荧光衰变曲线。 加入CQDs前后HSA的平均荧光寿命分别4.25, 4.47和4.53 ns, 荧光寿命没有明显改变, 表明CQDs与HSA的猝灭机制属于静态猝灭。
2.1.2 结合常数与结合位点数
根据Scatchard方程计算CQDs与HSA之间的结合常数KA与结合位点数n[7, 9]
式(4)中, F0, F与[Q]的含义与2.1.1中相同, KA为结合常数, n为结合位点数。 计算结果见表2, 随温度升高KA逐渐减小, 符合静态猝灭过程。 n≈ 1, 说明CQDs在HSA上仅有一个结合位点。
| 表2 不同温度下HSA与CQDs相互作用的结合常数(KA)和结合位点数(n) Table 2 Binding constant (KA) and number of binding site (n) for CQDs-HSA interaction at different temperatures |
2.1.3 CQDs与HSA的结合区域
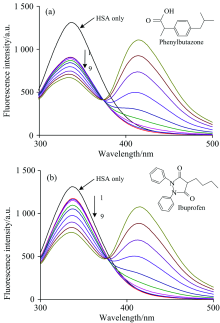
HSA上有两个主要结合位点(位点Ⅰ 和Ⅱ ), 位于蛋白质Ⅱ A和Ⅲ A亚结构域的疏水腔中[12]。 phenylbutazone和ibuprofen对位点I和位点Ⅱ 具有特异性亲和力, 且在HSA的荧光检测范围内它们均不发出荧光[13], 因此实验选用这两种试剂作为位点标志物, 通过竞争结合实验来大致判断CQDs在HSA上的结合位置。 将CQDs逐渐加入到已与分子探针结合的HSA溶液中, 结果如图3(a, b)所示。 可以看出, CQDs的存在仍会导致体系荧光猝灭, 但其对ibuprofen体系的猝灭程度更显著, 这说明ibuprofen对CQDs与HSA结合的干扰小, CQDs在蛋白质上的结合位点更靠近phenylbutazon。 计算加入位点探针后CQDs与HSA之间结合常数的变化, 得到phenlybutazone存在时KA为6.23× 103 L· mol-1, ibuprofen存在时KA为1.28× 104 L· mol-1。 加入phenylbutazone后结合常数明显下降, 说明CQDs会与phenylbutazone竞争HSA上的结合位点Ⅰ , 表明其在HSA上的结合位置更接近蛋白质的Ⅱ A亚结构域。
 | 图3 位点探针对CQDs结合HSA的影响 (a): 保泰松; (b): 布洛芬Fig.3 Effect of the site-specific probes on the binding of CQDs to HAS (a): Phenylbutazone; (b): Ibuprofen |
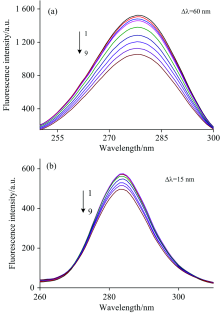
通过HSA的同步荧光光谱, 可进一步判定相互作用的结合位点。 当波长差Δ λ 为60和15 nm时, 分别获得色氨酸和酪氨酸的荧光光谱[5], 结果如图4(a, b)。 色氨酸和酪氨酸的荧光均被CQDs猝灭, 且随着浓度增加, 猝灭程度不断增大。
 | 图4 HSA的同步荧光光谱 (a): Δ λ =60 nm; (b): Δ λ =15 nmFig.4 Synchronous fluorescence spectra of HAS (a): Δ λ =60 nm; (b): Δ λ =15 nm |
但两者相比, 色氨酸荧光猝灭程度更加显著, 由此判断CQDs与HSA的结合位点更接近色氨酸残基。 HSA仅含一个色氨酸, 位于Ⅱ A亚结构域的髓水腔中, 这验证了上述实验的结果。
2.1.4 作用距离
根据Fö rster提出的偶极-偶极非辐射能量转移理论, 当供体的荧光光谱与受体的吸收光谱足够重叠, 且两者之间的距离不超过8 nm时, 就可能发生非辐射能量转移[7]。 HSA的荧光光谱与CQDs的吸收光谱部分重叠, 根据Fö rster非辐射能量转移公式, 对两者之间的作用距离r进行计算。 计算时取向因子K2取平均值2/3, 折射指数n取水和有机物的平均值1.336, Φ 取0.15, 得到J=1.01× 10-15 cm3· L· mol-1, R0=1.74 nm, E=0.045 8, r=2.89 nm。 r< 8 nm, 说明HSA与CQDs之间很可能发生非辐射能量转移, 导致荧光猝灭。
2.1.5 热力学参数及作用力类型
通过计算作用过程的热力学参数, 可以判断参与CQDs与HSA结合过程的主要作用力。 当温度变化较小时Δ H可视为常数, 根据Van’ t Hoff方程[式(5)和式(6)]以lnK对1/T作图, 由曲线的截距和斜率计算出反应的Δ H, Δ S和Δ G, 相应结果列于表3中[12, 13, 14]。 Δ G< 0, 表明HSA与CQDs的结合是自发进行的; Δ H< 0和Δ S< 0, 说明结合过程主要由焓驱动; 根据Ross等[13]总结出的通过热力学参数判断作用力类型的规律, 确定氢键和范德华力是参与结合过程的主要作用力。
| 表3 HSA-CQDs体系的热力学参数 Table 3 Thermodynamic parameters for the HSA-CQDs system |
其中, K为相应温度下的结合常数, R为通用气体常数。
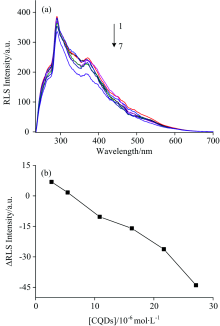
2.2.1 共振光散射(RLS)
散射光强度与粒子尺寸有关, 颗粒尺寸越大散射光越强, 因此RLS可用来研究生物大分子聚集状态的变化[14]。 图5(a, b)为加入CQDs前后HSA的RLS光谱。 可以看出随着CQDs浓度增大, HSA的RLS强度呈现逐渐下降的趋势, 说明相互作用过程中HSA结构发生变化, 蛋白质尺寸减小, 聚集程度下降。
2.2.2 三维(3D)荧光光谱
3D荧光光谱可以较好地反映蛋白质的荧光信息, 了解蛋白质构象变化或结构损伤。 图6(a, b)分别为作用前后HSA的3D荧光光谱(已扣除CQDs的背景荧光), 其中Peak A主要反映与蛋白质三级结构相关的氨基酸残基的光谱信息; Peak B反映的是与蛋白质二级结构相关的HSA骨架结构的荧光特征[9, 13, 14]。 实验发现加入CQDs后, 两荧光峰的荧光强度均明显猝灭并发生蓝移, 其中Peak B荧光猝灭程度更强(见表4)。 根据实验结果得出, CQDs与HSA的相互作用影响着蛋白质的二级和三级结构, 令蛋白质多肽骨架结构发生改变, 导致氨基酸残基周围微环境的疏水性增加。
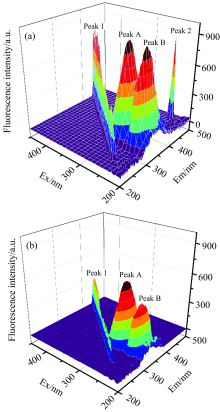 | 图6 HSA及HSA-CQDs体系的三维荧光光谱Fig.6 Three-dimensional fluorescence spectra of HSA (a) and HSA-CQDs system (b) |
| 表4 CQDs-HSA体系的三维荧光特征 Table 4 Three-dimensional fluorescence characteristics of CQDs-HSA system |
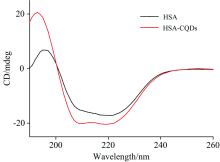
2.2.3 圆二色(CD)光谱
CD光谱常用于研究蛋白质二级结构变化。 HSA的圆二色谱在208和222 nm存在两个负吸收峰, 反映了蛋白质的α -螺旋结构特征[9, 12, 13, 14]。 加入CQDs前后HSA的CD光谱如图7所示, 计算得到HSA二级结构的百分含量。 加入CQDs后HSA在208和222 nm处的吸收峰明显增强, α -螺旋含量由34.1%增加到43.1%, β -拐角由27.2%降至17.3%, 无规则卷曲无明显变化。 α -螺旋增加说明相互作用改变了蛋白质所形成的氢键网络, 导致其卷曲折叠程度增大。
2.2.4 紫外-可见(UV-Vis)吸收光谱
UV-Vis吸收光谱也可用于研究相互作用过程中蛋白质结构变化。 随CQDs浓度增加HSA的吸收光谱如图8所示, 其中在约208 nm有一强吸收峰, 这是多肽骨架结构的特征峰; 在约278 nm处的较小吸收峰, 可提供蛋白质氨基酸残基微环境的相关信息[9, 13]。 可以发现当CQDs浓度增加时, HSA在208 nm处的吸收峰强度逐渐降低, 278 nm处的吸收峰也缓慢减小, 说明相互作用后HSA酰胺键周围微环境受到了干扰, 多肽骨架结构发生改变, 导致氨基酸残基周围微环境也发生变化。 吸收光谱的改变还证明HSA与CQDs之间发生的是静态猝灭, 与2.1.1中的结论一致。
根据以上实验结果, 分析相互作用导致蛋白质二级和三级结构发生改变的可能原因: CQDs由于尺寸较小, 可以通过氢键和范德华力的作用结合到蛋白质Ⅱ A亚结构域的疏水腔附近甚至进入疏水腔中, 从而导致蛋白质α -螺旋含量增加, HSA进一步卷曲折叠, 使得位于Ⅱ A亚结构域中的色氨酸残基所处微环境的疏水性增大。 由于HSA在水溶液中以一种更加稳定的状态存在, 因此通过团聚保持自身结构稳定的程度减小。
蛋白质构象变化可能影响其生理功能, 因此对HSA的重要功能特性进行了检测。
2.3.1 类酯酶活性检测
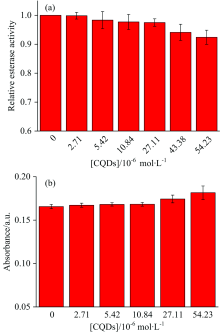
HSA具有类酯酶活性, 可以水解pNPA并产生在400 nm处有最大吸收的对硝基苯酚[15], 通过测定产物吸光度变化即可得到CQDs对HSA类酯酶活性的影响。 如图9(a)所示, 随着CQDs浓度增加HSA的类酯酶活性缓慢下降。 这一结果产生的原因可能是: CQDs的加入导致HSA折叠程度增大, 其结构中一些可水解pNPA的基团不再暴露于蛋白质表面, 因此HSA的类酯酶活性下降。
2.3.2 自由基清除能力
HSA中处于游离状态的半胱氨酸(Cys34), 在自由基清除方面发挥着重要作用[12, 15]。 Ellman试剂可以与游离巯基反应, 生成在412 nm有最大吸收的黄色络合物, 通过检测络合物吸光度变化就可以判断CQDs对HSA自由基清除能力的影响。 图9(b)显示了CQDs含量与产物吸光度之间的关系, 发现在高纳米颗粒浓度下吸光度稍有增强, 表示HSA的抗氧化能力可能有所提高。 这可能是由于高浓度CQDs导致HSA结构发生较大改变, 使得自由巯基与Ellman试剂之间接触机会增加所致。
通过多种光谱手段研究了CQDs与HSA之间的相互作用。 发现CQDs主要通过静态机制猝灭蛋白质的内源性荧光, 且CQDs在HSA上只有一个结合位点, 它接近蛋白质Ⅱ A亚结构域上的色氨酸残基。 氢键和范德华力是参与结合过程的主要作用力。 在CQDs的作用下HSA中氨基酸残基所处微环境的疏水性增强, 二级结构中α -螺旋含量增加, 空间结构更加紧密, 导致HSA的聚集状态和一些生理功能发生改变。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|