作者简介: 王茜蒨, 女, 1970年生, 北京理工大学光电学院教授 e-mail: qqwang@bit.edu.cn
拉曼光谱技术能够提供与物质特定分子结构相关的光谱信息, 可用于识别生物组织微小的生化变异, 具有快速、 实时、 无损、 无需样本预处理等优点, 在临床病理诊断领域极具应用前景。 与常规组织病理学分析相比, 拉曼光谱技术能够直接检测活体组织, 简化了分析程序, 缩短了诊断时间。 人体病变组织的细胞分子组成和结构可能发生变化, 这为拉曼光谱技术在组织病理诊断中的应用提供了检测依据。 基于组织分子组成与结构的差异, 结合机器学习和化学计量学方法, 拉曼光谱技术可以提供客观的诊断信息, 实现快速、 低侵入的病理诊断。 回顾了近十年来拉曼光谱技术在组织病理诊断中的研究进展, 对取得的关键成果进行了总结, 阐述了当前离体和活体应用拉曼光谱技术的一些关键问题。 针对离体拉曼光谱检测, 重点评估福尔马林固定石蜡包埋样本、 冷冻样本和新鲜组织样本等离体样本的适用情况; 阐述拉曼光谱数据收集的关键技术, 包括适用光源、 光谱范围, 以及病理样本光谱采集的方式等。 对于活体拉曼光谱检测, 重点介绍了活体检测研究中拉曼光谱技术应用的两种形式: 结合医用内窥镜进行体内检测, 以及开放手术中的直接检测; 综述了临床适用的拉曼系统, 重点介绍了当前活体拉曼研究中应用的光纤探头。 同时, 文章也讨论了拉曼光谱数据的处理与分析方法, 通过光谱预处理, 特征提取与分类识别, 构建拉曼光谱病理诊断模型, 在小样本范围能够获得较好的诊断结果。 考虑临床实际应用, 仍需要不断优化分析方法, 实现拉曼光谱与生化信息的关联, 将样本个体差异的影响纳入分类模型中, 以提升模型性能。 文章对拉曼光谱应用于病理诊断中的关键问题进行了讨论, 为进一步开展研究提供参考。 未来需要更深入和广泛地开展离体和活体研究, 以促进拉曼光谱技术在临床中的应用。
Raman spectroscopy can provide the spectral information related to the specific molecular structure of the substance, and recognize the tiny biochemical variation of biological tissue. It is a promising diagnosis technology in clinical applications due to the advantages of fast, real-time, non-destructive detection without sample pretreatment. Compared with the routine histopathological analysis, Raman spectroscopy can detect the fresh tissue directly and it may simplify the analysis procedure and shorten the diagnosis time. Some changes may take place in molecular composition and structure of pathological tissues, which provides a theoretical basis for the application of Raman spectroscopy in histopathological diagnosis. Raman spectroscopy may provide the objective diagnosis information and achieve the rapid, low-invasive diagnosis based on the differences of molecular composition and structure between normal and pathological tissues. This paper reviewed the development of Raman spectroscopy for the pathological diagnosis of tissues in the past decade and focused on the crucial results. Some key issues in the ex vivo and in vivo studies of Raman spectroscopy in pathological diagnosis were emphasized. Firstly, for the Raman detection of ex vivo sample, the applicability of several tissue samples, such as formal infixed paraffin-embedded samples, frozen samples and fresh tissue samples, was mainly evaluated; And the emphasis of Ramandata collection in the ex vivo studies of Raman spectroscopy, including applicable laser source, spectra range, and the way of spectra collection were summarized. Meanwhile, we focused on the two application forms of Raman spectroscopy in the detection in vivo, which involved the detection of Raman spectroscopy combined with the medical endoscope, and the direct detection in open surgery. The Raman system suitable for clinical application was also taken into consideration in this review, and the fiber probes used in the current in vivo Raman studies were major. Furthermore, the analysis methods of Raman data were discussed, the pathological diagnosis models, which can provide the excellent diagnosis results in the sample set with small size, have been established through spectral preprocessing, feature extraction, classification and identification. It is necessary to optimize the analysis method to achieve the correlation between Raman spectraand biochemical information and incorporate the effects of individual differences into the classification model to improve the model. In this paper, the crucial issues of Raman spectroscopy in pathological diagnosis were discussed in order to provide a reference for further research. More extensive ex vivo and in vivo studies are required to put the Raman spectroscopy technology into clinical practice.
拉曼光谱是基于拉曼散射效应的分子振动光谱, 能够反映待测物分子振动和转动信息, 识别多组分物质的组成[1, 2, 3]。 拉曼光谱是检测生物组织生化成分的强大工具, 被用于探索各种生物分子的结构[2]。 人体组织重要成分(蛋白质、 核酸、 脂质、 类胡萝卜素等)均有对应的拉曼光谱特征峰, 包含丰富的拉曼信息[4]。 组织发生病变时, 其细胞内的分子组成和结构可能发生变异[4, 5]。 病变组织的某些特征成分变化可以作为拉曼检测的生物标志物[2, 4, 6, 7, 8]。 拉曼光谱技术具有原位、 快速、 操作简单、 样本无损、 无需标记物等优势[9, 10, 11, 12], 在临床应用中得到了广泛的关注, 尤其是在疾病的鉴别和诊断方面[2, 6, 7, 8, 9, 10, 11, 12, 13]。 与常规诊断金标准— — 组织病理学分析相比, 应用拉曼光谱技术, 结合化学计量学和机器学习策略, 能够实现快速和低侵入组织活检, 提供准确、 客观的诊断信息[9, 10, 11, 12]。 从20世纪开始, 已经有许多研究人员开展基于拉曼光谱的疾病诊断研究, 但早期研究受到仪器性能限制, 始终停留在实验室阶段[14]。 随着拉曼仪器技术的发展, 适宜临床应用的光纤探针的使用使得更多体内实验可以被实施[11, 14, 15, 16]。 本文回顾了近十年来拉曼光谱在离体和活体组织病理诊断中的研究进展, 总结关键成果, 讨论拉曼光谱临床应用研究中的关键问题和发展趋势。
离体研究是活体研究及临床应用的基础。 在离体组织拉曼光谱检测中, 对人/动物离体样本进行光谱采集, 将拉曼光谱诊断视为组织活检的一种替代技术[11]。 国内外学者采用拉曼技术对口腔[17, 18, 19, 20, 21, 22, 23, 24]、 乳腺[25, 26, 27, 28, 29]、 宫颈[30, 31, 32]、 消化道[33, 34, 35, 36]、 鼻咽[37, 38, 39, 40, 41, 42, 43]、 脑[44, 45, 46, 47]、 肺[48]、 甲状旁腺[49]及其他一些人体部位[50, 51, 52, 53, 54, 55]的离体病变组织进行了大量研究。 实验人员通过实验室拉曼检测系统收集光谱, 侧重于鉴定不同组织中的化学差异并实现组织的分类。 同时关注样本适用性评估和拉曼光谱数据的收集, 这些问题对拉曼光谱诊断的应用至关重要。
在离体研究中, 采用人/动物切除组织作为拉曼检测的样本, 包括福尔马林固定石蜡包埋(FFPE)、 快速冷冻样本和新鲜组织样本。 表1列出了三种样本各自的优缺点和采用三种样本进行拉曼研究对应的文献。 FFPE样本能够在诊断结果已知的情况下进行回顾性研究[54]。 但是组织的固定可能会影响其生化成分[54], 从而导致拉曼峰变化。 Devpura等[53]对正常组织、 神经母细胞瘤和节细胞瘤组织的FFPE和冷冻组织切片拉曼光谱进行比较, 发现二者之间具有较为显著的差异。 由于组织制备和脱蜡过程消除了一些诊断生物标志物, 不利于组织的分类识别。 因此, FFPE样本分类预测精度低于冷冻组织。 若要使用FFPE样本进行进一步研究, 需要对其制备过程中生化信息的丢失进行深入研究。
| 表1 离体组织拉曼检测中样本的特点分析 Table 1 Analysis of the characteristics of samples in 拉曼 detection of exvivotissue |
冷冻组织更接近鲜活状态, 其拉曼光谱具有良好的信噪比和可重复性[25, 31]。 Wills等对肾上腺冷冻样本和新鲜样本拉曼诊断进行对比和评估[52], 冷冻和解冻过程似乎改变了一些拉曼峰的相对强度。 他们首次证实了从冷冻样本中采集的拉曼数据可以用于新鲜组织的分类, 但是检测准确率低于用新鲜样本拉曼光谱数据建模鉴别冷冻样本。 这或许是由于数据集过小, 作者希望通过收集更多冷冻样本的数据以改善鉴别性能。
拉曼光谱检测的一项优势在于能够直接检测新鲜组织。 然而新切除组织一旦离体, 很难在实验中保持与体内相似的状态, 对微小生化变化的检测可能更加困难[11]。 Krishna团队利用生理盐水在拉曼检测过程中保持组织的湿润, 以模拟临床鲜活组织的状态[56]。 黄伟等人比较了不同存放时间下同一组鼻咽癌组织的光谱变化, 结果表明在2 h内检测获得的拉曼光谱更接近活体状态[37]。 对于新鲜组织拉曼检测, 需要在手术样本切除后立即进行实验以获取接近临床条件的数据[25]。
除组织样本外, Sun等将新鲜鼻咽癌活检组织粘液侧涂在纯铝板上, 整体置于载玻片上进行拉曼测量, 取得了良好的检测效果, 证实了组织涂片拉曼检测的可行性[57]。 拉曼组织涂片检测或许可以提供一种微创/无创的诊断方式。 但涂片涂抹的基底可能影响获取的光谱, 这还需要进行更多的研究。 对于组织检测, 样本也需要放置在一定基底上。 实验中会使用玻片、 铝板、 不锈钢板等作为基底。 Kamemoto等[31]测试了各种透明基底均无法获得理想的结果。 最终使用铝涂层反射镜代替玻片, 具有低荧光背景, 能够对组织进行可见光检测并获得高质量的光谱, 且成本较低。
离体组织拉曼光谱检测通常采用桌面式拉曼系统。 由于生物组织中对光产生主要吸收的分子(如黑色素、 水和脂质等)对近红外光的吸收系数相对较低, 近红外激光源经常被用于医学拉曼测量系统, 尤其是位于生物组织高透光率“ 光学窗口” 的785 nm激光[58]。 与可见光或紫外激发相比, 采用近红外激光激发获取拉曼光谱具有更低的荧光背景[38, 58]。 在当前研究中, 785 nm半导体激光器常常被用作激发光源[17, 19, 20, 28, 29, 30, 31, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 45, 48, 49, 50, 51, 52, 55]。 光通过传输系统照射到样品上, 探测器和光谱仪收集并处理组织样本产生的拉曼信号。 多数研究中采用指纹(FP)区域拉曼光谱(光谱范围800~1 800 cm-1), 该区域提供了丰富的组织生化信息, 如蛋白质、 脂质、 胶原、 核酸等[42], 但易受强烈自发荧光背景和光学元件拉曼散射信号的干扰。 而高波数(HW)区域(2 800~3 700 cm-1)的组织拉曼光谱自发荧光信号远小于FP区域, 且HW区离激发光的波数较远, 有利于滤光和临床应用[42]。 Huang等[42]报道FP/HW-拉曼同时使用, 结果表明对鼻咽癌诊断性能有明显的提升作用。 Palermo等[49]将FP/HW-拉曼应用于离体甲状旁腺腺瘤组织的研究中, 也获得了较好的识别准确率。
尽管是离体实验, 在研究[25, 26, 28, 34]中已经采用光纤探针。 但多数体外实验仍基于透镜和棱镜光学系统将激光传输至样品, 控制样品台移动以检测感兴趣的区域。 其中, 显微拉曼系统被广泛的使用[18, 20, 21, 30, 31, 38, 39, 40, 42, 43, 49, 50, 51, 52]。 组织样本尺寸小且不均质, 并非整个样本均显示病理状态, 只有特定区域获取的拉曼光谱能够代表正常或异常属性。 显微拉曼可将光斑聚焦至微米级, 配合可视化软件灵活的选择检测区域以确保最终获取有效光谱。 对于有效数据获取, 主要采用两种方式: 一是根据病理学家的先验判断, 对组织特定的区域进行拉曼检测; 二是先对组织样本进行拉曼成像, 根据拉曼图像与组织病理学结果对照选择有效光谱[53]。 相比常规采集中将每个组织获取的平均光谱视为该组织的代表光谱, Krishna等[56]将组织样本不同位置获取的光谱作为独立的数据, 这种方式更符合临床实际应用(活检样本上一个部位异常, 样本即被视为异常)。
拉曼光谱技术能够直接应用于活体组织, 无需任何处理且无需注射标记物[9, 10, 11, 12], 因此, 其活体应用一直被广泛关注。 拉曼光谱技术活体研究已经在宫颈[59, 60, 61, 62, 63, 64, 65]、 肺[66, 67, 68]、 胃[69, 70, 71, 72, 73, 74, 75, 76, 77]、 鼻咽[78, 79, 80]、 乳腺[81]、 口腔[82, 83, 84, 85]和脑胶质瘤[86]检测方面得到开展。 研究人员利用临床便携拉曼系统和拉曼探头, 收集活体拉曼数据, 构建诊断模型, 验证拉曼技术在活体检测中的应用。
目前拉曼光谱技术应用于临床活体检测主要涉及两种方式。 一种是拉曼系统结合医用内窥镜, 实现低侵入原位检测, 主要用于内窥镜能够到达的疾病部位[59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80]。 另一种方式则是利用拉曼测量系统直接对活体组织进行检测[81, 82, 83, 84, 85, 86]。 对于第一种方式, Short等[66, 67, 68]在肺部自体荧光支气管镜(AFB)结合白光支气管镜(WFB)成像中引入拉曼点探测, 成功提升了诊断特异性与灵敏度。 Huang等[69]利用已有的白光反射成像(WLI)、 自发荧光成像(AFI)和窄带成像(NBI), 通过成像引导内窥镜拉曼系统获取体内消化道组织拉曼光谱。 基于WLI和AFI引导的鼻咽部内窥镜拉曼检测也已经被实施[79]。 而拉曼直接检测活体组织, 包括口腔乳腺[81], 口腔[82, 83, 84, 85]和脑胶质瘤[86]检测, 可应用于微创活检和开放式手术切除指导。 目前活体拉曼检测研究仍处于起步阶段, 完成了第一阶段的活体光谱收集和后续的模型建立, Duraipandian等[74]进一步提出了全自动在线拉曼光谱诊断框架, 与多模式图像引导相结合用于内窥镜下活体胃部病变检测。
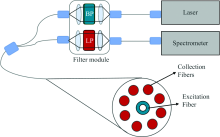
拉曼光谱活体检测依赖于临床适用拉曼系统的开发。 临床拉曼系统应满足体积小、 易于携带、 可消毒、 光传输和采集稳定, 并且探测器对微弱生物信号敏感等要求[58]。 拉曼系统包括激发和检测两部分, 正如在1.2节中所讨论的, 目前活体研究中采用的激发源大部分为785 nm半导体激光器。 对于临床拉曼仪器, 通过发射光纤将来自激光源的激发光传导至感兴趣的组织部位, 再通过收集光纤收集组织的拉曼散射光并将其传导至光谱仪。 尺寸适宜, 能最大限度收集拉曼信号并降低干扰信号的光纤探头是至关重要的。 拉曼光纤探头系统的一般结构如图1所示, 主要由位于中心的发射光纤、 分布在四周的收集光纤以及滤光模块组成。 发射光纤连接激光器用于传导激发激光, 产生的拉曼信号被收集光纤收集耦合至光谱仪。 拉曼信号微弱且容易被各种杂散光, 如瑞利散射、 自发荧光和实验器材的拉曼信号等覆盖。 因此, 光纤选择、 探头顶端结构设计、 滤光膜/片设置和探头后端优化是要解决的关键问题[16]。
Duraipandian等[63, 64]设计了一种手持拉曼探头进行宫颈癌检测。 该探头由镀有带通滤光膜的发射光纤和带阻滤光膜的收集光纤(芯径(200 μ m, NA=0.22)组成。 其顶端装有镀近红外涂层的蓝宝石球透镜, 能够有效减少激光发散[16, 63, 64]。 而Huang团队[69]则开发了直径ϕ 1.8 mm小尺寸光纤探头。 该探头由超低OH二氧化硅光纤束组成, 位于中心的窄带带通滤光(中心波长785 nm)光纤(芯径ϕ 200 μ m)用于激光传输, 周围的32根长通滤光(截止波长800 nm)光纤(芯径ϕ 200 μ m)用于拉曼信号收集和传输, 在尾端部分将收集光纤展开成抛物线弧状耦合到光谱仪的入射狭缝[69, 16]。 这种光纤探头被应用于胃部和鼻咽部内窥镜检测[70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80]。 Short等[66, 67, 68]则采用相似的收集光纤围绕中心光纤布局的拉曼探针, 利用支气管镜的仪器通道研究肺部组织拉曼检测。 在当前的活体研究中, 采用拉曼探头通过内窥镜通道检测或直接检测活体组织, 通过多模式图像引导或医生的目视检查随机选取不同位置的多个测量点, 完成拉曼数据的收集, 随后对照活检结果进行数据筛选。 拉曼光纤探头采集光谱时间已经能控制在几秒以内。 根据不同的检测部位和内窥镜仪器通道优化相应拉曼探头结构, 以及设计耦合多种检测方式的探头, 或许是未来的研究方向。
利用拉曼光谱数据诊断的优势在于能够提供客观和快速实时的诊断信息, 这取决于对光谱数据的分析和处理。 无论是在离体组织还是在活体组织拉曼检测中, 获得拉曼光谱数据后, 首先需要对原始数据进行预处理以改善光谱数据质量。 由于生物组织普遍存在的荧光和散射干扰, 尽管可以通过改进仪器性能降低其影响, 仍需要对拉曼光谱进行荧光和背景去除, 以及噪声抑制和基线校正等常规预处理[11, 58]。 此外, 对光谱进行归一化处理(如光谱面积、 最大值、 平均强度归一化等), 能够降低激发光强度波动带来的影响, 更好地比较不同组织之间的光谱形状和相对峰值强度[38]。
对拉曼光谱的分析主要包括光谱特征提取和组织识别诊断[11]。 光谱数据包含有大量的无效信息, 直接对全谱进行分析可能影响诊断效果, 增加计算成本。 除根据先验知识选择特征峰外, 常通过算法对原始光谱进行光谱特征组合的提取。 而组织的识别诊断则是通过监督多元分析方法构建诊断模型来实现。 文献中主要采用的拉曼光谱分析方法见表2。
| 表2 文献中采用的拉曼光谱分析方法 Table 2 拉曼 spectroscopy analysis methods in references |
其中, 基于支持向量机递归特征消除(SVM-RFE)结合马氏距离(MA)构建诊断模型, 对乳腺癌的诊断效果优于主成分分析(PCA)[28]。 对于临床便携使用的微型光谱仪带来的光谱质量下降问题, 采用自适应网络分析信号(NAS)方法消除非目标参数引起的成分干扰(如噪声、 背景和其他成分干扰等), 通过加权k-局部超平面(ANWKH)区分乳腺癌组织能够获得90%以上的准确率[29]。 PCA结合贝叶斯分类(BC)鉴别鼻咽癌准确率高于PCA-MA和PCA结合线性判别分析(LDA)及遗传算法(GA)结合LDA方法[38]。 Wang等[55]证实利用PCA和k-均值聚类(k-means)能够正确识别所有黑色素瘤样本。 Kanter等[61]采用非线性最大表示和鉴别特征(MRDF)结合稀疏多项式逻辑回归(SMLR)算法, 相较LDA提升了检测正常和不同级别恶性宫颈组织的准确率。 常规使用的算法无法解释光谱关联的生化特征信息。 Haka等[25, 26, 81]将宏观组织光谱与从各组成部分得出的基本光谱的线性组合进行拟合, 由此产生的拟合系数代表每个基础光谱对宏观组织光谱的贡献, 建立了乳腺组织的光谱模型。 结合逻辑回归判别分析构建诊断模型, 可以同时提供高性能的诊断结果以及诊断相关的化学基础信息。 类似的生物分子模型拟合方法被运用到胃部活体检测的研究中[72, 73], 利用所得拟合系数结合递归分割分析, 鉴别正常和恶性组织准确率达到93.7%[72]。
一个快速稳健的诊断模型构建, 往往依赖于包含临床差异足够大的样本集和充分的内部与外部验证[11]。 所谓内部验证是指, 将数据集的一部分用作训练集构建模型, 另一部分用作测试集验证所构建的模型。 对于小样本数据集, 通常采用交叉验证(如留一法交叉验证[11, 27, 34, 35, 36, 37, 40, 41]), 重复训练和测试的步骤, 直到数据集均用于构建模型并进行验证。 外部验证, 即采用新测量的数据集(独立于用来构建模型的第一个数据集)测试构建的模型。 如果缺乏外部验证, 得到的结果可能过于乐观。 Duraipandian等[74]利用PLS-DA诊断模型对全新的10例胃癌患者进行活体检测, 检出率仅为80%。 在对乳腺检测的临床模拟研究中[25], 外部验证集的灵敏度和特异性均低于内部验证。 文献[25]中进一步讨论了诊断差异的来源。 如数据集中疾病流行率和个体差异(如是否经过术前化疗和再切除)对诊断结果(特异性, 灵敏度, 阳性和阴性预测值)的影响。 显然, 实际应用中的复杂情况需要被广泛涵盖在诊断算法中, 临床个体差异性和拉曼光谱对细微生化差异的敏感性, 可能使诊断无法达到理想的效果。 Kanter团队在宫颈活体拉曼检测中, 注意到了激素变化的影响。 受患者月经周期和更年期状态的影响, 不同阶段的正常宫颈组织拉曼光谱显示细微的差异[59]。 他们将这种影响因素纳入诊断算法中, 提升了拉曼检测的总体准确率[59, 60]。 该团队还发现无疾病史患者与有既往疾病史患者的正常组织拉曼光谱存在差异[61], 在统计分析前考虑了各种“ 正常” 状态以提升准确率[62]。 同组的Vargis进一步研究了正常组织光谱类内变化的来源, 在体内研究中将种族、 体重指数和社会经济状况等均纳入调查。 结果表明, 体重指数是正常光谱之间显著的变异源[72]。 而另一针对口腔组织的研究则表明, 年龄可能对恶性和正常组织区分没有显著影响[85]。 个体差异对于拉曼疾病检测的影响, 仍然需要更多的研究进行评估。 将有可能的差异涵盖在诊断算法中, 可以提升诊断模型的稳健和适用性。
概述了拉曼光谱技术在组织病理诊断中的研究进展。 针对离体组织的拉曼检测研究, 证实了拉曼光谱技术作为组织活检替代或辅助技术的应用前景。 而采用光纤探头, 结合多模式成像和内窥镜系统, 或直接应用在切除手术中的拉曼活体检测研究, 进一步缩短了拉曼光谱技术与临床应用之间的距离。 研究人员利用各种多元统计方法构建诊断模型, 在离体和活体组织检测中均得到了较好的诊断结果。 同时关注患者先前疾病与治疗情况, 患者激素个体差异及其他因素对拉曼光谱分类的影响, 以进一步提升拉曼诊断性能。 在未来研究中, 需要(1)将有关病理诊断的重要性能参数标准化[54](当前研究中普遍缺乏阳性和阴性预测值评价); (2)开展更多的体外和体内实验, 以进一步评估可能影响光谱的变量因素, 并将其涵盖在诊断算法中; (3)对诊断模型进行更多的内部和外部验证以提升其适用性与稳健性; (4)改进临床拉曼仪器, 将其与现有的医学系统融合, 结合其他技术形成多模式应用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
|
| [86] |
|