作者简介: 黄晓辉, 1982年生, 福州大学化学学院博士研究生 e-mail: 11429721@qq.com
通过水热法合成两个同构新型锗钨酸化合物[M(phen)3]2[GeW12O40]·2H2O [M=Zn(1), Co(2)]。 属于正交晶系, 空间群为Pnma, 配体与簇阴离子间的氢键构成二维层状结构, 层与层之间通过配体邻菲罗啉(phen)的π…π和C—H…π分子间作用力连结成三维超分子。 利用X射线粉末衍射(PXRD)、 红外光谱(FTIR)、 磁微扰及热微扰下的动态红外光谱(2D-IR COS)和热重分析(TGA)等方法对化合物进行研究。 PXRD显示化合物测试谱图和单晶结构数据模拟谱图主要峰位重合, 峰形基本一致, 表明合成的化合物较纯。 FTIR显示在3 400 cm-1附近出现较宽的吸收峰是 νas(O—H)吸收峰, 在1 650~1 350 cm-1之间出现的峰是phen芳环的骨架伸缩振动峰, 在1 100~700 cm-1出现了饱和Keggin结构4个特征振动吸收峰; 5~50 mT磁场变化下的2D-IR COS显示, 在1 300~1 500和3 000~3 300 cm-1范围内, 化合物1和化合物2出现明显差异, 可能是化合物中过渡金属(Zn(Ⅱ), Co(Ⅱ))造成配体phen苯环中C—C骨架振动伴随C—H…π氢键中 νas(C—H)振动时偶极矩随磁场的变化。 TGA显示失重过程分为3个阶段, 第1阶段主要失去游离的水, 第2阶段失去配位邻菲罗啉, 第3阶段620 ℃后钨氧簇骨架开始坍塌。 探讨了化合物对五种人体肿瘤细胞系(胃癌细胞HGC-27、 SNU668, 肝癌细胞Huh7, 肠癌细胞HCT116、 SW480)的体外抑制作用。 发现两个化合物对这五种人体肿瘤细胞的半抑制浓度IC50都小于100 μmol·L-1, 有机配体和锗钨氧酸簇的协同作用使得化合物1、 2的体外抗肿瘤活性大大增强; 化合物1、 2对于这五种人体肿瘤细胞具有一定的选择性, 两种化合物对肠癌细胞SW480的抗肿瘤活性最高, 对胃癌细胞SNU668的抑制作用最低。 虽然化合物1和2同构, 但是过渡金属的不同, 导致于它们的抗肿瘤活性差别较大, 化合物2对五种人体肿瘤细胞的抑制作用都比化合物1强, 其中化合物2对于肠癌细胞SW480的抑制作用是化合物1的2.7倍, 为进一步研究作为多酸抗癌药物提供方向。
Two Keggin-type polyoxogermanotungstates [M(phen)3]2[GeW12O40]·2H2O (M=Zn (1), Co(2)) were synthesized by hydrothermal method. Compounds 1 and 2 are isomorphic, with the Pnma space group. 2D layers are linked by the hydrogen bonds between ligands and cluster anions. The layers were connected to form a three-dimensional supramolecule by strong molecular inter-atomic forces between adjacent phenanthroline. The compounds were characterized by XRD, FTIR, two-dimensional (2D) correlation infrared spectroscopy under magnetic and thermal perturbation, TG, etc. XRD showed that the spectrum was consistent with the simulation by single crystal structure data, and the main peaks were the same, indicating that the synthesized compound was relatively pure. The FTIR spectrum indicated that the wide absorption peak was νas(O—H)near 3 400 cm-1, the peak between 1 650 and 1 350 cm-1 was the skeleton stretching vibration peak of the aromatic ring, and there was four characteristic stretching vibrations of Keggin cluster anion skeleton in the range of 1 100 to 700 cm-1. Furthermore, the two-dimensional infrared correlation spectroscopy under 5~50 mT magnetic showed that the obvious difference between compound 1 and compound 2 in the range of 1 300~1 500 and 3 000~3 300 cm-1 may be caused by the transition metal (Zn(Ⅱ), Co(Ⅱ)) in the compounds which assigned to the C—C skeleton of phen and C—H…π hydrogen bond varies. TGA showed that the weight loss process could be divided into three stages. In the first stage, the free water was lost, and in the second, the coordinated phen was lost. At last, in the third stage, the framework of the tungsten oxide cluster began to collapse from 620 ℃. Results of the experiment on antitumor activities in vitro showed that two compounds inhibited five different human cancer cell lines (gastric cancer cell line, HGC-27 and SNU668; liver cancer cell line Huh7; and colon cancer cell line HCT116 and SW480) demonstrated dose dependency and selectivity. It was found that the IC50 of the two compounds against the five kinds of human tumor cells was less than 100 μmol·L-1. The synergistic effect of the organic ligand and cluster anions enhanced the antitumor activity of compounds 1 and 2 compared to unmodified POM. The two compounds showed the highest antitumor activity against colon cancer cell SW480 and the lowest inhibitory effect against gastric cancer cell SNU668. Although compounds 1 and 2 isomorphisms, the transition metal is different, lead to varying widely in their antitumor activity, compound 2 the inhibitory effect of five kinds of human tumor cells better than compound 1, the compound 2 for inhibition of colon cancer cells SW480 was 2.7 times than that of compound 1. The varied antitumor potencies of title compounds can provide direction for further research into the development of POM drugs.
多金属氧酸盐(简称多酸)为一类具有广泛用途的金属氧化物簇, 由于其结构的多样性以及在医药和材料科学等领域的潜在应用而受到广泛关注[1, 2, 3, 4, 5, 6, 7]。 在过去的几十年里, 多酸由于其结构和性质的多样性而表现出了良好的生物活性[8, 9, 10, 11]。 目前多酸药物的研究主要集中在功能化的配体引入对多酸抗癌活性的影响[12, 13, 14, 15, 16]。 但是对于过渡金属在多酸化合物中作用研究的较少, 构效关系还不是很明确。
本工作选择Keggin型锗钨氧簇和邻菲罗啉(phen)配体进行组装反应, 合成同构锗钨酸化合物[M(phen)3]2[GeW12O40]· 2H2O [M=Zn(1), Co(2)], 利用X射线粉末衍射、 红外光谱和磁微扰及热微扰下的动态红外光谱等方法, 深入研究化合物的谱学性质与结构的关系; 并利用二维红外光谱, 从分子结构角度探索同构晶体中不同过渡金属对抗肿瘤活性的影响, 为合成抗肿瘤多酸药物提供理论依据。
依次称取K8Na2[A-α -GeW9O34]· 25H2O (0.500 0 g, 0.163 mmol), 1, 10-phen (0.173 2 g, 0.961 mmol), 二水合醋酸锌(0.066 2 g, 0.302 mmol), 置于25.0 mL反应釜中, 加入100 μ L乙二胺、 6.00 mL, 2 mol· L-1 NH4Cl搅拌1 h(溶液的最终pH 8.91), 混合均匀, 于140 ℃下恒温加热5 d后, 冷却至室温。 洗涤后得到浅粉色块状晶体(按钨计算产率约为37%)。
化合物2的合成条件和化合物1的条件一样, 只是将醋酸锌换成四水醋酸钴(0.075 1 g, 0.302 mmol), 最后得到棕色块状晶体(按钨计算产率约为23%)。
用Rigaku Saturn 724 CCD衍射仪对化合物进行X射线单晶衍射测定, 用Rigaku UltimaIV X-Ray Diffractometer粉末衍射仪对化合物进行X射线粉末衍射测定。 用Thermo Scientific Nicolet iS50 FT-IR傅里叶变换红外光谱仪在4 000~400 cm-1范围扫描32次测定化合物的红外光谱, 此外, 在热微扰和磁微扰下分别测试动态红外相关光谱。 热微扰红外光谱测试采用可编程温度控制器, 在50~120 ℃范围内每20 min升温10 ℃; 磁微扰红外相关光谱测定采用自制磁控制器(CT50高斯计标定磁场强度), 磁性变化范围0~50 mT, 测量间隔5 mT。 热重分析利用Mettler Tpledo TGA/SDTA 815e分析仪在Ar气氛保护下测定, 温度区间为25~800 ℃, 升温速度为10 ℃· min-1。
人体癌细胞为福建医科大学消化道恶性肿瘤教育部重点实验室惠赠, 测试是在福建医科大学的Elx800 Universal Microplate Reader酶标仪完成。 根据测量的细胞抑制率利用GradPad Prism 8软件计算化合物作用于细胞的半抑制浓度(IC50值)。
具体实验方法: 细胞在5% CO2、 37 ℃、 饱和湿度、 含有10%的胎牛血清的RPMI-1640培养基中培养。 贴壁细胞以2 000细胞/孔加入96-孔板中, 孵育至贴壁后加化合物。 细胞液体积为90 μ L。 每一组实验设置化合物的最大作用浓度为100 μ mol· L-1。 用不含DMSO的细胞培养液按1: 100稀释母液浓度为100 mmol· L-1的化合物, 之后在含有1% DMSO的培养基中按1/3稀释度逐级稀释化合物, 共设置8个浓度梯度, 以终浓度为0.1% DMSO为阴性对照, 以不含细胞及化合物的培养基为空白对照。 取10 μ L各梯度浓度的化合物加入对应的96-孔板中。 每组实验设置三个平行。 混匀化合物的细胞板置于细胞培养箱中(37 ℃; 5% CO2)培养48 hr。 向每孔细胞中加入10 μ L CCK-8反应液, 混匀后置于细胞培养箱中(37 ℃; 5% CO2)孵育1~4 hr; 采用酶标仪测量450 nm波长下的OD值。
细胞存活率%=1-(OD实验组-OD空白组)/(OD阴性组-OD空白组)× 100%
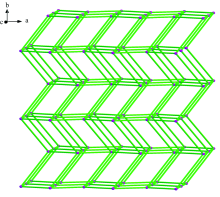
化合物[Zn(phen)3]2[GeW12O40]· 2H2O [图1(a)], [Co(phen)3]2[GeW12O40]· 2H2O [图1(b)]这两个化合物同构, 属于正交晶系, 空间群为Pnma, 最小不对称单元包含1/2个[GeW12O40]4-阴离子, 1个[M(phen)3]2+(M=Zn, Co)阳离子以及1个游离水分子(图1), 其中Ge1的占有率为1/2, W4, W7的占有率为0.5, 其他原子位于一般等效点上。
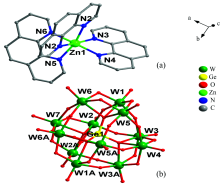 | 图1 化合物不对称单元(省略水分子)对称操作码: A x, 0.5-y, z (a): [Zn(phen)3]2+; (b): [GeW12O40]4-Fig.1 The asymmetric unit of compound 1, symmetry code: A x, 0.5-y, z (a): [Zn(phen)3]2+; (b): [GeW12O40]4- |
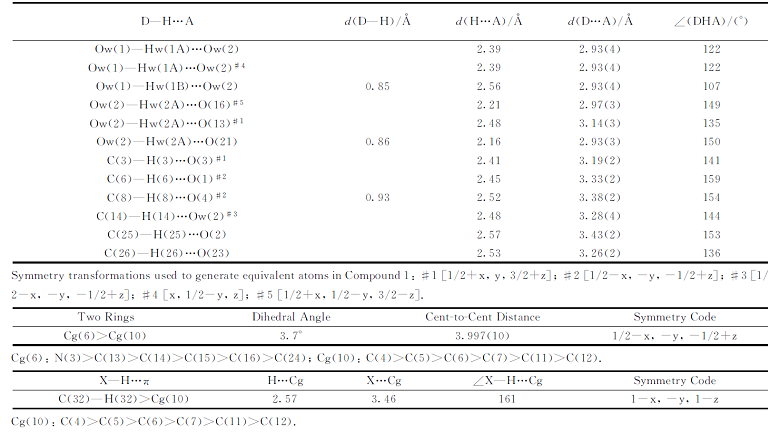
聚阴离子和金属-有机阳离子则通过分子间氢键(Ow(1)…Ow(2), Ow(1)…Ow(2), Ow(2)…O(16), Ow(2)…O(16), Ow(2)…O(13), Ow(2)…O(21), C(3)…O(3), C(25)…O(2), C(26)…O(23))相连接成一维链[图2(b)]。 再通过π …π 和C— H…π 分子间作用力[图2(a)]构筑形成稳定的三维超分子结构。 以[GeW12O40]4-阴离子作为连接点, 通过phen与[GeW12O40]4-之间的弱作用力设置为连接线, 得到sqc4拓扑网络三维超分子结构(图3), 运用TOPOS4.0软件拓扑分析其Schlä fli 符号为{36.418.53.6}。
| 表1 化合物1中弱作用力 Table 1 Parameters of weak interaction for compound 1 |
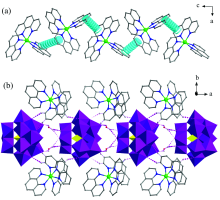 | 图2 (a)化合物1中phen两个芳环间π -π 作用; (b)化合物的一维链(沿a轴方向)Fig.2 (a) The π -π interactions between two aromatic rings from phen in compound 1; (b) 1D chain structure of compound (along a axis) |
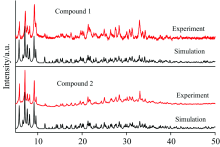
化合物1、 2的X射线粉末衍射图如图4所示, 从对比图可以看出在主要峰位置吻合较好, 由于晶体的各向异性导致了部分衍射峰的强度存在一些差别, 表明所合成的晶体较纯, 可用于其他性质的表征。
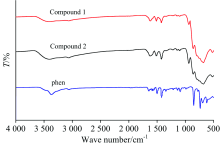
化合物1、 2的红外谱图(图5)基本一致, 这与 X射线单晶衍射及粉末图显示的结果是一致的。 在3 400 cm-1附近出现较宽的吸收峰, 归属为O— H伸缩振动峰, 在3 050 cm-1附近出现的吸收峰是芳环上的C— H伸缩振动峰ν (C— H)。 在1 650~1 350 cm-1之间出现的峰是phen芳环的骨架伸缩振动峰, 与纯phen相比峰红移且峰形变宽, 这可能是由于分子间存在着丰富的C— H…O氢键作用以及phen与金属离子配位后电荷分布倾向不同引起的。 在1 100~700 cm-1范围内出现4个特征振动吸收峰, 分别Keggin簇阴离子骨架的伸缩振动ν as(Ge— Oa), ν as(W=Od), ν as(W— Ob— W)和ν as(W— Oc— W)峰, 化合物和配体的红外峰归属见表2。
| 表2 化合物和配体的红外峰归属 Table 2 The FTIR of compound and ligand |
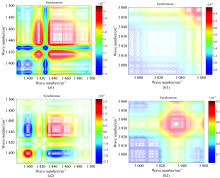
在50~120 ℃热微扰下两个化合物的2D-IR COS同步图基本一致, 与两个化合物是相同构型的结构解析结果相一致。 然而两个化合物在5~50 mT磁场变化下的2D-IR COS同步图差别较大, 如图6所示: 在1 300~1 500 cm-1范围内, 化合物1分别在1 302, 1 418, 1 427和1 435 cm-1处出现自动响应峰, 其中1 435 cm-1处的响应峰最强, 1 418 cm-1的响应峰次之, 1 427和1 302 cm-1处则较弱。 化合物2则在1 401, 1 427和1 432 cm-1处出现响应峰, 其中1 401 cm-1处的响应峰最强, 1 435 cm-1的响应峰次之, 1 427 cm处响应峰最弱; 这些响应峰归属为phen苯环C— C骨架振动的在磁场微扰下的响应峰[图6(a1), (a2)]; 这可能是在化合物1中过渡金属Zn(Ⅱ )为d10组态没有未成对电子; 在化合物2中过渡金属Co(Ⅱ )为d7组态, 含有未成对电子, 磁性粒子Co(Ⅱ )与phen配位时, 未成对电子导致配体phen苯环中C— C骨架振动时瞬间态偶极矩随磁场变化而发生变化。 化合物1在(1 340, 1 418) cm-1, (1 418, 1 450) cm-1处出现正的交叉峰, 表明在磁微扰下, C— C对称伸缩和反对称伸缩的偶极矩变化趋势相同。 化合物2则在(1 400, 1 418) cm-1处出现正的交叉峰, 但在(1 400, 1 440) cm-1处出现的交叉峰是负的, 表明在磁微扰下, C— C对称伸缩的偶极矩变化趋势相反。 化合物1和化合物2交叉峰的差异也表明化合物中金属离子[Zn(Ⅱ ), Co(Ⅱ )]与苯环的离域π 键作用不同, 从导致在磁微扰下芳环C— C对称伸缩振动偶极矩变化的同步性发生变化。 在2 900~3 060 cm-1范围内, 化合物1在3 055 cm-1处出现响应峰[图6(b1)], 化合物2在3 035 cm-1处出现响应峰, 归属于ν as(C— H)振动的响应峰[图6(b2)], 这是可能由于化合物2中磁性粒子Co(Ⅱ )与phen配位, 磁性粒子Co(Ⅱ )中未成对电子对苯环的离域π 键产生作用, 使得C— H…π 氢键中ν as(C— H)振动的瞬间态偶极矩发生变化。
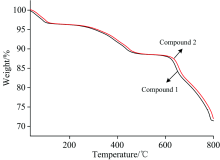
化合物1和2热重分析图基本一致(图7), 失重过程分为3个阶段, 第一阶段失重区间为50~110 ℃, 化合物1失重2.18%, 对应于2个游离水的失去(理论失重0.87%); 化合物2失重2.33%, 对应于2个游离水的失去(理论失重0.89%), 实验值稍高于理论值可能是因为晶体粉末放置于空气中太久吸潮造成的。 其第二阶段失重区间为240~450 ℃, 化合物1失重12.77%(理论失重13.12%); 化合物2失重12.95%(理论失重13.16%); 对应于3个邻菲罗啉分子的失去; 第3阶段失重化合物1在620 ℃后、 化合物2在630 ℃后, 钨氧簇骨架开始坍塌。
为了探索化合物抗肿瘤活性的差异, 选取了五种人体肿瘤细胞系(胃癌细胞HGC-27、 SNU668, 肝癌细胞Huh7, 肠癌细胞HCT116、 SW480)分别测试了化合物对它们的抑制作用。 图8表示不同浓度下化合物对五种癌细胞的抑制作用, 在高浓度下, 化合物对细胞生长的抑制作用比较明显。 与此同时, 对K2NaH[GeW12O40]· 7H2O[16]、 phen、 醋酸锌和醋酸钴进行了测试, 通过最小二乘法拟合出不同细胞的半抑制浓度IC50, 结果见表3。
| 表3 化合物1, 2对5种人体癌细胞的半抑制浓度IC50 Table 3 IC50 values of Compound 1, 2 against diverse human cancer cells |
从表3中发现两个化合物对这五种人体肿瘤细胞的半抑制浓度IC50都小于100 μ mol· L-1, 对比有机配体, 金属盐和K2NaH[GeW12O40]· 7H2O, 化合物1和2的IC50小了很多, 由于有机配体和无机多酸的协同作用使得化合物1和2的体外抗肿瘤活性大大增强[17, 18]; 化合物1和2对于这五种人体肿瘤细胞具有一定的选择性, 两种化合物对肠癌细胞SW480的抗肿瘤活性最高, 对胃癌细胞SNU668的抑制作用最低。 虽然化合物1和2同构, 但是过渡金属的不同, 导致于它们的抗肿瘤活性差别较大, 化合物2对五种人体肿瘤细胞的抑制作用都比化合物1强, 其中化合物2对于肠癌细胞SW480的抑制作用是化合物1的2.7倍; 磁微扰下2D-IR COS同步图表明这两个同构化合物由于过渡金属[Zn(Ⅱ ), Co(Ⅱ )]含有的未成对电子不同, 导致它们对配体phen苯环中的离域π 键作用不同, 化合物2中Co(Ⅱ )含有未成对电子, 容易与含有顺磁电子的官能团(如自由基等)作用[19, 20], 从而导致化合物2抗肿瘤活性比化合物1的强。 显示了这两种化合物在抗肿瘤药物方面潜在应用前景, 为进一步研究作为多酸抗癌药物提供方向。
通过水热法合成新型锗钨酸化合物Zn(phen)3]2[GeW12O40]· 2H2O (1), [Co(phen)3]2[GeW12O40]· 2H2O (2)。 两个化合物同构, 同属于正交晶系, 空间群为Pnma, 阴离子簇和配体间通过氢键、 π …π 和C— H…π 分子间作用力连结成三维超分子。 虽然两个化合物的结构相同, 但由于[Zn(Ⅱ ), Co(Ⅱ )]含有的未成对电子不同, 磁微扰下2D-IR COS同步图表明这两个同构化合物由于[Zn(Ⅱ ), Co(Ⅱ )]含有的未成对电子不同, 导致它们对配体phen苯环中的离域π 键作用不同; 也由于结构中此差别, 引起抗肿瘤活性的差异。 如化合物2对五种人体肿瘤细胞的抑制作用都比化合物1强, 其中化合物2对于肠癌细胞SW480的抑制作用是化合物1的2.7倍。 同时抗肿瘤实验表明: 两个化合物对这五种人体肿瘤细胞系(胃癌细胞HGC-27、 SNU668, 肝癌细胞Huh7, 肠癌细胞HCT116、 SW480)的半抑制浓度IC50都小于100 μ mol· L-1, 有机配体和锗钨氧酸簇的协同作用使得化合物1和2的体外抗肿瘤活性大大增强; 化合物1和2对于这五种人体肿瘤细胞具有一定的选择性, 对肠癌细胞SW480的抗肿瘤活性最高, 对胃癌细胞SNU668的抑制作用最低。 进一步研究将为多酸抗癌药物提供方向。
致谢: 感谢清华大学孙素琴教授在二维相关光谱软件分析中提供的帮助。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|