作者简介: 张维方, 女, 1996年生, 河南中医药大学药学院硕士研究生 e-mail: 1689921783@qq.com
中药产地是影响药材质量的重要因素, 不同产地生长环境对中药的生长及代谢产物的累积具有直接影响, 中药材素有道地产区分为非道地产区, 在我国具有悠远历史, 由于其产地的变迁以及现代主产地的增加, 导致当今药材主产地与历史记录略有出入。 傅里叶变换红外光谱技术具有快速无损的优点, 红外光谱可完整地将不同产地地黄的信息表达, 结合化学计量学将红外光谱所体现的信息数字化。 该工作运用傅里叶变换红外光谱仪采集不同产地地黄红外光谱, 对原始光谱进行基线校正、 平滑点数6个、 选取900~1 200 cm-1波段进行最高峰归一化等预处理, 对每个产地红外光谱各主要特征峰的相对峰强度进行计算, 采用正态分布、 聚类(CA)和主成分分析(PCA)比较其质量差异, 地黄的产地鉴别对中药的合理应用具有科学意义。 结果表明采用傅里叶变换红外光谱法采集73批不同产地生地黄的红外图谱, 73批不同产地地黄红外光谱指纹图谱峰形、 峰位、 峰高基本相似, 不同产地地黄中含有相同的化学成分, 其特征峰、 形状基本一致, 其中河南产地的地黄有个别特征峰的高度突出, 指纹区存在一定差异, 差异主要贡献波段为: 1 639, 1 424, 1 354和1 260 cm-1, 共标定13个共有峰。 聚类分析可将73批地黄样品分为河南产的怀地黄和其他地黄两类, 表明不同产地地黄存在内部质量差异; 正态分布与聚类分析结果一致, 在1 639 cm-1处, 河南产的怀地黄与其他省份的正态分布曲线交叉依次为: 山东省>山西省>河北省, 此方法能有效将道地药材与非道地药材区分开; 对所得的共有峰相对峰强度进行降维处理, 并计算不同产地地黄的主成分综合得分, 结果显示河南产怀地黄得到综合得分均高于其他产地的地黄, 表明河南产的怀地黄质量最佳。 傅里叶变换红外光谱结合多元统计分析方法可以无损、 有效、 快速的鉴别不同产地地黄。
The place of origin of Chinese medicine is an important factor affecting the quality of medicinal materials. The growth environment of different places of production directly impacts the growth of Chinese medicine and the accumulation of metabolites. Chinese medicinal materials are known for the difference between authentic and non-dao regions, and they have a long history in China. The change of its production area and the increase of modern main production areas have resulted in slight discrepancies between the main production areas of current medicinal materials and historical records. Fourier transform infrared spectroscopy technology has the advantages of being fast and non-destructive. Fourier Transform Infrared spectroscopy is characterized for its high speed and non-destruction. Infrared spectroscopy can completely express the information on different origins of Rehmannia glutinosa. Combined with chemometrics, FTIS can also express the digitization of information embodied in infrared spectroscopy. It can collect different Infrared spectroscopy of Rehmannia glutinosa by using Fourier transform infrared spectrometer. The original spectral data can be preprocessed like baseline correction of the original spectrum, 6 smoothing points, selection of 900~1 200 cm-1 band for highest peak normalization and so on. Moreover, FTIS can calculate the relative peak height of the main characteristic peaks of the infrared spectrum of each origin. FTIS is trying to put up quality differences with normal distribution, clustering (CA) and principal component analysis (PCA). In addition, the identification of the origin of Rehmannia glutinosa has scientific significance for the rational application of Chinese medicine. The results showed that the infrared spectra of 73 batches of Rehmannia glutinosa from different origins were collected by Fourier transform infrared spectroscopy. The peak shape, peak position and height of the fingerprints of 73 batches of Rehmannia glutinosa from different origins were basically similar, and the same chemical components were contained in different origins. The characteristic peaks and shapes are basically the same. Rehmannia glutinosa produced in Henan has prominent heights of individual characteristic peaks, and there are certain differences in fingerprint areas. The main contribution bands for the differences are: 1 639, 1 424, 1 354 and 1 260 cm-1. Four bands, a total of 13 common peaks are calibrated. Cluster analysis can divide 73 batches of Rehmannia glutinosa samples into two types, namely Huai Rehmannia glutinosa produced in Henan and other Rehmannia glutinosa, which indicates that there are internal quality differences in different origins of Rehmannia glutinosa. The normal distribution is consistent with the cluster analysis results. It showed that at the peak of 1 639 cm-1, the normal distribution curves of Huai Rehmannia glutinosa produced in Henan and other provinces are in order as follows: Shandong, Shanxi, Hebei. Therefore, this method can distinguish authentic medicinal materials from non-authentic medicinal materials well. It can reduce the dimension of the relative peak height of the resulting common peaks. And it can calculate the principal component composite scores of different origins of Rehmannia glutinosa. The results showed that the comprehensive scores of Rehmannia glutinosa produced in Henan were higher than those of other origins, indicating that the quality of Rehmannia glutinosa produced in Henan was the best. Fourier transform infrared spectroscopy combined with multivariate statistical analysis methods can non-destructively, effectively and quickly identify different origins of Rehmannia glutinosa.
中药地黄为玄参科植物地黄(Rehmannia glutinosa Libosch.)的新鲜或干燥块根[1]; 始载于《神农本草经》, 被列为上品, 具有补血滋阴、 清热生津、 凉血止血、 益精填髓等功效[2]。 生地黄是将地黄新鲜或干燥块根缓缓烘焙至约八成干所得, 生地黄性味甘、 寒, 归、 心、 肝、 肾经, 具有清热凉血, 养阴生津等功效, 用于温毒发斑、 热入营血等症。 地黄主要产于河南、 山东、 山西、 河北等地, 由“ 今人惟以怀庆地黄为上, 亦各处随时兴废不同尔” 等本草考证可知, 河南作为地黄道地产区的地位没有动摇, 故河南产地黄亦称为怀地黄, 是我国著名的“ 四大怀药” 之一, 主产于河南温县、 博爱、 武陟、 沁阳、 孟州等地[3]。 目前多运用HPLC技术对于地黄化学成分和质量进行定性和定量鉴别[4], 此方法需要复杂的样品前处理且周期较长, 而傅里叶变换红外光谱法, 避免了复杂的样品前处理, 最大限度保留药材的原始信息, 可以实现对药材的快速、 无损检测[5]。
中药是复杂的混合物体系, 其红外光谱图呈现出混合物体系中其各种成分的叠加谱, 在同一峰位处, 每种成分中只要具有相同的基团或者官能团, 都会在此峰位处有一定的吸收[6]。 因此, 光谱图中的每个峰, 都不仅代表一种物质, 而是多种物质的叠合峰, 此光谱图也就构成了图谱的宏观“ 指纹” 性, 同时也具有整体性特点, 凭借其整体宏观“ 指纹” 性特征, 可直接或间接进行中药的鉴定鉴别与质量评价[7]。 IR光谱具有整体性, 客观性和科学性, 可全面反映药材质量, 化学计量学可以数字化的表达光谱信息, 两者结合可更加客观地评价中药材的质量[9]。 本研究采用红外光谱技术, 建立不同产地生地黄的红外指纹图谱, 结合正态分布分析、 聚类分析(CA)和主成分分析(PCA)鉴别不同产地生地黄, 为快速鉴别地黄、 控制质量提供参考。
傅里叶变换红外分光光度计为Spectrum 100 型(美国Pekin Elmer公司); 红外分析采用Spectrum for window3.02软件; 粉末压片机为FW-4A型(天津市拓扑仪器有限公司); FW-100型高速万能粉碎机(北京科伟永兴仪器有限公司); 101-3AB型点热恒温鼓风干燥箱(北京中兴伟业仪器有限公司); ME204E/OL型万分之一天平(上海梅特勒-托利多仪器有限公司); 溴化钾(光谱纯, 天津市科密欧化学试剂有限公司); 无水乙醇(分析纯, 天津市致远化学试剂有限公司); 玛瑙研钵。
43批地黄药材(编号: S1—S43), 经河南中医药大学药学院陈随清教授鉴定为玄参科植物地黄(R. glutinosa Libosch.)的干燥块根, 30批河南产地黄药材(编号: S44—S73), 经河南中医药大学药学院陈随清教授鉴定为河南产怀地黄。 取地黄药材样品洗净, 于电热鼓风干燥箱中55 ℃烘干, 样品粉碎, 过200目筛, 放入干燥器中备用。 药材样品信息来源见表1。
| 表1 样品信息表 Table 1 Sample information form |
取样品2 mg与120 mg KBr置于玛瑙研钵研磨均匀, 取适量混合均匀的样品置于专用压片模具中, 以8 MPa压力压制30 s, 压成均匀半透明的薄片, 然后将薄片放置于红外灯下保持样品片干燥, 采用红外光谱仪采集各样品红外光谱图。 光谱范围4 000~450 cm-1, 每张光谱扫描次数16次· s-1, 光谱分辨率为4 cm-1, 扫描速度0.2 cm· s-1, 扫描时扣除CO2和H2O, 室温20~25 ℃, 相对湿度为25%~35%。
将各样品红外原始光谱用Spectrum for window3.02软件进行处理, 分别进行基线校正、 归一化处理并计算红外光谱相对峰高, 以不同产地地黄的相对峰高为原始数据使用SPSS19.0软件对不同产地地黄进行聚类分析及主成分分析。
取不同产地地黄样品按照1.3节压制样品片并扫描其红外光谱。 从不同产地生地黄红外光谱图可看出, 其红外光谱指纹图谱峰形、 峰位、 峰高基本相似, 不同产地地黄中含有相同的化学成分, 所含的特征峰、 形状基本一致, 其中河南产地有个别特征峰的高度突出, 指纹区存在一定差异, 如图1所示。
 | 图1 不同产地生地黄红外透过率叠加光谱Fig.1 Transmittance superposition IR spectrum of Rehmannia glutinosa from different origins |
将各产地地黄样品 原始图谱进行吸光度处理后, 共标定13个共有峰, 如图2所示。 研究表明, 地黄中主要含有多糖、 苯乙醇苷类、 环烯醚萜苷类、 梓醇核苷等成分[8]。 成分以苷类为主, 含量最多的为环烯醚萜苷类。 地黄中的环烯醚萜苷包括: 益母草苷, 桃叶珊瑚苷, 梓醇, 其中梓醇的含量最高。 水溶性成分包括多种糖, 其中以水苏糖含量最高, 为32.1%~48.3%。 同时, 地黄中含有大量的氨基酸。 3 379 cm-1附近强而宽的吸收峰为多糖、 糖苷类甾醇类化合物中羟基O—H键的伸缩振动峰; 2 925 cm-1峰为亚甲基C—H不对称伸缩振动吸收峰, 1 424 cm-1、 1 354 cm-1附近有C—H弯曲振动峰, 说明地黄化合物中含有较多的饱和烷基; 1 740cm-1附近波峰是羧酸类及其酯类等化合物中羰基C=O伸缩振动峰; 1 639 cm-1表征为水的O—H弯曲振动、 酰胺类N—H弯曲振动、 共轭羰基C=O的伸缩振动; 1 260 cm-1可能是C—H弯曲振动和C—O伸缩振动的叠加, 主要为多糖类、 糖苷类、 脂类中C=C骨架C=O—C的伸缩振动峰; 1 151 cm-1处为—COOH弯曲振动吸收峰; 1 051, 996和923 cm-1附近出现由多个峰重叠而成的宽强峰, 归属为糖、 糖苷类等物质C—O键的伸缩振动吸收峰。 生地黄主成分峰最强C—O键吸收在1 051 cm-1处, 其峰形似“ 菩萨身” 特征, 其中1 900~1 750 cm-1表征酯类、 1 700~1 500 cm-1表征酸类、 1 200~950 cm-1表征糖类。
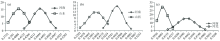
运用Spectrum for window3.02软件将最初得到的红外光谱图由透过率T%转换成吸光度A, 再依次进行基线校正, 因生地黄中糖苷类成分最多, 故选择1 200~900 cm-1波段范围内的最高峰归一处理, 再分别计算特征峰相对峰高, 如图3所示。 得到一系列相关峰相对峰强值, 经过对这些相对峰强度值去除离散值后, 因河南为地黄的道地产区, 对河南产的怀地黄(S44—S73)与其他省份(S1—S43)中各个省份地黄进行比较, 利用正态分布曲线图进行辅助分析, 如图4(a, b, c)所示, 发现在1 639 cm-1处, 河南产的怀地黄与其他省份的正态分布曲线交叉依次为: 山东省> 山西省> 河北省, 因此本方法能很好地将道地药材与非道地药材区分开。
运用Spectrum for window3.02软件将所采集的红外原始光谱由透过率T%转换成吸光度A, 进行自动基线校正, 自动平滑处理。 选择1 200~900 cm-1波段范围内的最高峰的吸光度归一化处理, 计算13个特征峰的峰强度。 以73批不同产地地黄样品的13个特征峰的相对峰强度为原始数据, 将数据输入SPSS19.0软件, 采用组间连接法, 以平方Euclidean距离为分类依据, 横坐标为组间距离, 纵坐标为样品编号, 对样品进行系统聚类分析, 结果见图5。 当组间距离=10时, 各省地黄基本上各自聚为一类, 其中山东省生地黄(S38—S43)与山西生地黄(S9—S37)明显各自聚为一类; 当组间距离=15时, 不同产地生地黄药材可聚为2类, S1—S43聚为一类, S44—S73聚为一类即怀地黄聚为一类, 山西、 山东、 河北等地的地黄药材聚为一类, 说明河南产的怀地黄内部质量与山西、 山东、 河北的地黄药材存在一定差异。
主成分分析是从多个变量之间的联系入手, 利用降维思想, 将多个变量转化为少数几个互不相关、 能反映原始变量信息变量的统计分析方法, 在指纹图谱研究中具有简明、 准确等优点。 以73批地黄样品13个共有峰相对峰强度为原始数据, 运用SPSS19.0软件标准化处理进行降维因子分析, 主成分特征值及方差贡献率见表2, 因前两个因子累计方差贡献率为87.101%> 85%, 充分代表了地黄样品13个共有峰的基本特征和主要信息, 故选取其中特征值大于1的前2个主成分特征值分别为9.398和1.925因子作为主成分1、 主成分2。 由图6可见前2个因子斜率陡峭, 后趋于平缓, 可将前2个因子作为主成分。
| 表2 主成分特征值及方差贡献率 Table 2 Principal component eigenvalues and variance contribution rate |
主成分载荷矩阵反映了各变量对主成分的贡献大小和作用方向, 将各特征向量中心化和标准化后, 73批样品的主成分得分图(图7), 河南产地黄样品与主成分1均呈正相关, 与主成分2大体呈正相关; 山东产地地黄样品与主成分1呈负相关, 与主成分2大体呈正相关; 山西产地地黄样品与主成分1部分呈正相关, 与主成分2均呈负相关; 河北产地地黄样品与主成分1呈负相关, 与主成分2呈正相关。 综合得分计算是以主成分的贡献率为权数对主成分得分进行加权平均, 即: 主成分综合得分=(72.291×主成分1得分+14.810×主成分2得分)/87.101。 对73批地黄样品主成分综合得分进行降序排列, 综合得分越高表明药材质量越好[9]。 如表3所示, 主成分综合得分排序河南产地地黄主成分得分排名最为靠前, 其次为山西运城地黄, 排名最后的为山东产地地黄, 表明地黄质量最好的为河南产区, 山西产区次之, 结合表3、 图7可知对于地黄品质影响较大的为主成分1。
 | 图7 不同产地地黄2个主成分的排序坐标图Fig.7 Ordinal coordinates of two principal components of Rehmannia glutinosa from different origins |
| 表3 主成分综合得分排序表 Table 3 Principal component comprehensive score ranking table |
傅里叶变换红外光谱分析避免了复杂的样品前处理过程, 红外光谱作为分子结构分析方法之一, 是官能团结构解析、 未知物结构鉴定及其伪造掺假鉴别等的重要方法。 红外光谱特征的信息整体性表征复杂混合物体系化学成分的复杂多样性。 根据生地黄的化学成分特征来确定它的主成分特征峰和与其对应的特征波段, 确认具有的特征吸收峰(峰位置、 峰形状以及相对峰高)。 将地黄图谱进行基本处理后, 对1 200~900 cm-1进行归一化处理, 共标定13个共有峰, 对其进行相对峰高的计算后, 发现1 639 cm-1处河南产怀地黄峰高均值> 0.45、 1 424 cm-1处河南产怀地黄峰高均值≥ 0.55、 1 354 cm-1处河南产怀地黄峰高均值> 0.45和1 260 cm-1处河南产怀地黄峰高均值≥ 0.37, 其他产地地黄这四个相对峰高均低于河南产怀地黄, 可以此4个峰高为参考依据来区分怀地黄与其他地黄。
在不同产地中, 河南产的怀地黄与其他省份地黄的图谱比较中, 其光谱图均有“ 菩萨身” 红外特征峰吸收。 但因生长过程中不同的气候、 温度、 湿度、 光照时间、 土壤性质(例如酸碱性等、 施肥、 加工)等条件的影响, 其质量就会存在较大的差异。 1 900~1 750 cm-1(主要为酯类)、 1 700~1 500 cm-1(主要为酸类)和1 200~950 cm-1(主要为糖类)范围内的振动吸收均有差别, 主要就是在同一年限不同产地的条件下, 由于各个地方气候、 湿度、 温度、 土壤性质等等一系列条件的影响, 进而导致各个产地地黄中所含大分子物质酯、 酸、 糖的相对含量各有不同, 最后在红外吸收光谱图中表现出同一峰位处峰的相对强弱。 红外指纹图谱结合正态分布、 聚类分析和主成分分析为地黄的道地性检验提供了便捷的方法, 也为地黄资源的综合开发提供参考。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|