作者简介: 周静, 女, 1993年生, 贵州大学医学院硕士研究生 e-mail: 2693173595@qq.com
采用傅里叶变换红外光谱(FTIR)分析了新鲜野生刺梨果肉、 烘干刺梨果肉以及室温存放数日后刺梨果肉的红外光谱特性。 为对比新鲜果肉与烘干果肉样品中刺梨黄酮的红外光谱特性, 以新鲜野生刺梨果实为研究对象, 分别采用了超声辅助溶剂萃取法和超声结合酶辅助半仿生法提取刺梨黄酮。 并使用无水乙醇作为超声辅助溶剂萃取法的萃取剂萃取刺梨黄酮, 以及使用胃蛋白酶, 胰酶和胆汁等模仿胃肠消化的环境, 在模拟半仿生条件下提取刺梨黄酮。 在两种提取方法中, 新鲜果肉和烘干果肉分别反应了0, 0.5, 1, 1.5, 2和2.5 h。 分别测定了新鲜果肉刺梨黄酮和烘干果肉刺梨黄酮的红外光谱数据。 然后, 通过分析刺梨黄酮的红外光谱特性, 比较了两种方法所提取刺梨黄酮的最佳特征波长组合, 得知在相同的反应条件下, 反应时间为1.5 h时, 超声辅助溶剂萃取法中新鲜果肉与烘干果肉提取物红外光谱对应的透射率强度分别为83.5%和84%; 超声结合酶辅助半仿生法中新鲜果肉与烘干果肉提取物红外光谱对应的透射率强度分别为32%和38%。 因此, 结合郎伯-比尔定律可知, 反应时间相同时, 对于刺梨黄酮的提取, 超声结合酶辅助半仿生法优于超声辅助溶剂萃取法。 除此之外, 我们发现随着反应时间延长, 两种提取方法所获提取物的红外光谱吸收峰强度均呈上升趋势, 但是反应2 h后该提取物的红外光谱吸收峰强度趋于平稳。 结果表明, 刺梨黄酮在3 419 cm-1(羟基O—H伸缩振动)、 1 615 cm-1(羰基C=O键伸缩振动)和1 053 cm-1(烷基)处的红外吸收峰对刺梨的新鲜程度具有较好的识别效果; 通过比较分析, 新鲜果肉与室温存放数日后果肉中的刺梨黄酮物质的红外光谱吸收峰分别与槲皮素和山奈酚吸收峰波数一致; 在相同实验条件下, 两种提取方法中烘干果肉刺梨黄酮提取物浓度均高于新鲜刺梨果肉。 该研究可为刺梨功能化药品和食品的制作及鉴定提供参考。
The fresh, dried chestnut rose (CR) (Rosa roxburghii Tratt) and stored for several days wild CR pulp were analyzed by using the infrared spectral technology of Fourier transform infrared spectrometer (FTIR) at room temperature in this paper. To compare the spectral characteristics of fresh and dried CR pulp, we extracted their flavonoids by the ultrasonic-assisted solvent extraction (UASE) method and ultrasonic combined enzyme-assisted semi-bionic (UCES) method, respectively. Moreover, absolute ethanol was used to extract CR flavonoids in the UASE method for the extraction of CR flavonoids. And then Pepsin, tryps in and bile were used to simulate the environment of enzyme assisted gastrointestinal digestion for the extraction of Flavonoids from Rosa roxburghii Tratt. The Fresh pulp and Dried pulp were respectively reacted for 0, 0.5, 1, 1.5, 2 and 2.5 h in the two extraction methods. First of all, the infrared spectra data of fresh pulp and dried pulp were measured. Then, by comparing the optimal characteristic wavelength combination of the two methods for extracting CR flavonoids, we found that under the same reaction conditions, when the reaction time is at 1.5 h, the transmittance intensities of the infrared spectrum from the fresh CR and the dried CR in the UASE method were 83.5% and 84%, respectively; in the UCES method, their transmittance intensities were 32% and 38%, respectively. Therefore, combined with Lambert-Beer’s law, when the reaction time was the same, the UCES method was superior to the UASE method for extracting CR flavonoids. Besides, with the increase of reaction time, the infrared absorption peak intensity of the two extraction methods showed an upward trend. After being reacted for 2 h, the absorption peak was gradually stable. The results showed that the infrared absorption peaks at 3 419 cm-1 (hydroxyl group O—H stretching vibration), 1 615 cm-1 (Carbonyl C=O bond stretching vibration) and 1 053 cm-1 (alkyl group) of the CR flavonoids could be distinguished. The infrared absorption peaks of flavonoids in fresh pulp and stored at room temperature for several days were consistent with that of quercet in and kaempferol. Under the same experimental conditions, the flavonoids concentration of dried CR was higher than that of fresh CR pulp. This research can provide references for identifying the production of functional medicines and foods of chestnut rose.
刺梨黄酮是一类生物活性很高的小分子化合物, 在植物中广泛存在。 刺梨鲜果中总黄酮含量平均为6.80 mg· g-1, 最高达8.00 mg· g-1, 其含有的儿茶素、 槲皮素、 山奈酚等类黄酮, 对人体健康有益[1]。 已有文献报道对刺梨黄酮的体外抗氧化活性的研究, 发现刺梨黄酮能清除各种活性氧, 并能显著抑制红细胞氧化溶血细胞、 肝组织脂质过氧化产物的形成[2], 除此以外刺梨果实被发现具有抗氧化、 抗诱变、 抗动脉粥样硬化、 抗肿瘤和防辐射活性[3]。 Xu等研究了刺梨类黄酮在抗细胞凋亡性中的作用, 并且证实了其具有防辐射作用[4]。 目前已有许多关于刺梨多糖、 超氧化物歧化酶、 刺梨黄酮等活性化合物质的研究[5, 6, 7], 但直接检测刺梨果肉中黄酮的傅里叶红外光谱少有报道。
由于超声波提取法具有无需专用设备、 操作简单、 节省时间等优点。 超声结合酶辅助半仿生提取法具有提取率高, 准确度好, 快速等优点, 可有效提取植物果实中的黄酮分子。 从而这两种方法可适用于刺梨黄酮的提取[8]。 Liu等[9]采用超声辅助半仿生法, 提取了粟米黄酮, 并对其抗氧化活性进行了研究, 结果表明超声半仿生技术可作为一种简便、 经济的提取粟米草总黄酮的方法。
对刺梨黄酮的鉴别, 传统测定的方法有液相色谱法, 紫外可见光谱分析以及化学显色法, 不仅速度慢、 成本高, 且不适合大批样本测定[10]。 如液相色谱法需要配备的仪器昂贵, 实验所需时间较长, 难以实现刺梨黄酮的快速测定[11]。 傅里叶变换红外光谱(Fourier transform infrared spectrometer, FTIR)是一种基于样品化学键, 分子振动信息的有机物快速分析技术, 具有灵敏度高, 重复性好, 扫描速度快, 低成本等特点, 已在医学, 食品及工业等领域发挥了重要作用[12]。 Kumar等[13]通过FTIR方法分析了决明子中黄酮类化合物的指纹红外光谱, 准确地鉴定出了该植物总群的类别。
本文采用FTIR分析了刺梨黄酮的红外光谱特性, 快速鉴别刺梨黄酮, 为开发刺梨新功能性食品提供思路。
新鲜野生刺梨果(购买于六盘水盘州食品有限公司); HCl(≥ 98%), 胃蛋白酶(1:3 000), 胰酶(USP级), 无水胆酸(98%), NaHCO3溶液(3.7%), NaCl(GR, 99.8%)均购买于阿拉丁化学试剂有限公司, 用于酶辅助半仿生提取法中模拟胃肠消化环境; 无水乙醇(分析纯, 购买于天津市富宇精细化工有限公司)作为超声溶剂萃取法的萃取剂。
高精度电子天平(JM-BL1003, 余姚市纪铭称重设备有限公司), 85-2A双数显恒温磁力搅拌器(金坛市城东新瑞仪器厂), 超声清洗器(ps-30A, 深圳市深华泰设备有限公司), 傅里叶变换红外光谱仪(V70, 德国布鲁克光谱仪器公司), 电热恒温鼓风干燥箱(GZX-9070MBE上海博迅实业有限公司医疗设备厂)。
样品1: 取一新鲜刺梨果, 洗净, 剔刺, 切成透明薄片(厚度约0.5 mm)置于载玻片上待测; 样品2: 取一室温条件下存放48h后的刺梨果, 剃刺切成薄片(厚度约0.5 mm)置于载玻片上待测, 用于与新鲜刺梨果的FTIR对比。
超声辅助溶剂萃取法: 设置三个实验组, 第一组称取40.6 g新鲜野生刺梨果果肉研磨成匀浆后移至烧杯中, 加入150 mL无水乙醇; 第二组称取40.6 g新鲜果肉, 使用电热恒温鼓风干燥箱(GZX-9070MBE), 设置温度150 ℃杀青10 min, 然后45 ℃烘干24 h获得烘干刺梨果肉研磨成粉状移至烧杯中, 加入150 mL无水乙醇。 两组样品置于超声水浴池中, 设置恒温40 ℃, 分别于提取时间0.5, 1, 1.5, 2和2.5 h取上清液待测; 第二组样品用于与新鲜果肉提取黄酮的FTIR对比。 第三组量取烘干果肉组2.5 h的上清液20 mL, 待无水乙醇挥发, 取固体待测, 用于与液体中刺梨黄酮的FTIR对比。
超声结合酶辅助半仿生法: 取等量新鲜果肉与烘干果肉, 研磨成匀浆和细粉分别置于两个烧杯中, 加入60 mL 0.88 g· mL-1的NaCl溶液, 移至容量瓶用0.88 g· mL-1的NaCl溶液定容至120 mL。 设置三个实验组, 每组分别量取新鲜果肉与烘干果肉容量瓶中40 mL匀浆液, 胃消化组在水浴温度达到37 ℃时加入0.2 g胃蛋白酶和6 mL水, 最后用1 mol· L-1的HCl溶液调节pH值为2.0; 胃酸组在37 ℃时用1 mol· L-1的HCl溶液调节pH值为2.0; 肠消化组在1 h胃消化后加入模拟肠液(0.15 g胰酶与1.2 g胆汁溶于0.1 mol· L-1的NaHCO3溶液), 最后用1 mol· L-1 NaHCO3溶液调节pH值为7.5。 将三组溶液分别装入锥形瓶, 在37 ℃避光温水浴中结合超声震荡消化, 于消化时间0, 0.5, 1, 1.5, 2和2.5 h取上清液待测, 用于与超声辅助溶剂萃取法提取的刺梨黄酮的FTIR对比。
采用红外显微镜(H1000, 德国Bruker仪器有限公司)观察刺梨果肉的表面形貌, 新鲜刺梨果肉和室温条件下存放48 h后的刺梨果肉切片表面形貌分别如图1(a)和(b)所示。 随着放置时间的延长, 刺梨果肉表面颜色变黄并变得干瘪。
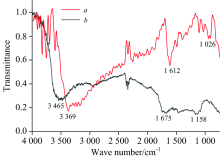
如图2所示为使用FTIR红外反射光谱法所测新鲜刺梨果肉(样品1)与室温存放48 h后刺梨果肉(样品2)的红外光谱。 通过对红外光谱进行分析, 样品1与样品2的红外振动如表1所示。 样品1和样品2分别在3 369和3 465 cm-1处有吸收峰, 此峰为O—H 伸缩振动所产生的吸收峰; 在1 612和1 675 cm-1为C=O伸缩振动而产生的吸收峰; 1 026和1 158 cm-1为烷基吸收峰。 样品1的吸收峰与槲皮素标准品吸收峰的波数一致[14]。 样品2的吸收峰与山奈酚标准品的波数一致, 表明该刺梨黄酮含有山奈酚[15]。 因此, 可根据分析刺梨黄酮的傅里叶红外光谱来为开发刺梨新功能性食品提供思路。
| 表1 新鲜刺梨果肉(样品1)与室温存放48h后刺梨果肉(样品2)红外振动 Table 1 Infrared vibrations study of fresh chestnut rose pulp (sample 1) and chestnut rose pulp stored at room temperature for 48 h (sample 2) |
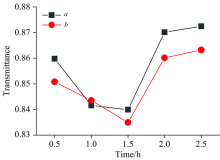
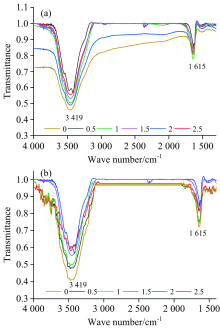
如图3(a)和(b)分别为超声辅助溶剂萃取法新鲜刺梨果肉与烘干果肉样品的红外光谱; 图4中曲线a和b为超声辅助溶剂萃取法新鲜果肉与烘干果肉样品的红外光谱在3 431 cm-1位置处对应的透射率强度。 3 431和3 416 cm-1处的吸收峰是O—H伸缩振动; 由图4透射率强度分析可知, 在相同反应条件下, 烘干果肉在1.5 h时对应的透射率强度为83.5%; 而鲜刺梨果肉对应的透射率强度为84.0%。 根据朗伯-比尔定律, 非吸光性溶剂中单一溶质的红外吸收光谱在任一波数(ν )处的吸光度为
式中, A(ν )和T(ν )分别表示在波数(ν )处的吸光度和透射率; b表示光程长(样品厚度); c表示样品的浓度。 由朗伯-比尔定律可知, 此时烘干果肉的吸收强度高于鲜刺梨果肉, 可见烘干果肉所提取的黄酮浓度高于新鲜果肉。 由于样品量是相同的, 由图4中曲线a和b可知在反应时间为1.5 h时达到最佳提取浓度。 当反应达到1.5 h后, 在1.5~2.5 h反应时间段, 样品中可提取黄酮的量较少。 故, 两组反应物在0~1.5 h的时间段提取的黄酮物质浓度逐渐增加, 在2 h以后有所增加但趋于稳定。
 | 图3 (a), (b)分别为超声辅助溶剂萃取法新鲜刺梨果肉与烘干果肉样品的红外光谱Fig.3 (a) and (b) are the infrared spectra of fresh pulp and dried pulp samples by ultrasonic-assisted solvent extraction, respectively |
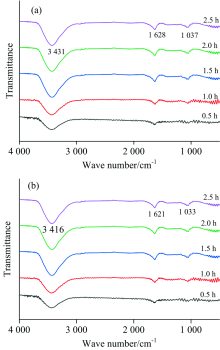
如图5(a)为超声辅助溶剂萃取法所提取黄酮粉末样品在显微镜下的形貌, 如箭头所示提取物为黄色固体粉末状。 图5(b)为该样品的红外光谱图, 在3 419 cm-1位置处为O—H伸缩振动所产生的吸收峰; 1 691和1 632 cm-1处有吸收峰, 存在C=O的伸缩振动; 1 058 cm-1为烷基吸收峰。 该提取物的吸收峰分别为: 3 419, 2 919, 1 691, 1 632, 1 437, 1 370, 1 219, 1 058和925 cm-1, 与山奈酚标准品吸收峰对照, 其红外光谱图各吸收峰的波数一致, 故所提取黄酮为山奈酚[15]。
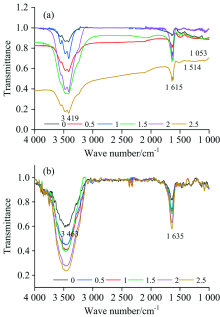
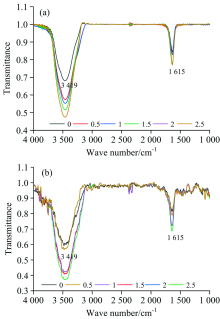
如图6(a)和(b)分别为新鲜果肉与烘干果肉超声结合酶辅助半仿生模拟胃消化提取样品的傅里叶红外光谱图。 图6(a)和(b)分别在3 419和3 463 cm-1处有吸收峰, 存在O—H的伸缩振动; 在1 615和1 635 cm-1处C=O伸缩振动而产生吸收峰; 在1 514 cm-1处C=O或芳环共轭结构而产生吸收峰; 1 053 cm-1为烷基吸收峰。 从图6(a)和(b)的红外光谱可见, 在温度和料液比相同时, 在0~1.5 h阶段, 随着提取时间的延长提取物的吸收峰越来越强, 在1.5 h后变化减弱, 总的提取物浓度是增加的。
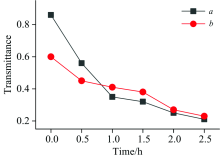
图7曲线a和b分别为新鲜果肉与烘干果肉超声结合酶辅助半仿生模拟胃消化样品的红外光谱3 419 cm-1位置处对应的透射率强度。 由朗伯-比尔定律可知, 随着提取时间的延长, 所获取样品的红外光谱吸收峰不断增强, 说明所提取的黄酮浓度不断增加, 但在2 h后提取物浓度趋于平稳, 说明此时样品中的黄酮大部分已被提取出来。 在较低pH模拟胃消化环境中, 黄酮主要成分之间的基团作用力减弱, 从而促进黄酮的释放。 由图7可知, 在0~1.5 h反应时间段, 新鲜果肉与烘干果肉的透射率强度变化趋势分别为54%和22%, 由朗伯-比尔定律可知, 新鲜果肉的吸收率强度变化趋势大于烘干果肉, 表明胃消化环境下烘干果肉更易于黄酮的快速提取, 此规律可为开发刺梨新功能性食品提供思路。
如图8所示, (a)和(b)分别为新鲜果肉与烘干果肉超声结合酶辅助半仿生胃酸模拟提取样品的傅里叶红外光谱图。 两种样品在3 419 cm-1(羟基)、 1 615 cm-1 C=O键)处有吸收峰。 分析两种样品的红外光谱, 由吸收峰强度的变化可知胃酸环境下烘干果肉较新鲜果肉易于快速提取黄酮。
如图9所示, (a)和(b)分别为新鲜果肉与烘干果肉超声结合酶辅助半仿生肠消化模拟提取样品的红外光谱图。 样品在3 419 cm-1(羟基)、 1 615 cm-1 C=O键)处有吸收峰。 在肠消化0小时的时候其红外光谱吸收峰最强, 表明此时刺梨黄酮浓度最高。 此时由于蛋白质被胃蛋白酶水解后, 与蛋白质共价和非共价结合的黄酮类物质可能被释放出来。 在0~2.5 h阶段, 随着反应时间的延长, 吸收峰逐渐减弱, 该结果表明刺梨黄酮的浓度随着肠消化时间的延长而逐渐降低。 在37 ℃模拟肠消化液作用下, 刺梨中易水解的黄酮类物质发生水解, 随着时间延长样品中黄酮被逐渐提取完毕。 由刺梨黄酮红外光谱的吸收峰强度变化情况可知, 同一条件下烘干果肉的吸收峰强度高于新鲜果肉, 肠消化条件下烘干果肉样品组黄酮的提取变化量高于新鲜果肉样品组, 此规律可用于快速鉴别刺梨黄铜, 为开发刺梨新功能性食品提供思路。
新鲜野生刺梨果肉与烘干果肉中均含有丰富的黄酮类物质, 新鲜果肉中提取黄酮为槲皮素; 室温存放48 h后刺梨果肉中提取黄酮为山奈酚; 烘干果肉中提取黄酮为山奈酚。 此结果表明, 可通过分析刺梨黄酮的傅里叶变换红外光谱特性, 快速鉴识别刺梨黄酮。 由于半仿生法中提取的刺梨黄酮浓度总体增加, 可见刺梨黄酮能在胃肠环境中提取吸收, 从而野生刺梨可作为健康与功能化食品的原材料。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|