作者简介: 滕渊洁, 1983年生, 浙江工业大学化学工程学院讲师 e-mail: yuanjieteng@zjut.edu.cn
将具有拉曼信号的三氢-吲哚菁类(Cy3)染料分子标记农药核酸适配体(Aptamer)制备成拉曼检测试剂(Cy3-aptamer), 对痕量啶虫脒进行了特异性的表面增强拉曼光谱法(SERS)检测研究。 考虑到胶体的稳定和聚凝作用原理, 采用聚丙烯酸钠作为分散剂, 使作为SERS检测基底材料的银溶胶带负电荷, 获得了良好的稳定性和分散性。 由于聚丙烯酸钠分散的银溶胶为负电平衡体系, 测试时需采用聚沉剂, 使具有较高稳定性的银纳米颗粒团聚, 形成SERS增强热点, 从而提高SERS检测信号。 以SERS信号较弱的啶虫脒为探针, 考察了银溶胶中加入不同聚沉剂(NaCl, KCl, NaOH, HNO3, H3PO4, H2SO4, HCl)对SERS信号的影响, 实验结果表明, H+作为阳离子和P
In this work, aptamer modified by Cy3 (1,1’-bis(3-hydroxypropyl)-3,3,3’, 3’-tetramethylindocarbocyanine) dye which has a strong Raman signal, was applied for sensitive and specific detection of trace acetamiprid by Surface-enhanced Raman Scattering (SERS). The good stability and dispersity of negative silver colloid were obtained by adding the proper concentration of sodium polyacrylate according to the principle of colloid stabilization and coagulation. During the detection process, these high stable silver nanoparticles were needed to be agglomerated by using the agglomerating agent to form more SERS enhancement hotspots to improve the SERS intensity. The effects of different agglomerating agents (NaCl, KCl, NaOH, HNO3, H3PO4, H2SO4, HCl) were investigated using acetamiprid as a probe. The results showed that the good SERS effect was showed when the electrolyte precipitator contains H+ and P
农药及残留主要有有机磷、 有机氯、 菊酯和氨基甲酸酯四大类, 同类分子在结构上具有一定的相似性, 这给特定分析检测带来一定的困难。 目前, 国标[1]规定的农药检测方法主要有气相色谱-质谱联用(GC-MS)和液相色谱-质谱联用(LC-MS)等。 在色质联用中, 虽然QuEChERS法[2]可简化前处理过程, 30 min约可处理6个样品, 但色谱分离仍需较长时间, 无法满足现场大批量检测需求。 至于市场上农药残留的快速检测, 虽然有酶标仪、 显色卡、 电化学速测仪等形式, 但检测原理均基于乙酰胆碱酯酶抑制法[3], 即利用农药对乙酰胆碱酯酶的活性抑制来间接判断是否存在农药, 但几乎每种农药均对乙酰胆碱酯酶有抑制作用, 因此存在专一性不高的问题。 从而, 有必要开发一种能够实现特异性的快速检测农药残留分子的方法。
适配体(Aptamer)[4]是指一类经过筛选, 能够特异性结合靶向物质的单链DNA或者RNA。 目前, aptamer在分子检测领域已经发展形成了多种分析手段[5], 如比色法、 荧光法、 电化学法、 拉曼光谱法等, 主要用于检测蛋白、 微生物、 生物毒素、 有机污染物、 重金属离子。 近年来, 阳性克隆筛选方法(SLECTIVE)及活性改造[6]越来越成熟, 但利用aptamer方法进行农药特效性检测相对较少。 目前, 已报道具有aptamer特异性的农药分子有啶虫脒[7]、 莠去津、 马拉硫磷, 丙溴磷[8]及同时检测甲拌磷、 丙溴磷、 水胺硫磷和氧(化)乐果的aptamer[9]等; 但利用aptamer建立的特效性分析方法报道较少, 仅见比色法[10, 11]、 电化学阻抗法[12]、 表面增强拉曼光谱法(surface-enhanced Raman scattering, SERS)等。
选择带负电荷的聚丙烯酸钠作为表面带负电荷的银溶胶的分散剂, 制备了具有良好稳定性和分散性的SERS基底材料。 再通过选择带有正电荷的精胺分子先行中和含磷酸骨架的aptamer上的负电荷, 三氢-吲哚菁类(Cy3)染料分子标记的aptamer (Cy3-aptamer)更易吸附于带负电荷的银溶胶表面, 而产生较强的SERS光谱。 且Cy3-aptamer产生的拉曼强度的变化与啶虫脒浓度存在一定的关系, 从而实现了特异性检测啶虫脒分子的目的。 同时为SERS法利用aptamer特异性快速检测农药分子提供了强有力的实验基础和理论依据。
LabRAM HR UV 800激光显微拉曼光谱仪(法国HORIBA JOBIN YVON公司), 激发光源: 632.81 nm He-Ne激光器; 共焦孔径300 μ m, 光栅线刻数为600 line· mm-1, 物镜: 50倍长焦距镜头。
啶虫脒(分析标准品, aladdin); aptamer啶虫脒: 5’ -TGTAATTTGTCTGCAGCGGTTCTTGATCGCTGACACCA-TATTATGAAGA-3’ (生工生物工程(上海)股份有限公司, 平均分子量15 170.81); Cy3-aptamer: 5’ -Cy3-TGTAATTTGTCTGCAGCGGTTCTTGATCGCTGACACCATA-TTATGAAGA-3’ (生工生物工程(上海)股份有限公司, 平均分子量15 598.34)。 聚丙烯酸钠(平均分子量5 100)、 精胺(98%)、 AgNO3为化学纯。 HNO3、 NaCl、 Na3C6H5O7· 2H2O、 KCl、 NaH2PO4· 2H2O、 NaOH、 无水Na2SO4、 Na2HPO4· 12H2O等均为分析纯。 HCl和H2SO4为优级纯。 pH 7.4磷酸缓冲溶液(0.2 mol· L-1)由NaH2PO4· 2H2O和Na2HPO4· 12H2O混合配制而成, 并含有0.1 mol· L-1的KCl。 水为18.3 MΩ · cm超纯水, 由UP900型超纯水器(韩国HUMAN公司)制得。
Aptamer啶虫脒使用液的配制: 移取 21 μ L磷酸缓冲溶液, 加入到含31.7 μ g Aptamer啶虫脒的试剂盒中, 摇匀得0.1 mmol· L-1 的Aptamer啶虫脒储备液, 再将其逐级稀释成1 μ mol· L-1的标准工作溶液。 同法配制Cy3-aptamer的使用液。
根据Lee和Meisel的方法[13], 称取18 mg AgNO3, 溶解于100 mL水中。 加热至沸, 缓慢加入新配制的1%柠檬酸钠3.0 mL。 剧烈搅拌下继续沸腾10 min, 直到溶液颜色变为灰色。 冷却至室温, 取15 mL银溶胶, 分别加入0.3 mL不同浓度的聚丙烯酸钠溶液, 使合成的银纳米粒子分散在聚丙烯酸钠中以进行稳定性试验选择。 聚丙烯酸钠的浓度为0.05%保存效果最佳, 装入棕色瓶于4 ℃保存, 至少可以保存60 d。
取500 μ L 0.01%聚丙烯酸钠的银溶胶, 500 μ L 80 mmol· L-1不同的聚沉剂(NaCl, KCl, NaOH, HNO3, H3PO4, H2SO4, HCl)和500 μ L 4.886× 10-4 mol· L-1啶虫脒溶液混合均匀, 室温下静置10 min, 比较不同聚沉剂条件下啶虫脒的拉曼增强信号。
Cy3-aptamer与精胺“ 显色” 反应: 取0.1 mol· L-1精胺5 μ L, 1 μ mol· L-1 Cy3-aptamer 100 μ L, 分别反应5, 10和15 min, 再加100 μ L银溶胶和5 μ L 0.16 mol· L-1 聚沉剂, 混匀后测定拉曼信号, 选择精胺与Cy3-aptamer反应的最佳时间。
Cy3-aptamer检测啶虫脒并用精胺“ 显色” 反应: 取100 μ L 1 μ mol· L-1 Cy3-aptamer, 100 μ L 0.5 mmol· L-1啶虫脒溶液, 分别反应5, 10, 20和30 min, 再加入0.1 mol· L-1精胺5 μ L, 反应5 min, 再加入100 μ L银溶胶、 5 μ L 0.16 mol· L-1聚沉剂, 混匀, 分别测定其拉曼信号并比较, 确定Cy3-aptamer和啶虫脒反应的最佳时间。
测定方法: 取100 μ L 1 μ mol· L-1 Cy3-aptamer, 100 μ L 0.25, 0.1, 0.075, 0.05, 0.01 μ mol· L-1 啶虫脒溶液, 反应20 min, 再加入0.1 mol· L-1精胺5 μ L, 反应5 min, 随后加入100 μ L银溶胶、 5 μ L 0.16 mol· L-1聚沉剂, 混匀。 样品置于显微激光拉曼光谱仪的物镜视野下, 调焦后进行增强拉曼光谱测试, 焦点聚焦于溶液表面。 扫描范围200~3 800 cm-1, 光谱采集时间60 s, 积分2次平均。
利用aptamer对特定农药的特异性作用, 以达到分离富集和特效选择的目的。 经多次试验探索建立了测试方法: 由于aptamer本身只有较弱的SERS信号, 特将拉曼信号探针Cy3先与aptamer结合生成Cy3-aptamer, 在精胺存在的情况下能在银溶胶表面产生很好的SERS信号。 当测定农药时, 先将Cy3-aptamer与测试液反应, 此时亦不能产生SERS信号, 只有加入辅助剂精胺后才能测得较强的SERS信号; 当有特定农药存在时, SERS信号会发生减弱。 可以利用不同的aptamer制备不同的Cy3-aptamer, 同时利用不同的农药具有不同的拉曼谱峰可以达到进一步选择性测定的目的; 采用不同的aptamer可以达到有针对性的测定特定的农药, 最终达到针对性强的农药测定方法。
采用对农药啶虫脒具有一定特异性的aptamer, 并通过特殊制备将Cy3标记进入aptamer, 其SERS检测原理如图1。
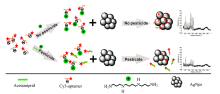 | 图1 Cy3-aptamer用于SERS检测农药啶虫脒示意图Fig.1 Schematic diagram of Cy3-aptamer applied in the specific SERS detection of acetamiprid |
Cy3-aptamer与精胺分子作用, 并吸附于银溶胶表面产生较大的SERS信号; 当溶液中存在啶虫脒时, Cy3-aptamer先与啶虫脒反应, 再加入精胺形成SERS的“ 显色” 反应, 探针分子Cy3-aptamer与精胺结合的分子吸附于银溶胶表面, 由于部分探针分子Cy3-aptamer与啶虫脒结合而使得SERS信号减弱。
作为SERS的基底材料银溶胶的稳定性至关重要, 为了提高银溶胶的长期稳定做了一些探索和改善。 Lee法制备的银溶胶表面因为Na3C6H5O7· 2H2O/柠檬酸过量, 受其酸根包覆而带负电荷。 考虑到胶体的稳定和聚凝作用原理, 在体系中加入带负电的物质可以使胶体稳定。 经多次试验, 加入聚丙烯酸钠作为银溶胶的分散剂, 可以有效的保持所合成的银纳米粒子均匀分散在溶液中, 并保持银溶胶的稳定。 实验表明: 制备的银溶胶液中加入聚丙烯酸钠浓度为0.05%时, 于4 ℃棕色瓶中可以稳定保存至少60 d。
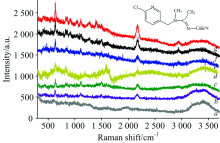
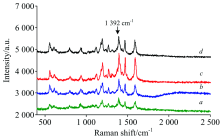
测试时银溶胶中加入电解质, 可使纳米溶胶表面的电荷平衡改变而发生团聚, 局部表面等离子体共振发生叠加, 从而形成SERS活性热点, 引起拉曼增强。 不同类型的电解质, 对SERS信号有不同的影响。 为了考察不同聚沉剂对银溶胶SERS的影响, 以SERS信号较弱的啶虫脒分子为探针, 对其在不同聚沉剂条件下的SERS进行了测试, 结果如图2。
从图2可以看出不同的聚沉剂对啶虫脒的SERS图有不同的影响。 由于啶虫脒表面带有Cl和C≡ N Cl原子易产生拉电子效应, 而C≡ N与C=N产生共轭及诱导效应, 故均带有一定的负电荷σ -, 使其较难以靠近表面带负电的银溶胶, 而检测不到SERS信号。 当加入聚沉剂NaOH (图2a)时, 亦无SERS信号。 常用的聚沉剂NaCl(图2b)和KCl(图2c), 其增强效应较弱; 而相同阴离子的HCl(图2d)产生的增强效果要大于NaCl和KCl。 因价数相同的带相反电荷离子的水合半径越小, 聚沉能力越强, 在此, 一价正离子的聚沉能力排列为H+> K+> Na+, 从而可以推测聚沉能力的强弱顺序将直接影响SERS的增强效应和检测信号的强弱。
此外, 3 000~3 700 cm-1处为水的OH伸缩振动, 当NaOH, NaCl, KCl作为聚沉剂时, 峰强较强, 可以看出, NaOH, NaCl, KCl作为聚沉剂时银溶胶表面被大量水分子占据。 也说明NaCl, KCl作为聚沉剂可以产生一定的聚沉效果, 但啶虫脒分子较难吸附到银溶胶表面。 进一步考察不同阴离子的酸, 其中, H3PO4(图2g)的SERS信号最强, HNO3(图2f)的SERS信号紧随其后, 随之为H2SO4(图2e)和HCl(图2d)。 其对啶虫脒的SERS检测信号强弱排列为P
因此, H+作为阳离子和P
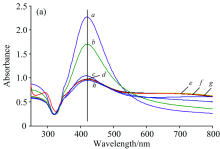
为了进一步研究聚沉剂对银溶胶的聚沉作用和影响, 考察了加入160 mmol· L-1不同的聚沉剂11 min后对银溶胶的紫外可见吸收光谱的变化[图3(a)]。 由图3(a)可知, 银溶胶空白溶液(本底含0.01%聚丙烯酸钠)[图3(a), a]的吸收峰位置在421.10 nm, 加入聚沉剂后, 聚沉剂都会使银溶胶的吸光度减小。 NaCl[图3(a), b], HCl[图3(a), c]和KCl[图3(a), d]的最大吸收峰分别在420.78, 420.78和417.32 nm处, 产生略微蓝移。 而加入碱和酸均会使吸收峰产生略微红移。 NaOH[图3(a), h]移至421.65 nm。 H3PO4[图3(a), e], HNO3[图3(a), f], H2SO4[图3(a), g]分别移至421.65, 421.65和422.51 nm。 说明Cl离子加入, 可能与表面附着的Ag离子结合, 产生氯化银, 增大了电子的跃迁能级。 而H+, OH-离子作用于银溶胶表面, 由于电荷效应, 使电子的跃迁能级减小。
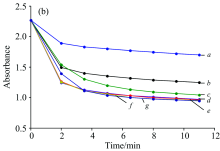
图3(b)为银溶胶吸光度随时间的变化图, 实验表明加入NaCl[图3(a), b], HCl[图3(a), c], KCl[图3(a), d]对银溶胶的吸光度的变化值影响相对较小, 而加入H3PO4[图3(a), e], HNO3[图3(a), f]和H2SO4[图3(a), g]具有类似的吸光度变化, 而NaOH[图3(a), h]吸光度变化最大。 结果说明, 聚沉速度在一定程度上影响了SERS检测信号, 但NaOH和H3PO4, HNO3和H2SO4的吸光度变化速度相似, SERS信号差异明显, 说明表面电荷性质对SERS的增强信号起决定作用。 因此, 可以通过加入聚沉剂来改善银溶胶表面的电荷状况和提高表面增强拉曼光谱的信号, 以达到高灵 敏分析检测分子的目的。
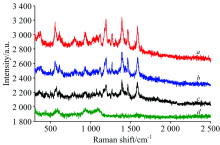
由于Cy3-aptamer磷酸骨架上带有较多负电荷, 经试验加入带有正电荷的辅助“ 显色剂” 精胺使其产生较强的SERS信号, 并考察了反应时间为5, 10, 15 min时的SERS图(图4)。 在未加精胺的1 μ mol· L-1 Cy3-aptamer SERS图4d中, 可以看出Cy3指纹信息较少。 推测主要是由于DNA骨架上的磷酸基团所带的负电荷强于其碱基上所带的正电荷, 而呈现酸性, 即Cy3-aptamer带负电, 而聚丙烯酸钠分散银溶胶体系也带负电, 以致于Cy3-aptamer不能很好的吸附到银溶胶表面。 在加入带正电荷的精胺(图4a, b, c)后, 可以观察到明显的Cy3指纹信息。 表明, 带正电荷的精胺分子与DNA作用后, 改变了DNA骨架上的带电状态, 使其与银溶胶能够产生更好的结合, 同时产生SERS效应, 并检测出Cy3-aptamer的信号[14]。 考察图4精胺与aptamer的SERS信号与反应时间关系, 反应时间对SERS影响不大, 为了缩短实验时间选择5 min为宜。
由于啶虫脒与其aptamer有较强的亲和作用, 会与精胺在aptamer上形成竞争反应, 影响“ 显色剂” 精胺对Cy3的“ 显色效应” 。 考察了Cy3-aptamer与啶虫脒不同反应时间(5, 10, 20, 30 min)后, 进一步加入辅助“ 显色剂” 精胺反应5 min时Cy3在银溶胶表面产生SERS光谱的影响(图5)。 实验表明, 啶虫脒与其aptamer反应20 min时Cy3的SERS信号最大, 推测啶虫脒、 Cy3-aptamer及其配合物Cy3-aptamer-啶虫脒存在一定的平衡解离关系, 且在银溶胶表面的吸附速率不同。 由于啶虫脒的浓度过量, 小分子啶虫脒首先占据银表面, Cy3信号较弱, 随着时间推移, 带有精胺的Cy3-aptamer逐渐靠近银表面, 使得Cy3信号增强。 超过20 min 信号下降, 推测主要是由于分子在银表面的堆积, 使得光散射信号传递受阻, 因此选择20 min为最佳反应时间。
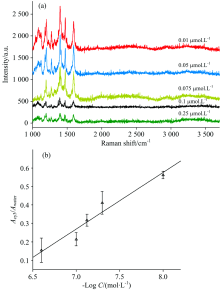
在所选条件下, 测定了不同浓度的啶虫脒溶液(0.25, 0.1, 0.075, 0.05, 0.01 μ mol· L-1)在Cy3-aptamer捕获下的SERS图[图6(a)]。 由图6(a)可知随着啶虫脒浓度的增加, 信标分子Cy3 的SERS峰强度随之下降。 为了提高测定的可靠性, 选择了本底水分子作为内标[15]组成相对强度。 以1 392 cm-1处特征峰的拉曼峰面积与3 000~3 700 cm-1处水的OH伸缩振动峰的面积的比值与啶虫脒浓度对数作关系图[图6(b)]。 经测定, 银溶胶Cy3-aptamer方法检测啶虫脒的浓度线性范围为1× 10-8~2.5× 10-7 mol· L-1, 线性回归方程为Acy3/Awater=-0.306 5LogC-1.876, 相关系数r=0.971 6。
用采样器采集杭州市上塘河水样, 在测试之前, 样品先用0.45 μ m微滤膜过滤, 以去除颗粒性悬浮物。 实际水样经本法检测未检出。 将1.0× 10-7 mol· L-1的啶虫脒标准样品加入到水样中, 重复测量三次, 相对标准偏差RSD=9.99%, 回收率为97.4%, 97.5%, 99.4%。
采用农药啶虫脒aptamer并标记拉曼光谱信号分子Cy3制备的Cy3-aptamer探针分子, 能够很好的与精胺作用在银溶胶表面吸附而产生基准SERS光谱信号。 啶虫脒与Cy3-aptamer探针分子能够形成特异性反应, 减少了Cy3-aptamer与精胺的作用, 而减弱了SERS的信号, 从而实现了特异性分析测定农药啶虫脒分子的目的。 利用此方法可以实现其他农药或其他化合物的特异性分析检测, 具有一定的应用前景和研究意义。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|