作者简介: 梁政委, 1994年生, 中国科学院海洋研究所硕士研究生 e-mail: liangzhengwei16@mails.ucas.ac.cn
贻贝对各种海洋环境具有广泛适应性, 范围从浅海跨越到深海热液、 冷泉等极端环境。 贻贝主要通过其足组织分泌的蛋白形成足丝附着于岩石等固体表面, 这种蛋白是一种可再生、 不受水环境影响的性能良好的天然生物胶黏剂, 得益于分泌蛋白的性质, 足丝在水下具有黏附性强、 韧性高、 耐水性优良等特性, 在生物材料学、 医学等方面具有很好的开发潜力和应用前景, 已经是国内外研究热点之一。 拉曼光谱是一种非接触的、 无损的可以提供分子生物化学信息的检测技术。 足丝是贻贝足腺体的外在表达形式, 结合扫描电镜和共聚焦显微拉曼光谱技术, 从贻贝足丝的表观差异到贻贝足腺体的分泌蛋白组分和分布特征, 基于深海和浅海贻贝足丝的扫描电镜表征的表观形态差异, 对两种贻贝足组织分别进行共聚焦显微拉曼光谱检测, 得到两种贻贝的3个腺体的拉曼光谱和腺体局部区域的2D拉曼彩色分布图, 从外在表现形式足丝到内部足腺体分布, 通过对比两种贻贝的3个腺体的成分以及相对分布, 分析造成两种贻贝足丝差异的内在腺体分布情况, 此外结合两种贻贝生存环境的差异, 认为贻贝的足丝外观差异以及其内部腺体分布是贻贝应对浅海和深海冷泉完全不同理化环境的一种环境适应机制。 基于实验结果得到如下结论, 拉曼光谱表明两种贻贝足腺体组成: 表征核心腺体的amide Ⅲ信号位于1 242和1 269 cm-1位置的2个峰的峰强度相对其他两个峰(1 318和1 337 cm-1)较高, 表现为有序高级的蛋白构象, 外皮和粘附盘腺体含有丰富的酪氨酸(643, 830, 850和1 615 cm-1)和3, 4-二羟基苯丙氨酸(多巴, DOPA, 785 cm-1); 浅海贻贝在1 043 cm-1位置有高强度的胶原蛋白信号。 拉曼成像呈现两种贻贝腺体分布特征: 深海贻贝表现为较为集中的腺体分布, 浅海贻贝腺体分布较为分散, 表明贻贝为适应不同环境形成不同的腺体分布机制。 由此可见, 拉曼光谱可以用于研究不同环境下生存的贻贝的足腺体分布特性, 并在生物样品微观分析中更多的应用。
Mussels are widely distributed in various marine environments, from shallow seas to cold seeps and hydrothermal vents in the deep oceans, because of its excellent adaptabilityin different physicochemical conditions. Mussels anchor themselves on the tough substrate exposed on the seabed, such authigenic carbonate crusts or rock outcrops with adhesive protein secreted by mussel foot. This protein is a natural renewable biological adhesive available in various marine environments and mussel byssus presents such as high adhesive, high toughness and resistance to water. The adhesive protein has great potential and application prospect in biotechnology and medicine field, and it has become a research hotspot nowadays. Raman spectroscopy is a kind of non-destructive and non-invasive detection technique which can provide molecular biochemical information of organisms. In this paper, SEM and confocal Raman micro-spectroscopy are used to investigatethe apparent difference of mussel foot byssus, the secreted protein composition and distribution characteristics of mussel foot gland. Based on the apparent morphological differences of deep-sea mussels and sallow-sea mussels by SEM, two kind of mussels foot tissues are detected with confocal Raman micro-spectroscopy and acquire Raman spectra and 2D Raman color-coded image of three glands. The components and relative distribution of three glands of two mussels are compared and byssus differences caused by the glands distribution are analyzed. Meanwhile, considering the living environments of the two kind of mussels, we think that the mussel byssus appearance difference and foot glands distribution is a kind of adaptation mechanism to the environment. The Raman spectra suggest the components of two mussels foot glands: the higher intensity at 1 242 and 1 269 cm-1to the other two peaks (1 318 and 1 337 cm-1) of the amide Ⅲ signals indicates that the core gland is a higher degree of conformational order protein. The proteins that comprise theplaque and cuticle enrich amino acid tyrosine (Tyr) at 643, 830, 850 and 1 615 cm-1 and post-translationally converted to 3,4-dihydroxyphenylalanine (DOPA) at 785 cm-1; shallow-sea mussels present high intensity collagen protein at 1 043 cm-1. Raman imaging shows the glands distribution feature: deep-sea mussels foot glands distribution concentration and shallow-sea mussels foot glands distribution dispersion, which suggests that the glands distribution may be a kind of mechanism for the mussels to adapt different environments. The results indicate that confocal Raman micro-spectroscopy can be used in the analysis of the mussel foot glands distribution characteristics in different environments, and has great prospect to be applied in the micro-analysis of the biological samples.
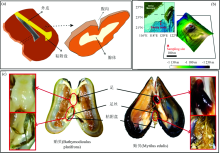
海洋贻贝属软体动物门, 瓣鳃纲, 其广泛分布于沿岸和近海, 主要通过足丝附着于岩石、 船体或其他基质表面来生存。 贻贝的足丝通过贻贝足腺体分泌贻贝粘附蛋白(mussel adhesive protein, MAP)而形成的, 这些蛋白在贻贝腹沟内经过一系列作用形成组分、 结构和功能完全不同的核心、 外皮表面和粘附盘[1, 2][图1(a)]。
近年来, 关于贻贝足以及足丝的研究已经取得一定进展, Filippidi等阐明了足丝组成: 足丝核心部分主要由半结晶的胶原蛋白组成, 称为Precols; 足丝纤维外皮表面由贻贝足蛋白-1(mfp-1)组成, 对核心起到保护作用; 粘附盘由大量富多巴的蛋白质组成(mfp-2, -3, -4, -5, -6), 主要成分是酪蛋白经过后翻译修饰羟基化而形成的-3, 4-二羟基苯丙氨酸(多巴, DOPA), 在贻贝足丝与其他基质表面粘附时起主要作用[2, 3], Inoue等利用分子生物学方法研究了海洋贻贝足丝粘附蛋白的分子结构[4]、 Schmitt等的研究工作阐述了贻贝的DOPA与Fe等金属离子进行螯合作用的粘附机理[5]、 Priemel等利用拉曼光谱技术对贻贝足腺体以及人工诱导后的腺体进行拉曼光谱检测揭示了贻贝足丝的生成的一系列生物调控过程[6, 7]。 相比于传统的研究方法, 拉曼光谱是一种非接触、 无损的提供物质组成和结构等生物化学信息原位探测技术手段, 其不需要特殊繁杂的样品预处理, 可以避免样品污染以获得原本的样品信息。 而共聚焦显微拉曼光谱仪在拉曼光谱仪的基础上, 在光路中引入针孔, 激光通过针孔聚焦为微小光斑, 只有在焦平面上的样品产生的拉曼信号可以通过共聚焦孔回收至光谱, 提高了信噪比和空间分辨率, 还能有效的减少荧光干扰。 对样品微区进行无损的拉曼光谱分析和2D扫描, 可以直观地呈现生物样品化学组成与分布特征。 近年来, 共聚焦显微拉曼光谱已经逐渐应用在生物组织和细胞检测方面。
足丝是贻贝足腺体的外在表现形式, 本文结合扫描电镜和共聚焦显微拉曼光谱对深海和浅海贻贝的足组织进行分析, 从贻贝足丝的表观差异到贻贝足腺体的分泌蛋白组分和分布特征, 探讨两种贻贝足组织分泌蛋白的差异对生成足丝的影响以及对环境适应机制, 可以利用拉曼光谱成像技术研究不同环境下的贻贝足腺体分布特征, 其对工业上生产应对不同环境生产高效理想粘性复合材料具有指示意义。
深海贻贝(Bathymodiolus platifrons)样品于2017年“ 科学号” 冷泉航次取自南海冷泉大陆坡福尔摩沙脊“ Fanmaoqu” 位点[图1(b和c)], 采样过程由“ 发现” 号水下缆控机器人(ROV)完成。 浅海贻贝(Mytilusedulis)来自于大连小平岛。 样品采集至甲板后立即用海水冲洗, 解剖的足组织于-80 ℃冻存。 在-25 ℃的温度下, 使用冷冻切片机(HM 505 E, Germany, 69190 Walldorf)切下10 μ m厚度的足组织切片, 将其固定在载玻片上用于拉曼探测分析。
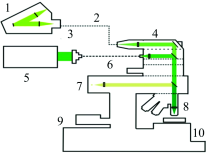
共聚焦显微拉曼光谱仪(alpha 300R+, WITec, Ulm, Germany)(图2)用于贻贝足的单谱和成像分析, 激发光源波长为532 nm, 显微镜物镜为50× /0.55(Zeiss, EC, Epiplan-Neofluar, Germany), 到达样品处的激光功率为20 mW, UHTS300型光谱仪搭配600刻线光栅使光谱采集范围为0~3 000 cm-1, 分辨率为3 cm-1。 进行光谱采集时积分时间为1.5 s, 累积次数为10, 划定面扫描区域, 设置x和y方向的像素点, 步长为500 nm。 使用WITec Project plus软件对拉曼光谱数据进行处理, analysis是通过对某组分的特征峰区域进行单变量成像, 进而整合所检测区域的多个组分图像得到各组分相对分布的2D拉曼光谱图像。
结合深海贻贝和浅海贻贝足丝的形态学知识和扫描电镜表征(图3), 两种贻贝足丝特征如下: 深海贻贝足丝稀疏而宽粗, 粗度约为400 μ m, 其外皮表面较粗糙杂乱, 粘附盘较大; 浅海贻贝足丝繁多而纤细, 粗度约为70 μ m, 其外皮表面较光滑平整, 粘附盘较小。 两种贻贝足丝形态学表观相差很大, 而足丝由贻贝足腺体分泌的蛋白在各种作用下生成, 所以足丝表观差异是贻贝足腺体差异的外在表现形式, 所以检测两种贻贝足腺体的组成以及分布对了解两种足丝差别具有重要意义。
由于样品进行冷冻切片, 受环境影响失水, 镜下形态改变, 且两种贻贝足的尺寸存在差异, 在未经染色的条件下无法保证两种贻贝测定时位置一致性, 所以本实验对两种贻贝的足腺体局部进行拉曼检测和成像, 通过多点位多光谱重复检测的方式确定腺体间的临界位置。
拉曼光谱(如图4和图5)表明两种贻贝足蛋白种类基本相同, 都存在位于1 667 cm-1的amide Ⅰ 和位于1 230~1 340 cm-1的amide Ⅲ 蛋白质骨架信号, 基本表现为1 242, 1 269, 1 318和1 337 cm-1四个拉曼峰。 而Amide Ⅲ 的四个峰的相对强度变化又可以表明蛋白质结构差异, 其中核心腺体的蛋白质表现为有序的β 重叠或螺旋蛋白质高级构象, 对应谱图表现为位于1 242和1 269 cm-1位置的两个峰的峰强度相对其他两个较高, 与胶原蛋白preCol的二级蛋白质结构一致, 而外皮和粘附盘腺体的蛋白构象无序, 其光谱上表现为位于1 242和1 269 cm-1位置的两个峰峰强度相对较低。
此外, 三个腺体组成上也存在差异, 外皮腺体和粘附盘腺体由特殊的蛋白质组成, 拉曼光谱表现为位于643, 830, 850和1 615 cm-1四个峰位置的酪氨酸(Tyr)信号以及由酪氨酸后翻译修饰羟基化形成的拉曼信号峰位于785 cm-1的-3, 4-二羟基苯丙氨酸(多巴, DOPA)信号[8], 表明外皮腺体(mfp-1)和粘附盘腺体(mfp2-6)存在酪氨酸和多巴。 谱图还呈现了位于1 006 cm-1的苯丙氨酸(Phe)信号[9], 其为mfp-2的主要组分, 表明了足蛋白-2的存在。 相对于深海贻贝, 浅海贻贝的拉曼谱图表现出高强度的位于1 043 cm-1位置的胶原蛋白信号[8]。
本实验对两种贻贝的三个腺体的局部区域进行了拉曼成像, 得到了2D拉曼彩色分布图(如图4和图5), 其形象的展现了三个腺体区域的局部界限与分布, 其中红色、 蓝色和绿色分别与外皮、 核心和粘附盘腺体区域一一对应, 黄色区域代表除三种腺体外贻贝足组织的剩余组分。 2D拉曼彩色分布图表明两种贻贝足组织组分分布特征: 浅海贻贝的核心和粘附盘腺体区域分布较分散, 即区域中夹杂零散的黄色部分, 而外皮腺体分布较集中; 深海贻贝的核心和粘附盘腺体区域分布相对集中, 即黄色区域分布集中, 外皮腺体区域较集中。
贻贝足腺体分泌蛋白形成足丝, 足丝是足腺体的外在表现形式, 所以足腺体分布特征决定了的足丝形态特征。 深海贻贝和近海贻贝表现出较大差异的足丝表观和内部足腺体分布, 这可能源于两种贻贝对各自生存环境的适应机制: 本实验所用的深海贻贝生存在中国南海冷泉繁茂区, 附着于自生碳酸盐岩上, 需要利用冷泉渗漏的甲烷生存, 其栖息环境表现为高压、 黑暗、 低温、 富甲烷、 富硫化氢结合等, 贻贝足丝较粗, 其强度、 韧性相对较好, 即便受到海流或其他地质活动影响, 有利于贻贝安稳的固定在冷泉渗漏区域来生存; 而浅海贻贝生存在大连小平岛, 水域环境温度较高, 受人类活动影响较大, 浅海海流较大, 在受海流扰动时贻贝足丝较细有利于贻贝断开单个足丝进行迁徙重新附着。 除海流外, pH、 压力、 温度等理化环境参数以及粘附基质也可能造成两种贻贝足和足丝的形态结构差异。 所以贻贝为适应不同环境表现出的贻贝足丝的高粘附强度、 高韧性、 强耐水性的性质, 这些有效的粘附蛋白是一种高效的高聚天然生物胶黏剂, 其为工业生产适应多种复杂环境应用的聚合物材料提供理论基础。
分别对浅海贻贝和深海贻贝足组织切片进行拉曼检测和成像, 得到了三个腺体的拉曼光谱以及腺体局部区域的2D拉曼彩色分布图。 拉曼光谱表明两种贻贝足腺体组成: 核心腺体表现为有序高级的蛋白构象, 外皮和粘附盘表现为丰富的酪氨酸和多巴组成; 浅海贻贝在1 043 cm-1位置有高强度的胶原蛋白信号。 拉曼成像呈现两种贻贝腺体分布特征: 深海贻贝表现为较为集中的腺体分布, 浅海贻贝腺体分布较为分散, 表明贻贝为适应不同环境形成不同的腺体分布机制。 共聚焦显微拉曼光谱为不同环境下生存贻贝的足腺体分布特征研究提供技术方法, 是一种潜在的研究开发适用于不同环境要求的新型高效人工聚合物探测技术。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|