作者简介: 马 莉, 女, 1993年生, 西北农林科技大学硕士研究生 e-mail: 1309184730@qq.com
预处理是木质纤维材料高效转化为燃料乙醇的关键步骤之一。 通过预处理可以实现木质素及半纤维素等屏障性组分的大量移除, 增加纤维素酶对纤维素的生产性吸附, 从而有效提高后续的酶水解得率。 泡桐( Paulownia)年产量大、 生长周期短、 加工废料多, 是制备生物能源和其他化学品极具潜力的原料。 为实现泡桐木质生物质原料到生物乙醇的高效转化, 促进泡桐原料的高效酶水解, 故而对原料进行预处理以打破其原有的生物抗性, 降解并脱除酶水解屏障性组分, 暴露并保留更多纤维素组分。 本研究以泡桐作为实验材料, 使用乙酸协同亚硫酸钠对原料进行化学预处理, 分析不同处理方法对原料化学组分及结构特性的影响。 组分分析显示: 预处理后, 样品葡聚糖相对含量均有不同程度增加, 其中碱性亚硫酸钠协同处理泡桐增加最为明显。 数据显示, 碱性亚硫酸钠协同处理具有很好的脱木素作用, 同时可以降解溶出部分木聚糖组分, 因此其葡聚糖相对含量显著增加至67.48%(未处理泡桐的葡聚糖相对含量为46.81%)。 此外, 分别采用FTIR, XRD及XPS等表征方法对所有泡桐样品的理化结构进行分析, 以探究不同预处理对样品结构产生的影响。 FTIR分析表明: 碱性亚硫酸钠协同处理后木质素特征吸收明显减弱, 纤维素特征吸收增强, 表明木质素有一定脱除, 纤维素相对含量有所增加。 XRD分析显示: 预处理后泡桐纤维表面受到破坏, 木质素及半纤维素等无定型物质被部分脱除, 纤维素结晶度均有不同程度增加。 其中, 碱性亚硫酸钠协同处理后纤维素结晶度显著增加至58.98%(未处理材的纤维素结晶度约为40.23%), 002峰位向右侧偏移, 衍射峰衍射强度明显增强, 峰形变高且尖锐程度增大; XPS分析表明: 碱性亚硫酸钠协同处理后, 样品表面碳水化合物含量增加, 表面木质素含量减少。 所有表征分析均显示碱性亚硫酸钠协同处理对泡桐结构破坏性最大, 木质素降解脱除程度最高, 纤维素保留程度最好, 这有助于增加纤维素酶对纤维素的可及性, 有效提高后续的纤维素酶水解效率, 进而促进泡桐原料到燃料乙醇的高效转化。 结构表征分析结果与化学组分规律保持一致。
Pretreatment is one of the key steps in the efficient conversion of lignocellulose into fuel ethanol. During the pretreatment process, a large amount of barrier components such as lignin and hemicellulose can be removed, which can effectively increase the productive adsorption of the cellulase to cellulose, thereby effectively improving the subsequent enzymatic hydrolysis yield. Paulownia has a large annual output, short growth cycle and high processing waste. It is a potential material for the preparation of bio-energy and other chemicals. In order to achieve high-efficiency conversion of paulownia woody biomass material to bioethanol, and promote efficient enzymatic hydrolysis of paulownia material, the raw material was pretreated to break its original biological resistance, degrade and remove enzymatic hydrolysis barrier components, expose and retain more cellulose components. In this work, Paulownia was used as the experimental material, and the raw material was chemically pretreated with acetic acid and sodium sulfite, analyzing the effect of different treatment methods on the chemical compositions and structural characteristics of samples. The composition analysis showed that the relative content of glucan in the samples increased to different degrees after pretreatment, and the alkaline sodium sulfite synergistic treatment of paulownia increased most obviously. The data showed that the alkaline sodium sulfite synergistic treatment had a good delignification effect and could degrade some xylan component, so the relative content of glucan was significantly increased to 67.48% (the relative content of glucan in the raw material was 46.81%). In addition, the physicochemical structures of all paulownia samples were analyzed by FTIR, XRD and XPS to explore the effects of different pretreatments on the structure of samples. FTIR analysis showed that the characteristic absorption of lignin was significantly weakened by the alkaline sodium sulfite synergistic treatment, and the characteristic absorption of cellulose was enhanced, indicating that the lignin had a certain removal, and the relative content of cellulose had increased; XRD analysis showed that the fiber surface of pretreated Paulownia was destroyed, the amorphous substances such as lignin and hemicellulose were partially removed, and the crystallinity of cellulose increased to varying degrees. Among them, after alkaline sodium sulfite synergistic treatment, the cellulose crystallinity increased significantly to 58.98% (the cellulose crystallinity of the raw material was about 40.23%), the peak position of 002 shifted to the right, the diffraction intensity of diffraction peak increased obviously, the peak shape became higher and the sharpness increased; XPS analysis showed that the surface carbohydrate content increased and the surface lignin content decreased after the alkaline sodium sulfite synergistic treatment. All the structural characterization analysis showed that the alkaline sodium sulfite synergistic treatment had the greatest destructive effect on the structure of Paulownia, the most lignin degradation and the best cellulose retention, which could increase the accessibility of cellulase to cellulose and effectively improve the subsequent cellulase hydrolysis efficiency, and thereby promote the efficient conversion of paulownia raw material to fuel ethanol. The results of structural characterization analysis were consistent with the chemical composition rules.
生物质能被称为世界上的“ 第四大能源” [1]。 其中木质生物质能是可再生和可持续发展的[2]。 随着全球气候变暖以及不可再生资源的日益消耗, 木质生物质能的有效利用越来越受到工业应用的关注[3]。 近年来世界能源工业不断发展, 越来越多的木质生物质材料(如能源草, 农作物秸秆, 木材废料等)被用作生产工业乙醇的绿色生物质材料。
泡桐(Paulownia)是一种生长周期短、 多用途树种, 可用于制浆、 家具、 手工艺品、 乐器和木炭等领域。 泡桐原产于中国, 年产量极高, 约50 t· a-1, 显著高于其他能源物种(如杨树, 柳枝稷, 芒草及柳树等)的产量约6~17 t· a-1 [4]。 此外, 我国泡桐资源丰富, 种植面积约968万亩, 约占世界种植面积的27%。 在当前泡桐产业发展中, 主要以桐木单板和桐木家具加工为主[5], 桐木综合利用价值较低, 加工生产过程中会产生大量的加工废弃物。 因此, 有效利用这些废弃泡桐资源进行生物质能源转化来制备燃料乙醇是非常有意义的。
有研究报道, 泡桐富含木质纤维素, 其综纤维素含量约占60%~70% [6]。 与其他木质生物质材料相比, 泡桐所含灰分和可溶性物质较少, 结构较为疏松, 是制备生物乙醇及其他化学品极具潜力的原料。 木质素和半纤维素, 尤其是木质素, 被认为是限制纤维素酶对纤维素可及性的最大物理屏障[7]。 复杂顽抗的木质素结构在很大程度上限制了泡桐的有效利用, 因此需要先对原料进行预处理破坏其结构, 增加纤维素酶与纤维素的特异性吸附, 使纤维素易于水解, 高效转化为燃料乙醇。
目前国内以泡桐作为材料制备燃料乙醇的研究较少。 部分学者使用稀酸法、 水热法、 物理化学法等对泡桐进行处理。 但针对乙酸及亚硫酸钠协同处理泡桐的研究鲜见, 乙酸预处理可以较好地降解木聚糖, 亚硫酸钠具有很好的脱木素作用。 本工作以速生泡桐为研究对象, 采用乙酸协同亚硫酸钠对原料进行化学预处理。 探究不同处理条件对泡桐化学组分及结构特性的影响, 为我国泡桐生物质资源高效转化利用提供部分理论基础。
泡桐木粉(加工废料), 粉碎研磨至80目, 晾干装袋贮存备用, 含水率保持在8%以下。 冰醋酸、 无水乙醇、 氢氧化钠、 无水亚硫酸钠、 浓硫酸、 葡萄糖、 木糖等均为市售分析纯试剂。
水浴锅、 电子天平、 真空泵、 干燥箱、 高速离心机、 紫外-可见分光光度计、 振荡器、 高效液相色谱、 高压灭菌锅、 高温油浴锅、 粉碎机等。
1.2.1 预处理
乙酸预处理: 配置5% CH3COOH溶液250 mL, 称取绝干泡桐粉末20 g, 料液比为1:10, 170 ℃条件下处理30 min。 结束后冷却过滤, 将固体用蒸馏水洗至中性, 晾干装袋备用。 残渣标记为RMA。
亚硫酸钠协同处理: 配置4% Na2SO3溶液250 mL, 称取RMA绝干原料20 g, 料液比为1:10, 120 ℃条件下处理60 min, 后续处理同上。 此残渣标记为RMAS。
碱性亚硫酸钠协同处理: 配置4% Na2SO3+1% NaOH溶液250 mL, 称取RMA绝干原料20 g, 料液比为1:10, 120 ℃条件下处理60 min, 后续处理同上。 此残渣标记为RMAAS。
1.2.2 化学组分测定
泡桐样品各组分含量参照美国国家可再生能源实验室(NREL)的方法进行分析测定。 葡萄糖及木糖峰面积在高效液相色谱仪(Agilent1200)上用Bio-Rad HPX-87H色谱柱测定。 所有试验均采用三组平行, 最终数据取平均值并计算标准误差。
1.2.3 结构表征
X-射线衍射仪(Rigaku D/max-3C generator)用于测定泡桐样品的纤维素结晶度, 测定电压40 000 V, 电流0.1 A, 扫描角度2θ , 范围为5° ~50° , 扫描速率为12° · h-1。 纤维素的结晶度指数由X射线衍射仪测得的光谱峰高进行公式计算得到[8]。 I002为002晶面的极大衍射强度, 2θ 约为22° ; Iam为非结晶背景衍射的散射强度, 2θ 约为18° 。 结晶度(CI)计算公式为式(1)
采用NicoletiS10型傅里叶变换红外光谱仪对样品进行红外分析。 扫描范围取4 000~400 cm-1, 分辨率为4 cm-1, 扫描次数为64次。
X射线光电子能谱仪(XPS)用于检测泡桐样品表层(2~10 nm)的原子组成及化学环境[8]。 使用的光源为单色光Al Kα X-射线源(15 kV, 5 mA)。
预处理前后泡桐样品的化学组分变化如表1所示。
| 表1 不同预处理方法对样品化学组分及结晶度的影响 Table 1 Effect of different pretreatment methods on chemical compositions and crystallinity index of samples |
未处理泡桐的葡聚糖, 木聚糖和木质素含量分别为46.81%, 18.92%和26.40%, 抽提物含量为5%左右。 经乙酸预处理后, 木聚糖含量降低至11.06%, 葡聚糖含量增加至50.23%。 可能是由于乙酸对木聚糖具有很好的降解溶出作用, 此结果与前人的研究相似[9]。 Wang等[9]提出160 ℃条件下, 用25%的乙酸溶液处理10%固体浓度的麦草几乎可以移除所有的木聚糖并回收94.2%的葡聚糖。 乙酸处理过程中, 木聚糖在水合氢离子的作用下, 降解为低聚木糖溶于上清液中, 使更多的纤维素暴露在预处理残渣中。 然而, 乙酸预处理对木质素的脱除十分有限, 因此三大素之间的复杂交联结构需要进一步被破坏以提高后续酶水解效率。
经亚硫酸钠协同处理后, 葡聚糖含量增加至57.73%, 木质素含量降低至28.29%, 表明Na2SO3预处理具有良好的脱木素能力。 此外, 经过碱性亚硫酸钠协同处理后, 发现碳水化合物含量提高到72.71%, 木质素含量降低到26.34%。 与亚硫酸钠协同处理相比, 碱性亚硫酸钠协同处理具有更好的脱木素能力, 同时降解了部分木聚糖, 大大增加了纤维素在生物质表面的暴露面积, 有助于纤维素酶对纤维素的生产性吸附。 这表明添加NaOH有助于除去其他成分(即木质素, 半纤维素和提取物等), 暴露并保留更多纤维素。 此结论与先前的研究吻合[8]。
为研究预处理过程中样品的物理结构变化, 通过XRD测定处理前后泡桐样品的纤维素结晶度。 图1为预处理前后泡桐样品的X射线衍射图谱, 图中101, 002及040峰是典型的纤维素I的特征, 其衍射角分别为16.02° , 22° 和34.76° 。 经过预处理后, 002峰位置均向右有所偏移, 说明经过预处理后结晶区晶胞参数变小, 晶面间距变小, 同时发现, 碱性亚硫酸钠协同处理后, 002峰尖锐程度最大, 衍射峰明显增强, 纤维素结晶度CI明显高于其他样品。
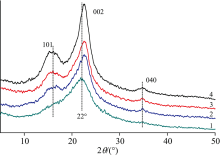 | 图1 预处理前后泡桐样品的X射线衍射图 1: RM; 2: RMA; 3: RMAS; 4: RMAASFig.1 The X-ray diffraction spectrogram of Paulownia samples before and after pretreatment 1: RM; 2: RMA; 3: RMAS; 4: RMAAS |
纤维素结晶度指数是由X射线衍射仪测得的光谱峰高计算所得[10]。 如表1所示, 未处理泡桐的结晶度是40.23%。 这可能归因于部分无定型物质的存在, 如木质素和半纤维素等。 经过乙酸处理后, 泡桐样品的结晶度增加至47.25%。 这可能是由于乙酸降解掉了一部分木聚糖, 从而导致纤维素结晶度增加。
亚硫酸钠协同处理后, 样品结晶度增加至50.32%。 预处理固体纤维素结晶度的增加可能归因于部分木质素, 木聚糖和其他组分的降解脱除, 从而降低整体无定形特征。 碱性亚硫酸钠协同处理导致更高的结晶度出现, 这可能是由于氢氧化钠的引入促进了更多木质素和其他成分被去除。 预处理后样品纤维素结晶度的增加, 表明更多无定型组分被脱除, 这与组分中葡聚糖含量的增加规律一致。
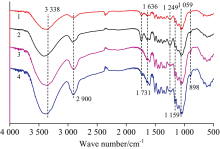
预处理前后泡桐的红外光谱图谱如图2所示。 1 731 cm-1处的吸收峰代表半纤维素的乙酰基和糖醛酯基或木质素中阿魏酸与香豆酸中羧基的酯键连接[10]。 在1 731 cm-1处, 乙酸处理后泡桐的吸收强度增加, 可能是由于乙酸脱除了部分木聚糖组分导致木质素含量增加。 两次协同处理后吸收接近消失, 吸收强度的顺序是RMA> RM> RMAS> RMAAS。 这表明协同处理后木质素可能发生了降解。 木质素特征吸收越少表明其结构破坏越大, 从而使得纤维素酶更容易接近纤维素[11]。 化学结构的破坏导致泡桐样品的顽抗性降低, 后续酶促水解性增强[8]。 碱性亚硫酸钠协同处理表现出更强的破坏底物结构的能力。 此外, 纤维素的特征吸收峰2 900, 3 338及1 059 cm-1, 协同处理后泡桐样品的吸收强度明显增加。 同时观察到, 木质素的特征峰在1 249 cm-1(C— O愈创木基环)和1 636 cm-1处, 乙酸处理样品的木质素峰值强度明显高于协同处理后样品的峰值强度。 这可能是由于协同处理使得泡桐原料的木质素结构进一步被破坏。 相比较于未处理的泡桐原料, 预处理后的泡桐在898和1 159 cm-1两处峰值强度(β -D糖苷键的特征峰)均有所提高, 峰强度的顺序是RM< RMA< RMAS< RMAAS, 这可能由于预处理后多糖含量增加所导致。
图3为所有泡桐样品的X射线光电子能谱图谱。 可以发现, 经过碱性亚硫酸钠协同处理后, C— C含量明显减少, C— O含量明显增加。 这表明碱性亚硫酸钠协同处理对于样品表面木质素的脱除十分有利。
 | 图3 预处理前后泡桐样品的X射线光电子能谱图谱Fig.3 The X-ray photoelectron spectroscopy of Paulownia samples before and after pretreatment |
所有泡桐样品的氧碳比(O/C)是根据生物质材料表层(2~10 nm)的碳氧组成计算的(表2)。 据报道, 不同生物质组分的O/C比值按以下顺序排列: 纤维素(约为0.83)> 半纤维素> 木质素> 抽提物(即脂肪酸, 烃类等)。 木质素和抽提物的理论O/C比分别为0.33和0.09[12]。 未处理泡桐的O/C比为0.45。 乙酸处理后, 泡桐样品的O/C比下降为0.387, 较为接近木质素的理论值0.33。 这可能是由于乙酸处理过程中降解了部分木聚糖, 表面木质素含量相对增加导致。 经亚硫酸钠协同处理后, O/C比增加到0.39, 仍然非常接近木质素的理论值(0.33)。 一般情况下, 预处理过程可以去除大量的抽提物。 因此, 数据表明亚硫酸钠协同处理泡桐的表面仍有大量木质素, 尽管木质素总量明显减少(表1), 可能是由于Na2SO3预处理和洗涤过程中木质素的再沉积。 高的O/C表示样品表面纤维素和(或)半纤维素含量较高, 低的O/C表示样品表面木质素较多[13]。 因此, O/C的增加表明表面木质素含量减少。 经碱性亚硫酸钠协同处理后, O/C提高到0.46, 说明表面木质素含量明显减少。 因此, 碱性亚硫酸钠协同处理更有利于总木质素的脱除及表面木质素的去除。 正如组分分析部分所讨论的, 碱性亚硫酸钠协同处理后泡桐的碳水化合物含量明显增加, 更加有助于酶水解。
| 表2 预处理前后泡桐样品的光电子能谱分析结果 Table 2 The O/C ratio and concentration of functionality by percentage carbon in Paulownia samples before and after pretreatment |
高分辨率的C(1s)峰可分为四类: C— C/C— H (C1), C— O (C2), C═O (C3)和— COOH (C4)[7]。 在所有泡桐样品中, 只有C1, C2和C3峰(图3)。 C1峰主要由木质素和抽提物组成[7]。 与未处理泡桐相比, 乙酸处理泡桐的C1含量有所提高, 可能是由于木聚糖的脱除导致表面木质素含量相对增加。 亚硫酸钠协同处理后, C1含量仅有略微减少, 表明亚硫酸钠协同处理泡桐表面仍然覆盖大量木质素, 处理过程中可能移除了部分抽提物。 此结论与前人的研究结果相似[8]。 经碱性亚硫酸钠协同处理后, C1含量明显减少并低于未处理材, 表明木质素的表面覆盖度降低。 相比于亚硫酸钠协同处理, NaOH的加入对表面木质素的去除有一定的促进作用。 C2和C3峰被认为与多糖有关, 包括纤维素及半纤维素[8]。 可以发现, 碱性亚硫酸钠协同处理泡桐C2(表面碳水化合物)含量有明显提高(表2)。
(1)碱性亚硫酸钠协同处理表现出最佳的预处理效果。 葡聚糖相对含量增加至67.48%, 木质素及木聚糖等酶水解屏障性组分均有很大比例降解脱除。
(2)表征分析结果与组分分析规律一致。 FTIR分析显示, 碱性亚硫酸钠协同处理对样品结构破坏最大, 木质素特征吸收减弱, 纤维素特征吸收增强。 XPS分析可见, 碱性亚硫酸钠协同处理可以移除更多的表面木质素, 暴露并保留更多的表面碳水化合物(O/C比增加, C1含量减少, C2含量增加)。 XRD分析表明, 预处理后样品的纤维素结晶度均有不同程度增加, 002峰右移。 碱性亚硫酸钠协同处理后, 衍射峰衍射强度明显增强, 峰形变得高且尖锐, 更多无定型组分(木质素及半纤维素等)被脱除, 从而有助于提高后续的纤维素酶解效率。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|