作者简介: 赵秋伶, 女, 1979年生, 辽宁科技学院生物医药与化学工程学院副教授 e-mail: flyzhql@iccas.ac.cn
土鸡蛋供不应求, 不法商贩为谋取暴利将斑蝥黄添加到饲料中制造假土鸡蛋, 严重损害了消费者权益。 斑蝥黄和蛋黄本身的色素(叶黄素、 玉米黄素、 胡萝卜素)均为线性多烯分子, 相似的结构和相近的分子量使得它们被同时萃取、 难以分离。 斑蝥黄和蛋黄色素提取液的紫外-可见吸收光谱严重重叠, 无法采用传统光谱法检测。 将紫外-可见分光光度法与一阶导数光谱法有机结合, 经简单萃取而未分离的情况下, 建立了蛋黄中斑蝥黄的快速检测方法, 有效排除了蛋黄中天然色素对斑蝥黄检测的干扰。 首先用乙醇和氯仿混合溶剂提取蛋黄中天然色素, 用紫外-可见分光光度计对蛋黄提取液和标准斑蝥黄样品进行光谱扫描, 然后用Origin软件对光谱做一阶导数处理, 并用Adjacent-Averaging方法对一阶导数光谱进行平滑去除噪声处理。 根据蛋黄提取液、 标准斑蝥黄样品及两者混合物的一阶导数光谱特征和蛋黄提取液一阶导数光谱零交叉点位置, 确定448, 467及520~579 nm可作为斑蝥黄的检测波长。 用蛋黄提取液和标准斑蝥黄样品混合物的一阶导数光谱值对斑蝥黄浓度作图得工作曲线, 考察了448, 467, 520及535 nm, 工作曲线的线性关系及检测限, 最终确定520 nm为斑蝥黄的最佳检测波长: 该波长下工作曲线的线性回归方程为 Y=0.001 01 C+0.000 180 9, R2=0.992 9, 线性范围为0~17.68 μg·mL-1, 检测限为0.58 μg·mL-1。 为了验证该方法在实际样品检测中的效果, 取来自不同养殖场的三种鸡蛋样本进行添加回收实验, 结果表明: 当斑蝥黄添加量为1~5 μg·mL-1时, 样品的平均回收率在96.4%~102.8%之间, 相对标准偏差在2.53%~5.67%之间。 该方法无需复杂的样品前处理步骤、 无需大型仪器、 操作简单、 结果准确, 成本低, 能用于检测蛋黄中斑蝥黄含量。
In order to make huge profits, the illegal traders add canthaxanthin to chicken feed to make fake native eggs, which seriously damages the rights and interests of consumers. Both canthaxanthin and yolk coloring (lutein, zeaxanthin and carotene) are linear polyene molecules with similar structures and similar molecular weights; they are extracted at the same time and are difficult to separate. The ultraviolet-visible spectra of canthaxanthin and yolk extract overlap seriously, so it is impossible to detect canthaxanthin by traditional spectroscopy. In this paper, ultraviolet-visible spectrophotometry and first derivative spectrophotometry were combined to establish a rapid method for the determination of canthaxanthin in egg yolk without separation after simple extraction, the interferences of lutein, zeaxanthin and carotene on the detection of canthaxanthin were effectively eliminated. Firstly, the yellow compounds in the yolk were extracted with a mixed solvent of ethanol and chloroform. The spectra of yolk extract and canthaxanthin standard solution were scanned by ultraviolet-visible spectrophotometer. Then the spectra were processed for first-order differential processing by Origin software and were smoothed to eliminate noise by Adjacent-Averaging method. According to the first derivative spectra’ characteristics of yolk extract, standard canthaxanthin sample and their mixture and the zero-cross point position of the first derivative spectrum of yolk extract, 448, 467 and 520~579 nm can be used as detection wavelength of canthaxanthin. The first derivative spectrum value of the mixture of yolk extract and the standard canthaxanthin solutions was plotted against the concentration of canthaxanthin to obtain the straight working line. The linear relationship and detection limit of the working line at 448, 467, 520 and 535 nm wavelengths were investigated. The results showed that the optimal detection wavelength of canthaxanthin was 520 nm. The linear regression equation of the working line at 520 nm was Y=0.001 01 C+0.000 180 9 and R2=0.992 9. The linear range was 0~17.68 μg·mL-1, and the detection limit was 0.58 μg·mL-1. In order to verify the effectiveness of this method in actual sample measurement, three egg samples from different producing areas were added and recovered. The results showed that the average recovery of the samples ranged from 96.4% to 102.8%, and the relative standard deviation ranged from 2.53% to 5.67%. The method does not need complicated sample pretreatment steps and large-scale instruments; it is simple, accurate and low cost and can be used to detect canthaxanthin in egg yolk.
斑蝥黄(Canthaxanthin, CX) , 又称β -胡萝卜素-4, 4’ -二酮、 角黄素等, 分子式为C40H52O2[1]。 根据农业部第2045号《饲料和饲料添加剂管理条例》, 斑蝥黄作为人工合成着色剂, 被允许添加进家禽饲料中, 以改变家禽肉质和蛋黄的颜色[2]。 普通鸡蛋添加斑蝥黄后, 蛋黄颜色会发生明显改变, 从浅黄色变为稍红的橘黄色, 并且更加鲜亮[3]。 斑蝥黄为橙红色色素, 仅能使蛋黄颜色变美观, 丝毫不会提高产品营养价值[4]。 今年的3· 15消费者权益日, 央视曝光添加了斑蝥黄的普通鸡蛋被拿来冒充土鸡蛋, 在各网络平台、 商场上以高价售卖, 打着散养鸡, 精细喂食, 更高饲养成本的旗号, 价格甚至是普通鸡蛋的2倍。 这种欺骗行为严重损害了消费者的合法权益。 斑蝥黄是一种可食用的着色剂, 但不代表人体可以大量食用。 已有研究表明: 过量的斑蝥黄被人体吸收后累积在视网膜上, 造成视力减退等眼疾, 严重威胁人体健康[5]。 日本于2006年实施的“ 肯定列表制度” 规定: 禽蛋中斑蝥黄的最大残留限量为0.1 mg· kg-1, 中国尚无斑蝥黄残留限标准[6]。 目前, 食品中斑蝥黄的检测方法主要有高效液相色谱法[7]、 高效液相色谱-串联质谱法[8]、 反相高效液相色谱法[9, 10]和超高效液相色谱-串联质谱法[11]。 尽管这些方法具有高灵敏度、 高特异性等优点, 但也存在设备要求高、 前处理过程复杂、 成本高、 耗时长等缺点, 无法普及和推广。 因此, 发展简单、 低成本、 高灵敏度快速检测蛋黄中斑蝥黄的方法, 对于消除食品安全隐患具有十分重要的意义。
导数光谱亦称微分光谱, 是紫外吸收光谱派生的一个分支, 目前文献报道的最高为四阶导数光谱。 导数光谱法对复杂组分可不经分离而直接测定, 方法简便、 快速、 准确, 近年来在药物制剂分析中得到广泛应用[12, 13]。 食品安全分析由于对灵敏度要求比较高, 导数光谱法经常无法满足要求。 但斑蝥黄作为着色剂添加到蛋黄中的量是非常可观的, 有文献报道: 普通鸡蛋每100 g干蛋黄粉中总类胡萝卜素含量为4.5 mg; 而色度达到15的红心蛋每100 g干蛋黄粉中总类胡萝卜素含量高达9.25 mg[14]。 蛋黄中含水量在48%左右, 那么色度15的红心蛋中斑蝥黄的添加量为每100 g蛋黄中斑蝥黄含量约2.47 mg, 如此大含量的斑蝥黄用紫外-可见分光光度计可以满足测量要求。
本文将紫外-可见分光光度法与一阶导数光谱法有机结合, 解决了斑蝥黄和蛋黄提取液两者吸收光谱严重重叠而引起的干扰问题, 实现了复杂基质中斑蝥黄的快速、 灵敏检测。
TU-1900双光束紫外-可见分光光度计(北京普析通用仪器有限公司); BSA224S电子分析天平(赛多利斯科学仪器有限公司); Heal Force台式高速冷冻离心机(力康生物科技公司); LX-400迷你离心机(其林贝尔仪器制造有限公司); THZ-C台式恒温振荡器(上海隆拓仪器设备有限公司)。
新鲜鸡蛋(市售); 斑蝥黄标准品购于上海源叶试剂公司; 甲醇、 乙醇、 乙腈、 石油醚和氯仿等(分析纯, 国药集团化学试剂有限公司)。
新鲜鸡蛋敲开, 分出蛋清保留蛋黄部分, 用玻璃棒搅拌均匀, 量出体积。 以体积比为3:1的乙醇和氯仿混合溶剂作为提取剂, 料液比为1:4, 在室温条件下进行提取, 离心分离, 每次提取5 min, 提取3次, 提取液用化学定性分析滤纸过滤一次。
斑蝥黄标准品 5 mg, 用氯仿溶解并定容至5 mL, 配成浓度为1 mg· mL-1标准储备液。 使用前用乙醇和氯仿混合溶剂稀释成不同浓度的标准液, 保证最终溶液里乙醇和氯仿体积比为2:1, 用于建立标准曲线。
量取提取液体积, 运用紫外-可见分光光度计在波长为200~800 nm 范围内, 光谱带宽 1 nm, 间隔1 nm 的条件下进行光谱扫描。 扫描前两次校正基线, 第一次用空气校正, 第二次用体积比为3:1的乙醇和氯仿的混合溶剂校正。
获得的紫外-可见吸收光谱, 运用Origin软件对其求一阶导数, 并使用Adjacent-Averaging方法对一阶导数光谱进行平滑处理。 确定测量斑蝥黄含量的波长, 获得标准曲线及回归方程。
选取新鲜鸡蛋蛋黄(已验证无斑蝥黄)作为添加回收实验样品。 前处理方法: 称取均质后蛋黄液3份, 每份各1.000 mL , 置于3个15 mL离心管中, 分别添加1.000, 3.000和5.000 μ g斑蝥黄标准品, 静置10 min后分别加入4 mL体积比为3:1的乙醇和氯仿的混合溶剂, 充分振荡均匀, 室温提取5 min, 然后以5 000 r· min-1的转速离心5 min, 分出提取液。 提取3次, 合并提取液。 提取液用化学定性分析滤纸过滤一次, 保留待测。
蛋黄中的色素主要包括叶黄素和玉米黄素, 还含有少量黄体素、 胡萝卜素及核黄素等。 叶黄素、 玉米黄素和斑蝥黄均为线性多烯分子、 且分子量接近, 相似的结构使得它们通常被同时被提取、 很难分离[15]。 但它们各自的结构特点: 叶黄素和玉米黄素为含有羟基的黄色系类胡萝卜素; 而斑蝥黄是含有羰基的红色系类胡萝卜素。 又使得它们在不同溶剂中的溶解能力不同。 为了便于肉眼观察蛋黄色素提取效率, 试图寻找一种能同时提取蛋黄色素和斑蝥黄的溶剂。 为了提取蛋黄中天然色素, 分别选用甲醇、 乙醇、 乙腈、 石油醚和氯仿作为溶剂, 实验发现: 乙醇能最快最大量的将蛋黄色素萃取出来。 同时试验了斑蝥黄在甲醇、 乙醇、 乙腈、 石油醚和氯仿中的溶解度, 发现斑蝥黄在氯仿中溶解能力最强。 选用乙醇和氯仿的混合溶剂作为蛋黄色素提取剂。 因氯仿环境毒性较大, 尽量少用的原则, 考察了混合提取剂中氯仿的最小用量, 实验结果表明: 氯仿的体积含量至少为四分之一时, 提取效率满足要求。 当用混合提取剂处理蛋黄液时, 蛋黄即时褪色, 每次提取时间5分钟足够, 蛋黄中的天然色素和斑蝥黄均为线性多烯结构, 容易发生氧化, 提取温度不宜高, 选择室温且提取出来的色素低温避光保存, 避免发生氧化。
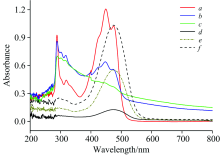
三次蛋黄提取液的紫外-可见吸收光谱见图1中曲线a, b, c, 不同浓度斑蝥黄的紫外-可见吸收光谱见图1中曲线d, e, f, 蛋黄提取液和斑蝥黄两者的吸收光谱在波长280~600 nm范围内严重重叠, 因此无法采用传统紫外-可见分光光度法直接测定蛋黄中斑蝥黄含量。 蛋黄提取液和斑蝥黄, 尽管两者的紫外-可见吸收光谱严重重叠, 但是振幅和最大吸收峰位置有差别: 蛋黄提取液最大吸收强度在520 nm, 而斑蝥黄的最大吸收强度在580 nm; 蛋黄提取液的最大吸收峰位于448 nm, 而斑蝥黄的最大吸收峰和蛋黄提取液的最大吸收峰的亚峰重合, 位于474 nm。 振幅和吸收峰位置的微小差别使得可以采用导数光谱法对所得数据进行处理以消除蛋黄提取液对斑蝥黄检测的干扰。
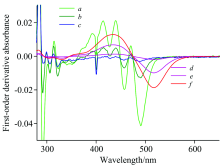
通过一阶导数光谱法处理图1的6条谱线, 得到一阶导数光谱如图2。 由图2中曲线a, b, c可知: 在波长448, 467, 474和520 nm处三次蛋黄提取液的一阶导数光谱交叉于0点, 在520 nm后蛋黄提取液的一阶导数光谱与基线重合、 无吸收; 由图2中曲线d, e, f可知: 不同浓度斑蝥黄的一阶导数光谱在波长474及580 nm处交叉于0点, 580 nm后无吸收。 综合分析发现: 斑蝥黄和蛋黄提取液混合物的一阶导数光谱在474 nm都交叉于0点, 在448, 467及520~579 nm处蛋黄提取液的一阶导数光谱交叉于0点, 而斑蝥黄的一阶导数光谱值处于非0交叉点。 当在某一波长时: 物质(一)的一阶导数光谱交叉于0点, 而物质二的一阶导数光谱处于非0交叉点, 此波长下两者混合物的一阶导数光谱值与物质一无关, 只与物质(二)浓度正相关。 因此, 448, 467及520~579 nm可作为斑蝥黄的检测波长。 蛋黄提取液除了包含叶黄素和玉米黄素等天然色素外, 还含有其他易溶于溶剂的蛋黄组分, 蛋黄提取液为多种物质的混合物, 但可以扫出吸收光谱, 蛋黄提取液和斑蝥黄的吸收光谱的振幅和吸收峰存在微小差异可以采用导数光谱法对所得光谱进行处理以消除蛋黄提取液中色素对斑蝥黄检测的干扰, 实现不分离情况下的快速检测。
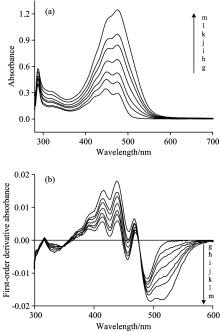
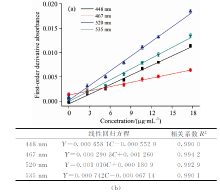
通过对斑蝥黄标准系列的光谱扫描曲线[见图3(a)]进行一次微分得一阶导数光谱[见图3(b)], 利用此光谱获得一阶导数光谱曲线上448, 467, 520和535 nm处的特征值。 以斑蝥黄的浓度为横坐标, 以一阶导数光谱绝对值为纵坐标, 建立工作曲线, 见图4(a)。 在0~18 μ g· mL-1范围内四条曲线均符合线性关系, 回归方程和线性系数见图4(b)。 按照IUPAC建议, 根据空白溶液基线噪声信号的3倍(3δ 评判标准)对应的待分析物的浓度, 四条直线的检出限分别为2.03, 1.12, 0.58和1.35 μ g· mL-1。 520 nm波长下的一阶导数光谱对应的标准曲线斜率最大、 线性系数较高、 检出限最低。 因此520 nm条件下可获得最优工作曲线, 以此进行后续实验。
分别来自不同养殖场的三个新鲜鸡蛋样本, 首先按照建立的方法进行斑蝥黄含量检测, 实验结果表明: 被检的鸡蛋样本不含有斑蝥黄。 用此不含斑蝥黄的鸡蛋样本做添加回收实验, 实验结果见表1, 样品的回收率在96.4%~102.8%之间, 相对标准偏差2.53%~5.67%之间, 说明建立的方法能检测蛋黄中残留的斑蝥黄, 并且检测的准确度和精密度良好, 符合检测要求。
| 表1 样品的加标回收实验(n=5) Table 1 Standard-added recovery experiments of the samples (n=5) |
基于紫外-可见吸收光谱及一阶导数光谱技术, 构建了蛋黄中斑蝥黄残留的快速检测方法。 通过对蛋黄提取液和斑蝥黄标准溶液的紫外-可见吸收光谱进行一阶导数处理, 根据两者一阶导数光谱0及非0交叉点的位置特征, 确定斑蝥黄检测波长为448, 467及520~579 nm, 根据工作曲线的线性关系和检测限, 最终确定520 nm为最优检测波长。 在优化实验条下, 斑蝥黄的一阶导数光谱绝对值与斑蝥黄浓度在0~17.68 μ g· mL-1 范围内呈良好的线性关系, 检出限0.58 μ g· mL-1。 为了验证该方法在实际样品中的检测效果, 取三个养殖场的鸡蛋样本进行了添加回收实验, 平均回收率在96.4%~102.8%之间, 相对标准偏差2.53%~5.67%, 说明建立的方法能检测蛋黄中残留的斑蝥黄, 并且检测的准确度和精密度良好, 符合检测要求。 这种方法无需复杂的样品前处理、 无需大型仪器设备, 且灵敏度高、 操作简单、 成本低、 检测时间短, 建议在食品安全分析中广泛推广和使用。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|