作者简介: 张菲菲, 女, 1992年生, 安徽农业大学硕士研究生 e-mail: 2434179162@qq.com
棕榈藤(rattan)属于棕榈科(Palmae)省藤亚科藤类植物, 是一种产于热带森林中, 仅次于木材和竹材的、 重要的非木材林产品, 具有很高的经济价值和开发前景。 全球棕榈藤总共有13个属660余种, 其中我国自然分布有4属37种5变种, 但有较高经济价值的不到30种。 由于目前对棕榈藤的细胞结构, 尤其是藤纤维的细胞壁结构知之甚少, 严重限制了对棕榈藤材的研究和加工利用。 因此, 为构建棕榈藤材纤维细胞壁结构模型, 以高地钩叶藤( Plectocomia himalayana Griff.)为研究对象, 对其基部、 2 m处、 中部和梢部四个部位分别截取试样、 软化、 聚乙二醇包埋、 切片。 切片在室温下经0.2 mol·L-1的硼氢化钠(NaBH4)溶液浸泡5~6 h后用蒸馏水洗净, 利用LabRam XploRA显微共聚焦拉曼光谱仪, 采用逐点扫描显微探针成像方法获取光谱数据集。 将获得的光谱数据利用LabSpec5软件进行处理, 从而得到藤茎不同部位藤皮、 藤中、 藤芯处纤维细胞次生壁中层(S2)主要成分, 即纤维素、 半纤维素、 木质素相对含量, 并就相对含量在径向、 轴向变异进行了分析。 结果表明, 在径向上, 高地钩叶藤藤皮处纤维细胞S2层纤维素与半纤维素相对含量最高, 木质素相对含量最低; 而藤芯处纤维细胞S2层纤维素与半纤维素相对含量最低, 木质素相对含量最高; 藤中处纤维素、 半纤维素及木质素相对含量居中。 在轴向上即不同藤龄处, 藤皮纤维细胞S2层纤维素和半纤维素的相对含量在2 m处最大, 木质素的相对含量在梢部最大; 藤芯纤维细胞S2层纤维素、 木质素、 半纤维素的相对含量分别在中部、 2 m处、 基部处最大。 藤皮、 藤芯与藤茎一样, 纤维细胞S2层纤维素相对含量最小值在梢部, 半纤维素和木质素相对含量均在中部最少。 分析可知, 棕榈藤藤茎不同部位, 藤纤维细胞壁中层(S2)纤维素、 半纤维素及木质素相对含量是不同的。
Rattan, belonging to Calamoideae of Palmae, is a multipurpose plant resource found in highly tropical forest, and it is an important non-timber forest product inferior to timber and bamboo, with high economic value and development prospects. There are 13 genera and more than 660 species in the world, of which 4 genera and 37 species of 5 varieties are naturally distributed in China, but there are less than 30 species with high economic value. At present, little is known about the cell structure of rattan, especially the cell wall structure of fiber, which seriously limits the research, processing and utilization of rattan. Therefore, in order to construct the fiber wall structure model of rattan, Plectocomia himalayana was chosen as the research material, and from which samples were cut, softened, embedded with polyethylene glycol and sliced at the base, 2 m, middle and tip respectively. After the slices were soaked in 0.2 mol·L-1 NaBH4 for 5~6 h at room temperature and washed with distilled water, the spectral data were obtained by point-by-point scanning microscopic probe imaging method with the LabRam XploRA microscopic confocal Raman spectrometer. The relative content of cellulose, hemicellulose and lignin in the central layer of secondary wall (S2) of fiber in cortex, middle layer and core at different parts of P. himalayana cane was obtained after the spectral data were processed by LabSpec 5 software, and then the variation of relative content in radial direction and axial direction was also analyzed. The research results show that, in terms of S2 of fiber at 2 m, the relative content of cellulose and hemicellulose is the highest and the relative content of lignin is the lowest in cortex, while the relative content of cellulose and hemicellulose is the lowest and the relative content of lignin is the highest in core, and the relative content of cellulose, hemicellulose and lignin in middle layer is between that of cortex and core in the radial direction. In the axial direction, the relative content of cellulose and hemicellulose of S2 of fiber in cortex is the highest at 2 m, and that of lignin in tip is the highest. The relative content of cellulose, lignin and hemicellulose of S2 of fiber in core is the highest at the middle, 2 m and base respectively. The cortex and core are the same as cane of rattan, the relative content of cellulose in S2 of fiber is the minimum in the tip, and that of hemicellulose and lignin is the least in the middle. Based on the above analysis, the relative contents of cellulose, hemicellulose and lignin in S2 of rattan fiber are different in different parts of rattan.
棕榈藤(rattan)属于棕榈科(Palmae)藤类植物, 是具有重要经济价值和开发前景的热带和亚热带森林植物资源, 其藤茎即原藤具有多种用途, 为仅次于木材和竹材的、 重要的非木材的林产品。 世界棕榈藤总共有13个属660余种, 中国自然分布有4属37种5变种, 但有较高经济价值的不到30种[1, 2]。
高地钩叶藤(Plectocomia himalayana Griff.)属棕榈科省藤亚科钩叶藤属, 攀援、 丛生, 属于大径藤(藤径4~5 cm)。 在我国主要分布于云南南部、 西南部、 西部地区海拔1 450~1 800 m的箐沟、 竹林、 山地常绿阔叶林中; 其藤茎质地较粗糙, 属于劣质材, 一般适用于编织较粗糙的藤器或扎栏[1, 2]。 目前, 关于高地钩叶藤的研究报道主要集中在解剖构造等方面[3, 4, 5], 关于化学性质方面的研究, 还未见报道。
藤材化学成分主要包括纤维素、 半纤维素、 木质素, 及抽提物、 灰分等。 传统的植物细胞壁的化学分析都需要将植物组织分解、 是破坏性的, 而且传统的化学成分分析, 仅仅显示了生物质中三大组分(纤维素、 半纤维素和木质素)在宏观区域的含量和变异。 如曹积微等对云南省藤、 版纳省藤、 钩叶藤的化学组成进行了简单地测试分析[6]; 尚莉莉对钩叶藤的研究发现, 藤皮处的纤维素含量高于藤芯、 而藤皮处的半纤维素含量却低于藤芯, 且藤茎基部含量比中部和梢部要多。 这些研究未体现出微观的化学成分变异。
尽管针对木材、 竹材等细胞的化学成分微区分布有了较为详细的研究[7], 但涉及到棕榈藤材细胞壁微区化学的变化的研究就相对更少, 如汪佑宏等[8]对黄藤材纤维细胞的木质素分布进行了研究, 发现纤维细胞角隅处木质素含量要比次生壁高, 且胞壁各微区的木质素含量为次生壁< 初生壁< 胞间层。 刘杏娥[9]结合了共聚焦显微荧光和拉曼光谱成像技术系统, 研究了黄藤材藤茎中不同类型细胞以及同一细胞不同形态区域的木质素化学特点, 发现细胞角隅、 胞间层和复合胞间层的拉曼信号强度最高, 具有较高的木质化程度, 而次生壁中宽层拉曼特征峰强度最低, 窄层较宽层高等。
综上所述, 针对棕榈藤材, 尤其是高地钩叶藤细胞壁主要成分的微区分布研究, 还有待进一步深入。
取生长健康的高地钩叶藤1根, 在基部、 2 m处、 中部和梢部四个部位, 分别截取长约1 cm的试样, 编号后进行软化、 聚乙二醇(炭蜡)包埋, 利用旋转式切片机切取横切面10 μ m切片, 并将切片在室温下用0.2 mol· L-1的硼氢化钠(NaBH4)溶液浸泡5~6 h, 后用蒸馏水洗净, 最后将处理过的切片浸泡在蒸馏水中编号备用。
LabRam XploRA显微共聚焦拉曼光谱仪(Horiba Jobin Yvon公司), KD1508A型轮转式切片机(浙江金华科迪仪器设备有限公司)等。
显微拉曼光谱的采集: 利用LabRam XploRA显微共聚焦拉曼光谱仪, 采用逐点扫描显微探针成像方法获取光谱数据集。 扫描步长为0.8 μ m, 激发波长为532 nm, 功率8 mW, 单点采集时间1 s, 狭缝宽度100 μ m, 孔隙大小为300 μ m, 拉曼光谱测试范围为250~3200 cm-1。 为获得较高的空间分辨率(拉曼光谱仪的空间分辨率理论计算值为0.61 λ /NA), 采用100倍油镜(MPlan 100× , oil, NA=1.35), 计算机控制平台的同步移动、 数据采集和数据处理。 将存放在蒸馏水中的样品取出, 固定在载玻片上, 置于拉曼显微镜下观察、 测定, 获得的光谱数据利用LabSpec5软件进行处理。
图1为纤维细胞S2层的平均拉曼光谱。 图中纤维素的主要特征峰为2 890, 1 376, 1 115, 1 096和378 cm-1; 木质素的主要特征峰为1 680和1 598 cm-1。 2 890 cm-1归属于纤维素C— H和CH2的对称伸缩振动, 1 096 cm-1是纤维素C— O— C糖苷键的非对称伸缩振动, 378 cm-1归属于纤维素β -D葡萄糖苷键。 1 680 cm-1归属于松柏醇/紫丁香醇和松柏醛/紫丁香醛结构, 1 598 cm-1归属于苯环的对称伸缩振动, 而1 090 cm-1是重原子(CC和CO)的伸缩振动, 对应的主要组分是纤维素、 木聚糖、 葡甘露聚糖(其中木聚糖与葡甘聚糖是组成半纤维素的重要物质(见表1)。
| 表1 纤维细胞壁S2层主要组分的平均拉曼光谱分布[10] Table 1 The distribution of average Raman spectrum of main components in S2 layer of fiber cell wall |
取2 m处试样, 在切片的藤皮、 藤中和藤芯三个部位分别选择具有代表性的纤维细胞进行逐点扫描, 并选取纤维细胞次生壁中层(S2)与纤维细胞角隅处(CC)的线谱进行线谱分析(见图2)。 从图2(a)可以看出, 除了在特征峰1 090 cm-1处藤皮峰高稍高于藤中外, 藤皮与藤中处的拉曼光谱差异很小; 这说明, 除了半纤维素含量有较小差异外, 藤皮和藤中纤维细胞S2层的化学成分相对含量基本没有什么差别。 而藤芯处的拉曼光谱在特征峰2 890和1 090 cm-1处的峰高均明显低于藤皮和藤中处, 在特征峰1 598和1 680 cm-1处的峰高又明显的高于藤皮与藤中处, 由此可见, 藤芯处纤维细胞S2层纤维素与半纤维素的相对含量低于藤皮和藤中, 而木质素的相对含量高于藤皮和藤中。
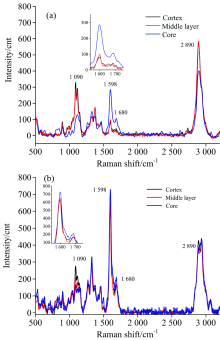 | 图2 径向不同部位纤维细胞S2层(a) 与CC处(b)拉曼线谱分析Fig.2 Raman line-spectra of S2 layer (a) and CC (b) of fiber cell at different radial positions |
从图2(b)可以看出, 在特征峰2 890 cm-1处, 藤皮纤维CC处线谱峰高高于藤中和藤芯, 藤中与藤芯在此处差异很小; 说明该藤材纤维细胞角隅处纤维素相对含量在藤皮处最高, 藤中与藤芯处相近且较低。 在特征峰1 598 cm-1处, 将图谱局部放大后可看出, 藤芯处峰高最高, 其次是藤中, 藤皮最低, 其中藤皮与藤中相差很小; 说明高地钩叶藤纤维细胞角隅处木质素相对含量在藤芯位置最高, 而藤中处含量略大于藤皮处。 特征峰1 090 cm-1的峰高呈藤皮高于藤中、 藤中高于藤芯, 说明该藤材纤维细胞角隅处半纤维素的相对含量在藤皮处最大, 其次是藤中, 而藤芯处最小。
以上对该藤材纤维细胞的S2层和CC处化学成分分别进行径向的比较, 可以得出纤维细胞S2层和CC处纤维素、 木质素与半纤维素的径向变化规律相近。 从而可以推断纤维细胞纤维素与半纤维素相对含量的在藤皮处最高, 藤芯处最小; 相反的, 木质素的相对含量在藤芯处最高, 藤皮处最小。
在高地钩叶藤茎不同高度上(基部、 2 m处、 中部和梢部四个部位), 分别选取具有代表性的藤皮和藤芯纤维细胞进行逐点扫描, 并选取S2层的线谱进行了线谱分析(见图3)。 从图3(a)(藤皮)可以看出在特征峰2 890 cm-1处, 2 m处的峰强度最大, 其次是基部, 中部比基部稍小, 梢部的峰强度最小; 说明该藤材藤皮纤维细胞S2层纤维素的相对含量在生长高度2 m处最大, 在梢部的相对含量最小, 而基部纤维素相对含量略大于中部。 在特征峰1 598 cm-1处可以看出, 梢部的峰强度最大, 其他位置的峰强度差别不大, 但基部峰强度稍高于2 m处和中部; 说明藤皮纤维细胞S2层木质素的相对含量在梢部最大, 且明显高于其他部位。 在特征峰1 090 cm-1处可以看出, 2 m处的峰强度明显比其他位置大, 基部和梢部的峰强度差不多, 中部的峰强度最小。 说明藤皮纤维纤维细胞S2层半纤维素的相对含量在2 m处最大, 中部相对含量最小, 基部与梢部相对含量比中部稍大, 但比2 m处小很多。
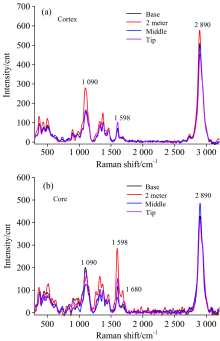 | 图3 轴向不同部位纤维细胞S2层拉曼线谱分析 (a): 藤皮; (b): 藤芯Fig.3 Raman line-spectra of S2 layer of fiber cell at different axial positions (a): Cortex; (b): Core |
从图3(b)(藤芯)可以看出在特征峰2 890 cm-1处, 轴向上中部的峰强度最大, 其次是基部, 梢部最小, 但基部、 2 m处和梢部差别很小; 说明高地钩叶藤材在中部的藤芯纤维细胞S2层纤维素的相对含量最大, 梢部纤维细胞S2层纤维素相对含量最小, 基部S2层纤维素相对含量略大于2 m处, 但与梢部间差异均较小。 在特征峰1 598和1 680 cm-1处均可以看出, 在2 m处的峰强度最大, 其次是梢部、 基部, 中部的峰强度最小, 且各位置对应的峰强度区别明显; 说明在轴向, 就藤芯纤维细胞S2层木质素的相对含量而言, 2 m处最大, 其次是梢部、 基部, 而中部最小。 在特征峰1 090 cm-1处, 图中可以明显的看出, 基部的峰强度最大, 其次是梢部, 中部的峰强度最小; 说明藤芯纤维细胞S2层半纤维素的相对含量在基部最高、 中部最小, 梢部略高于2 m处。
从以上对藤皮和藤芯两处的纤维细胞S2层化学成分的轴向比较分析, 可以看出藤皮纤维细胞壁S2层纤维素和半纤维素的相对含量在2 m处最大, 木质素的相对含量在梢部位置最大。 随着高地钩叶藤轴向高度的增加即随着藤龄的减小, 藤皮处纤维细胞壁S2层纤维素的相对含量先增加, 到达一定年份后会逐渐减少; 木质素相对含量先减少, 到达一定年份后又会上升; 半纤维素相对含量的呈“ 增-降-增” 的变化趋势。 藤芯纤维细胞壁S2层纤维素、 木质素、 半纤维素的相对含量分别在中部、 2m处、 基部处最大。 随着高地钩叶藤轴向高度的增加即随着藤龄的减小, 藤芯处纤维细胞壁S2层纤维素的相对含量呈“ 降-增-降” 的变化趋势; 木质素的相对含量的变化趋势与纤维素刚好相反, 即随着藤茎生长年份的减小先增加, 到达一定年份后逐渐下降后又上升; 半纤维素相对含量先下降后上升, 说明随着藤茎生长年份的减少, 半纤维素的相对含量先逐渐降低后上升。 这些变化都说明了随着藤茎的生长年份的增加, 细胞会逐渐成熟、 然后衰老, 化学成分也会随之变化。
高地钩叶藤纤维细胞壁S2层中, 纤维素与半纤维素相对含量在藤皮处最高, 藤芯处最小; 相反的, 木质素的相对含量在藤芯处最高, 藤皮处最小。
高地钩叶藤藤皮纤维细胞壁S2层纤维素和半纤维素的相对含量在2 m处最大, 木质素的相对含量在梢部最大; 藤芯纤维细胞壁S2层纤维素、 木质素、 半纤维素的相对含量分别在中部、 2 m处、 基部处最大。 藤皮和藤芯一样, 即藤茎纤维细胞壁S2层纤维素相对含量最小值在梢部, 半纤维素和木质素相对含量均在中部最少。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|



