作者简介: 冯 龙, 1988年生, 国际竹藤中心工程师 e-mail: fenglong@icbr.ac.cn
采用532 nm共聚焦显微拉曼光谱技术原位状态下研究了黄藤藤茎纤维及导管细胞壁中纤维素微纤丝空间取向差异。 在高数值孔径(NA=1.25)物镜测试条件下, C—H伸缩振动(2 771~3 000 cm-1)特征峰峰面积拉曼成像成功的区分出细胞角隅、 复合胞间层以及次生壁。 进一步发现纤维细胞次生壁呈宽窄交替的同心层状结构, 而导管次生壁无明显的分层结构。 采用平行于细胞径向壁的拉曼偏振激光进行光谱成像发现纤维细胞次生壁窄层纤维素C—O—C(1 097 cm-1)拉曼信号强度明显高于宽层, 即窄层中微纤丝取向更加平行于入射激光偏振方向, 与细胞轴夹角更大, 而导管次生壁中微纤丝取向较为均一。 细胞壁不同形态区域拉曼光谱分析发现纤维素C—O—C特征峰以及CH和CH2特征峰的拉曼信号强度与入射激光的偏振方向存在明显的相关性。 当入射偏振激光的电矢量方向从平行变化到垂直于微纤丝方向时, 其糖苷键C—O—C非对称伸缩振动信号减弱, 而CH和CH2的取向在与入射偏振激光的电矢量方向垂直时, 其拉曼信号强度相较于平行状态略微降低, 表明纤维素特征峰中的糖苷键C—O—C的非对称伸缩振动比CH和CH2伸缩振动对拉曼偏振光的方向改变更为敏感。 比较纤维细胞宽层与窄层的拉曼光谱发现径向次生壁窄层1 097 cm-1处拉曼信号强度明显高于弦向次生壁窄层, 而径向次生壁宽层的2 897 cm-1处拉曼信号强度低于弦向次生壁宽层。 拉曼特征峰比值( I1 095 /I2 897)可用来定性研究细胞壁微纤丝角, 结果发现这一比值在导管次生壁、 纤维细胞窄层和纤维细胞宽层中分别为1.32~1.10, 0.92~0.55和0.42~0.33, 表明导管次生壁具有最大的微纤丝角, 纤维细胞窄层次之, 宽层最小。 该研究为解析藤材细胞壁骨架空间结构、 化学成分分布以及微力学特性提供了新型的分析手段和重要的理论指导。
The variation in the microfibrils orientation of the Daemonorops jenkinsiana multilayered fiber and vessel was in-situ studied by polarized laser Raman spectroscopy with 532 nm exciting laser and a high-NA objective lens (1.25). Raman imaging obtained by integrating over the band range from 2 771 to 3 000 cm-1 displayed the morphologically distinct cell wall regions, including cell corner middle lamella, compound middle lamella and secondary wall. Furthermore, the fiber secondary wall displayed a concentric structure with alternating broad and narrow layers, while vessels had no obvious layering structure. Higher Raman C—O—C band (1 097 cm-1) intensity was visualized within the narrow layer of fiber wall from polarized laser Raman images, indicating the microfibrilsin these regions were more parallel to the incident laser electric vector and more perpendicular to the cell axis. The microfibrils orientation in vessel was uniform with in its secondary wall. Raman spectral analysis of different morphological areas of cell wall evidenced the band intensities of the C—O—C, CH and CH2 modes had a significant correlation with the polarization direction of incident light. When the orientation of cellulose microfibrils changed from parallel in respect to the fiber axis to with a high angle, the C—O—C signal reduced obviously. By comparison, the signal of CH and CH2 displayed slight decrease when changing the direction of incident laser, indicating the more sensitive nature of C—O—C vibration modes to polarization direction of incident light. Comparing the Raman spectra extracted from the narrow (Nl-R), broad layer (Bl-R) of fiber radial wall, as well as narrow (Nl-T), broad layer (Bl-T) of fiber tangential wall, it was found that the Nl-R had higher 1 097 cm-1 band intensity, while Bl-T displayed higher 2 897 cm-1 band intensity. Raman band ratio ( I1 095 /I2 897) can be used to predict microfibrils angle (MFA) in different cell wall types, qualitatively. The results showed that the ratio was highest in vessel secondary wall (1.32~1.10), followed by narrow layer of fiber secondary wall (0.92~0.55), and lowest in the broad layer of fiber secondary wall (0.42~0.33), indicating the highest MFA in the vessel secondary wall. This study provided a novel method and important theoretical guidance for the investigation on cell wall architecture, chemical composition distribution and micromechanics.
拉曼光谱技术能够灵敏的检测聚合物分子链的构象和链间相互作用, 进而揭示聚合物结构单元、 空间构型、 晶态结构、 分子链的物理构象或分子链在各向异性材料中的排列等信息[1]。 其衍生出的共聚焦显微拉曼光谱技术、 拉曼成像技术和偏振光拉曼技术等广泛应用于材料科学、 植物学、 生物医学等领域[2]。 在植物学研究中, 显微拉曼光谱技术可以在不破坏样品结构的情况下快速、 灵敏的检测出植物组织化学组成[3]及分布[4], 结合偏振光技术还能够获得植物细胞壁中纤维素微纤丝取向等重要结构信息[5]。
在植物细胞壁中, 纤维素作为骨架物质以微纤丝的形式存在。 细胞壁形成过程中受外界应力的影响, 其亚层的微纤丝逐渐螺旋扭转, 形成复杂的三维交错网状结构。 亚层的微纤丝排列规律直接影响植物细胞壁力学性能, 因此细胞壁微纤丝取向研究对理解植物细胞壁结构和解译多尺度力学差异具有重要的意义[6]。 目前研究植物细胞壁微纤丝的手段主要有X射线衍射仪、 原子力显微镜和显微红外光谱。 其中X射线衍射仪仅能获取细胞壁平均微纤丝角[7], 原子力显微镜测量纤维素微纤丝存在一定的随机性, 且无法获得微纤丝在细胞壁各亚层中的取向差异[8], 显微红外光谱受限于较低的空间分辨率(透射模式下为6.24 μ m, ATR模式下为1.56 μ m), 难以准确获得细胞壁(厚度10~20 μ m)及细胞壁亚层(厚度0.3~1.5 μ m)的微纤丝取向信息[9]。 相比较而言, 共聚焦显微拉曼光谱技术具有较高的空间分辨率(0.3~0.5 μ m), 可以在不破坏细胞壁原有结构的前提下, 获得细胞壁乃至细胞壁亚层的组分分布及取向信息[10]。 本文利用偏振光拉曼光谱成像技术研究了具有优异柔韧性的黄藤藤茎中纤维细胞和导管的微纤丝取向规律, 研究结果加深了对藤材细胞壁空间结构的全面认识, 促进显微拉曼光谱技术在植物细胞壁精细结构领域研究发挥更为重要的作用。
黄藤(Daemonorops jenkinsiana)茎长约25 m, 采自国际竹藤中心三亚热带竹藤种质资源库。 从基部至梢部第10节节间截取藤茎, 利用单面刀片分割成长× 宽× 高(0.5 cm× 0.5 cm× 1.0 cm) 大小的矩形样品块, 然后利用滑走式切片机(Leica RM 2010R)在横截面切取15 μ m厚的切片, 保存在超纯水中供共聚焦拉曼光谱成像使用。
采用显微共聚焦拉曼光谱(HR Evolution, Horiba Jobin Yvon)进行光谱采集和成像。 为获得较高的空间分辨率, 光谱采集时采用100倍油镜(MPlan100× , Oil, NA=1.25)以及532 nm激发波长, 激光功率为8 mW。 测试时光栅为300 mm-1, 狭缝宽度为100 μ m, 扫描步距0.5 μ m, 单点光谱采集时间1 s, 光谱测定范围500~3 100 cm-1, 光谱分辨率2 cm-1, 最后利用LabSpec6软件对获得数据进行后期处理, 光谱特征峰比值通过峰面积比值计算获得。
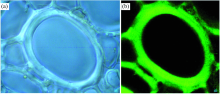
通过CH伸缩振动(2 771~3 000 cm-1)特征峰峰面积成像可清楚的分辨细胞角隅、 复合胞间层和宽、 窄层交替的纤维细胞次生壁亚层[图2(b)]。 鉴于共聚焦显微拉曼光谱的理论空间分辨率(0.61λ /NA=0.26 μ m)略大于复合胞间层(0.1~0.2 μ m)尺寸, 因此复合胞间层区域很可能包含了邻近次生壁的部分化学信息。 不同于纤维细胞, 导管次生壁没有呈现出宽窄交替的分层结构[图2(b)]。
入射激光的传播方向通常由电矢量和磁矢量复合而成, 本研究中拉曼入射偏振激光的电矢量方向平行于纤维和导管细胞径向壁而垂直于细胞弦向壁, 两者空间关系如图3所示。 研究指出天然纤维素拉曼光谱中的3个主要特征峰位于380, 1 097和2 897 cm-1处, 分别归属于吡喃环C— C— C的对称弯曲振动、 糖苷键C— O— C的非对称伸缩振动、 以及CH和CH2的伸缩振动[11]。 其中纤维素C— O— C特征峰(1 097 cm-1)以及CH和CH2特征峰(2 897 cm-1)的拉曼信号强度与入射激光的偏振方向存在明显的相关性[12]。
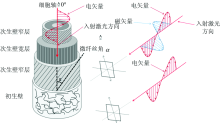 | 图3 拉曼激光偏振方向与细胞壁空间结构关系示意图Fig.3 Schematic of the spatial relationship between incident polarized laser and the D. jenkinsiana cell wall |
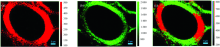
偏振光拉曼光谱1 083~1 100 cm-1积分成像发现纤维细胞次生壁窄层在径向具有较高的拉曼信号强度[图4(a)], 归因于窄层中纤维素的糖苷键C— O— C非对称伸缩振动更趋近平行于入射激光偏振方向, 即窄层中的微纤丝与细胞轴夹角更大, 具有更大的微纤丝角。 另外, 拉曼信号在同一细胞壁亚层中均一的强度分布表明微纤丝高度定向有序排列。 对2 840~2 930 cm-1区域进行积分, 纤维细胞弦向次生壁的宽层比窄层具有更高的拉曼信号强度[图4(b)], 说明宽层的CH和CH2伸缩振动更趋近平行于入射激光方向, 重叠图中可以清晰的看出糖苷键C— O— C与CH, CH2的空间分布规律[图4(c)]。 值得注意的是, 对光谱区域1 083~1 100 cm-1进行积分时, 图4(a)中的弦向壁几乎没有成像信号, 即当入射偏振激光的电矢量方向垂直于微纤丝时, 其糖苷键C— O— C非对称伸缩振动信号较弱, 而CH和CH2的取向即使在与入射偏振激光的电矢量方向垂直时, 其拉曼信号强度相较于平行状态略微降低[图4(b)], 这主要由于纤维素特征峰中的糖苷键C— O— C的非对称伸缩振动比CH和CH2伸缩振动对拉曼偏振光的方向改变更为敏感, 因此1 097 cm-1处的拉曼特征峰用于研究植物细胞壁中纤维素微纤丝空间取向具有更高的可信度。
采用同样的拉曼偏振光谱技术对导管成像发现平行于拉曼偏振激光电矢量方向的导管径向壁同样具有较高的纤维素糖苷键C— O— C非对称伸缩振动信号强度[图5(a)], 而弦向壁呈现出较高的CH, CH2伸缩振动信号强度[图5(b)], 亦验证了显微拉曼偏振光谱成像技术在植物细胞壁微纤丝空间取向研究的成功应用。 从图5(a)中可以发现, 当对光谱区域1 083~1 100 cm-1进行积分后, 其弦向壁微弱的糖苷键C— O— C非对称伸缩振动拉曼成像信号, 很可能是由于导管次生壁存在少量无序排列的微纤丝所导致。
随着入射偏振激光电矢量方向的变化, 纤维素的拉曼特征峰1 097 cm-1以及2 897 cm-1的强度大小也会随之改变。 当入射偏振激光电矢量方向与纤维素C— O— C平行时, 此时1 095 cm-1拉曼特征峰强度最高, 2 897 cm-1拉曼特征峰强度最低; 当入射偏振激光电矢量方向与纤维素C— O— C垂直时, 1 097 cm-1拉曼特征峰强度最低, 而2 897 cm-1拉曼特征峰强度最高[13]。 如图6所示, 分别在垂直及平行于入射偏振激光电矢量方向的条件下, 比较纤维细胞弦向壁和径向壁的宽层与窄层的拉曼光谱图, 对比图6(a)和(b)发现径向次生壁宽层的1 097 cm-1处拉曼信号强度明显高于弦向次生壁宽层, 而径向次生壁宽层的2 897 cm-1处拉曼信号强度低于弦向次生壁宽层。 由于纤维素分子链中糖苷键C— O— C与CH, CH2的空间取向近乎垂直, 因此当入射偏振激光电矢量方向与纤维素C— O— C平行时, 它与CH和CH2处于垂直关系, 所以当1 097 cm-1处拉曼信号强时, 2 897 cm-1处拉曼信号强度相对较弱。 比较纤维细胞径向壁宽层与窄层的拉曼光谱图发现[图6(b)和(d)], 纤维细胞径向壁窄层具有较强的纤维素C— O— C拉曼特征峰强度, 表明窄层中纤维素微纤丝取向更加趋近平行于入射偏振激光电矢量方向, 即径向壁窄层具有更大的微纤丝角。 径向壁窄层拉曼光谱中较低的2 897 cm-1处特征峰强度进一步支持了以上结果。 比较弦向壁宽、 窄层拉曼光谱发现, 1 097与2 897 cm-1处拉曼特征峰强度差异较小, 这主要由于拉曼入射偏振激光与微纤丝近乎垂直的空间关系[图6(a)和(c)]。
 | 图7 黄藤导管拉曼光谱 (a): 弦向壁; (b): 径向壁Fig.7 The Raman spectra extracted from vessel wall of D. jenkinsiana (a): Tangential wall; (b): Radial wall |
在相同的入射偏振激光电矢量与细胞壁空间关系条件下, 导管次生壁的拉曼光谱C— O— C与CH, CH2特征峰强度差异与纤维细胞的拉曼光谱分析结果一致, 亦证明了纤维素微纤丝的空间取向与入射激光偏振方向的相关性。 为了排除因物镜聚焦深度不同引起的拉曼信号强度差异, 本文选用1 097与2 897 cm-1特征峰强度比值来反映微纤丝的相对大小。 结果发现在导管、 纤维细胞次生壁窄层以及纤维细胞次生壁宽层中这一比值分别为1.32~1.10, 0.92~0.55, 0.42~0.33。 表明三者微纤丝角大小关系为导管> 纤维细胞次生壁窄层> 纤维细胞次生壁宽层。
采用高空间分辨率偏振光拉曼谱技术, 在细胞及亚细胞水平上揭示出黄藤纤维细胞和导管细胞壁中纤维素微纤丝的空间取向差异。 在宽窄层交替的纤维细胞中的微纤丝取向高度定向, 窄层的微纤丝更加趋近垂直于纤维细胞轴向; 而导管次生壁没有明显分层现象, 微纤丝取向较为均一。 纤维细胞次生壁窄层、 纤维细胞次生壁宽层以及导管三者微纤丝角大小关系为: 导管> 纤维细胞次生壁窄层> 纤维细胞次生壁宽层。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|