作者简介: 郭小莹, 女, 1996年生, 宁波大学食品与药学学院硕士研究生 e-mail: guoxiaoyingjz@163.com
基于表面增强拉曼光谱(SERS)拟建立一种适用于水产鱼制品中组胺含量的快速检测方法。 采用银纳米颗粒(Ag NPs)作为活性基底和氯化钠溶液作为聚集剂获取组胺的SERS特征峰, 并结合线性回归算法对鱼肉中的组胺含量进行测定分析。 首先对固体组胺、 组胺水溶液以及鱼肉提取液中组胺的SERS特征峰及归属进行表征分析, 然后对以Ag NPs的浓缩倍数与氯化钠溶液的浓度作为SERS基底的反应条件进行优化, 最后在该优化条件下对鱼肉中组胺进行定量分析。 结果表明, Ag NPs在400 nm处有最大吸光度, 通过透射电子显微镜观察颗粒的形状主要为球形, 均匀尺寸为30 nm左右。 利用4-巯基苯甲酸作为探针分子对其进行拉曼测试, 所得拉曼峰具有良好的重复性, 且拉曼强度很高。 因此该活性基底的合成方法不仅用时少、 易操作, 且合成的Ag NPs可作为可靠的增强基底应用于SERS试验中。 此外通过紫外-可见分光光度计检测得出氯化钠溶液使Ag NPs在溶液中发生团聚, 形成热点, 可实现SERS信号增强。 固体组胺的拉曼光谱图反映出1 167 cm-1处出现的特征峰主要是由N—H面内弯曲引起的; 1 236 cm-1处的特征峰主要是咪唑中C—H平面内弯曲和环呼吸引起的; 1 291 cm-1处主要与环伸展有关; 1 474 cm-1处的特征峰主要是由咪唑N—H面内弯曲振动和环伸展引起的。 优化反应条件在Ag NPs的浓缩倍数为15倍、 氯化钠溶液浓度为1 mol·L-1时表现出最高的增强效应, 并在该优化条件下检测了浓度为5~250 mg·L-1的组胺水溶液, 得出在该优化条件下检测到组胺水溶液的最低浓度为5 mg·L-1。 同时在该优化条件下采集了10~100 mg·L-1范围的鱼肉提取液中组胺的SERS光谱, 并建立组胺溶液的特征拉曼位移峰强度与浓度之间的线性回归模型。 得出在1 180, 1 258和1 425 cm-1处的特征峰与对应的拉曼峰强度值所建立的标准曲线有良好的线性关系( R2=0.918 1~0.947 3), 通过比较得出在1 258 cm-1处特征拉曼位移峰强度的 R2值最大, 且在鱼肉中组胺的最低检测浓度为10 mg·L-1, 远低于国标中水产品中组胺最大限量检测限50 mg·L-1。 因此选择1 258 cm-1处的标准曲线进行进一步的组胺检测。 最后通过对鱼肉提取液中添加组胺对该标准曲线进行检测验证, 得到回收率在100%~111%之间。 且通过高效液相色谱法验证该方法具有适用性。 由此表明选取银纳米颗粒作为活性基底、 氯化钠溶液作为聚集剂的表面增强拉曼光谱技术结合线性回归法建立标准曲线用于快速检测鱼肉中的组胺是可行且准确, 这为在鱼肉中的组胺含量的快速定量分析提供了参考依据。
A rapid method for the detection of histamine in fish products was developed in this study based on Surface-enhanced Raman spectroscopy (SERS). Silver nanoparticles (Ag NPs) were used as the active substrate and sodium chloride solution as an aggregating agent to obtain histamine SERS peaks. The histamine content in fish extracts was determined by linear regression algorithm. In this research, the normal Raman spectra of histamine powder, the SERS characteristic peaks and vibrational assignment of histamine standard solutions as well as histamine in fish extracts were analyzed. The SERS reaction conditions for the concentration of silver nanoparticles and sodium chloride solution were optimized. Lastly, the optimization conditions were used to quantitatively analyze the histamine in fish extracts. The results showed that the silver nanoparticles had the maximum absorbance at 400 nm. The shape of the nanoparticles was mainly spherical and the average size was about 30 nm. Then using 4-MBA as a probe molecule to detect the stability and sensitivity of Ag NPs and obtained Raman peak has good repeatability and high Raman intensity. Therefore, not only is the synthesis method of the active substrate less time-consuming and easy to operate, but the synthesized Ag NPs can be used as a reliable reinforcing substrate in the SERS test. In addition, it was proved by UV-Vis spectrophotometer that the NaCl solution can arouse the agglomeration of Ag NPs to form hot spots, which can enhance SERS signal. The Raman spectrum of solid histamine reflects that the characteristic peak appeared at 1 167 cm-1 due to the in-plane bending of N-H, the in-plane bending of imidazole in C—H plane and ring breathing (1 236 cm-1), the ring stretching (1 291 cm-1), the in-plane bending vibration of imidazole N—H and ring stretching (1 474 cm-1). Then the optimized reaction conditions showed the highest enhancement effect when the concentration multiple of silver nanoparticle was 15× and the concentration of sodium chloride solution was 1 mol·L-1, and the optimal condition was detected at the of 5~250 mg·L-1 histamine aqueous solution, of which the lowest concentration was detected at 5 mg·L-1. At the same time, the SERS spectra of histamine in fish extracts ranging from 10 to 100 mg·L-1 were detected under the optimized conditions. It was revealed that 3 calibration curves established at the characteristic peaks at 1 180, 1 258, 1 425 cm-1 corresponding Raman peak intensities had a good linear relationship when the concentration of histamine in fish extracts ranged from 10 to 100 mg·L-1 with R2= 0.918 1~0.947 3, of which the R2 value of the prominent peak at 1 258 cm-1 was the largest. The lowest concentration detected in fish was 10 mg·L-1, much lower than maximum limit of detection of histamine in the national standard. The calibration curve had superior accuracy with the recovery between 100%~111%. And the applicability of the method was verified by high performance liquid chromatography (HPLC). The experimental results showed that surface-enhanced Raman spectroscopy using silver nanoparticles as an active substrate and sodium chloride solution as an aggregator coupled with linear regression to establish a standard curve for rapid detection of histamine in fish is feasible and accurate, which provides a reference basis for rapid quantitative analysis of histamine content in fish products.
组胺(Histamine) 是生物胺(biogenic amine, BA)的一种, 也是对人类健康影响最大的一种多胺类物质, 它与人类健康关系密切, 摄入组胺含量过多会造成不适或中毒[1]。 组胺在水产品鱼制品中最主要的生物合成途径是贮藏和加工过程中的污染微生物及酶对组氨基酸的脱羧反应[2]。 鲭鱼、 鲐鱼和沙丁鱼等海水鱼制品富含血红蛋白和组氨酸, 在加工和贮藏过程中最易引起组胺积累[2]。 因此在出口贸易中, 澳大利亚和欧盟对水产品中的组胺含量提出了严格要求, 并规定水产品及其制品中组胺限量标准不得高于100 mg· kg-1, 美国FDA规定进出口水产品中组胺含量不得高于50 mg· kg-1 [3]。
目前国内外食品中组胺测定的方法[4]主要有HPLC法、 薄层色谱法、 毛细管电泳、 离子色谱法、 生物学法等。 其中HPLC是最常用的检测方法, Muscarella等[5]结合ELISA和HPLC对收集的鲜鱼和鱼制品样本进行了组胺含量测试。 实验结果得出58%的总样品中检测到组胺浓度> 2.5 mg· kg-1; 在216份鲜鱼样本中, 70%的组胺含量低于10 mg· kg-1, 而有6%的含量显示组胺水平高于100 mg· kg-1。 但是这些方法均存在衍生操作繁琐、 检测时间较长、 样品用量多等不足。 因此研究快速、 高效地检测组胺的方法开发具有重要的现场意义。
表面增强拉曼光谱(surface enhanced Raman spectroscopy, SERS)具有灵敏度高、 水干扰小、 快速检测等优点, 且在食品痕量快速检测中有着广泛的应用[6]。 李春颖等人运用 SERS 技术, 结合化学计量学法对水产品中的禁用药物进行检测, 最低能检测到鱼肉中孔雀石绿和结晶紫的含量分别为1.0和20 μ g· kg-1, 显示出SERS技术对食品中痕量药物残留检测的巨大潜力[7]。 SERS技术通过采用经特殊处理的表面粗糙金属(如金、 银等)作为活性基底, 将被测分子或官能团吸附到金属表面, 使得被测分子或者其官能团的拉曼散射信号提高了105~106倍[8]。 且在SERS光谱中, 在一定浓度范围内, 某一目标组分的浓度与其特征拉曼位移峰强度呈线性关系[8]。 Xie等利用薄层色谱结合SERS方法实现了鱼肉中组胺的筛选分析[9], 但该方法主要是以筛选为导向的, 且薄层色谱板上的衍生化导致过量荧光胺的重叠会对SERS检测的结果产生一定的影响。
本研究的目的是运用表面增强拉曼光谱技术, 以银纳米颗粒作为SERS活性基底, 建立银纳米颗粒的浓缩倍数和氯化钠溶液浓度的优化方案增强被检测物的拉曼信号强度, 结合线性回归算法用于组胺含量的检测, 旨在为水产鱼制品中快速测定组胺的含量提供技术理论支持。
未经冻藏的新鲜鲐鱼, 每条质量(300± 20) g, 购自宁波路林水产交易中心, 冰藏并快速运至实验室, 清洗后去除头尾、 内脏, 取背部鱼肉作为实验样品。
组胺二盐酸盐(≥ 99 %, Histamine dihydrochloride, C5H9N3· 2HCl)、 氢氧化钠(96%, Sodium hydroxide, NaOH)购于上海阿拉丁生化科技股份有限公司; 硝酸银(≥ 99%, Silver nitrate, AgNO3)、 盐酸羟胺(99.995%, Hydroxylamine hydrochloride, ClH4NO)、 4-巯基苯甲酸(4-Mercaptobenzoic acid, 99%, 4-MBA)购于Sigma-Aldrich公司; 氯化钠(Sodium chloride, NaCl)、 三氯乙酸(Trichloroacetic acid, Cl3CCOOH)、 正戊醇(1-Pentanol, C5H12O)、 盐酸(hydrochloric acid, HCl)购于国药集团化学试剂有限公司; 所有化学品均为分析纯, 无需进一步纯化即可使用, 所有实验中都使用电阻率为18 MΩ · cm-1的高纯度水。
上海HORIBA Scientific公司生产的XploRA ONE高灵敏度拉曼光谱仪用于拉曼光谱采集; 南京菲勒仪器有限公司的紫外-可见分光光度计与日立H-7650透射电子显微镜均用于SERS基底的表征; 美国Thermo公司生产的高速冷冻离心机用于基底的浓缩。
银纳米颗粒(silver nanoparticles, Ag NPs)的制备方法略加改进[10]。 方法如下: 先将17 mg(0.1 mmol· L-1)的硝酸银溶解在10 mL的去离子水中配制成10 mmol· L-1的硝酸银溶液。 将11.6 mg(0.17 mmol· L-1)的盐酸羟胺与3.3 mL(0.1 mol· L-1)的氢氧化钠溶液加入到100 mL容量瓶中并用去离子水定容, 混合均匀。 取45 mL上述盐酸羟胺混合液加入到100 mL离心管, 作为Ag NPs制备的还原剂。 取5 mL的硝酸银溶液迅速加入到还原剂中, 充分混合, 即合成黄绿色的银纳米颗粒, 用0.22 μ m Millipore膜过滤后将其密封避光置于4 ℃的冰箱保存以备用。 通过TEM和UV-Vis光谱表征胶体悬浮液的粒度分布。
(1)优化Ag NPs的浓缩倍数: 将5 mL Ag NPs分别浓缩不同的倍数2× , 4× , 10× , 15× 和20× 。 以Ag NPs浓缩液: 100 mg· L-1组胺水溶液: 1 mol· L-1 NaCl溶液=9: 1: 3的比例进行配制, 均匀混合2 min, 即得到待测样本。
(2)优化NaCl溶液的浓度: 取5 mL Ag NPs浓缩10倍, 即得到0.5 mL的Ag NPs。 配制不同浓度(0.01~3 mol· L-1)的NaCl溶液, 以相同的比例均匀混合2 min, 即得到待测样本。
(3)组胺水溶液的测定: 准确称取0.01 g组胺标准品, 溶于0.1 mol· L-1盐酸溶液中, 配制成浓度为1 000 mg· L-1的组胺标准储备溶液。 稀释配制不同浓度(5~250 mg· L-1)的组胺标准溶液。 以相同的比例均匀混合2 min, 即得到待测样品。
鱼类样品组胺的提取和净化是基于Evangelista[11]的方法进行综合优化得出。 利用三氯乙酸提取组胺。 方法如下: 准确称取绞碎的试样10. 00 g于20 mL 10%三氯乙酸水溶液浸泡2~3 h, 震荡2 min, 混匀过滤。 吸取2 mL滤液于分液漏斗中, 250 g· L-1 氢氧化钠溶液调节pH至10~12, 加入3 mL正戊醇振荡提取5 min, 静置分层, 将上层提取液转移至10 mL容量瓶中, 提取三次, 合并提取液, 用正戊醇稀释至刻度。 吸取2 mL正戊醇提取液, 加入3 mL 1 mol· L-1盐酸溶液振荡提取, 静置分层, 将盐酸提取液(下层)转移至10 mL容量瓶中, 提取三次, 并用盐酸溶液稀释至刻度。 即得鱼肉样品组胺提取液。
加标处理: 取2 mL提取液于离心管中, 加入不同体积的组胺标准储备液, 获取不同质量浓度(10~100 mg· L-1)的待测样本。
为了验证该方法的适用性, 将储存于-80 ℃的冰冻鲐鱼放置于25 ℃下12 h后进行取样检测, 并选取高效液相色谱法同时对样品进行分析检验。 将样品置于研钵中研磨均匀, 称取10.00 g研磨的样品, 置于50 mL离心管中, 以庚胺为内标试剂, 苯甲酰氯为样品衍生试剂, 参照黄文娟[12]等用于检测生物胺的高效液相色谱法进行分析。
每次试验前拉曼光谱仪使用硅片(Si)用520 cm-1 峰作为基准峰进行仪器校正。 表面增强拉曼光谱采集如无特殊说明, 激光波长785 nm, 激光强度设置为50%, 功率120 mW, 50× 目镜, 曝光时间60 s, 检测的光谱范围均为200~3 500 cm-1, 分辨率为1 cm-1。 样品检测过程中参数设置保持一致, 每个样品至少重复3次, 以得到准确的拉曼光谱结果。
光谱图使用LabSpec 6软件处理; 数据绘图使用Origin 9.0软件。
通过紫外-可见分光光度计和透射电子显微镜来对合成的Ag NPs进行表征。 如图1所示, Ag NPs有最大吸光度, 且主要在400 nm左右, 颗粒的形状主要为球形, 均匀尺寸为30 nm左右。 这与Mikac等[13]研究通过还原硝酸银所制备的具有10~40 nm大小和球形的银纳米颗粒的结果一致, 并且所获得的Ag NPs的吸光度均在400 nm左右。 因此将本实验所得到的Ag NPs用于进一步研究。
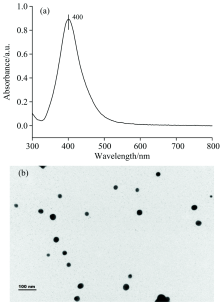 | 图1 (a)Ag NPs的紫外可见吸收光谱; (b)TEM图像Fig.1 Ultraviolet and visible absorption spectrum (a) and TEM Images (b) of silver nanoparticles |
为检验获得的Ag NPs的稳定性和灵敏度, 使用4-MBA作为探针分子对其进行拉曼测试, 将1, 0.1和0.01 mol· L-1的3种不同浓度的4-MBA溶液与Ag NPs以1: 9的比例混合得到SERS光谱, 如图2(a)看出所得拉曼峰具有良好的重复性, 且拉曼强度很高。 因此该实验方法不仅用时少、 易操作, 且合成的Ag NPs可作为可靠的增强基底应用于SERS试验中。
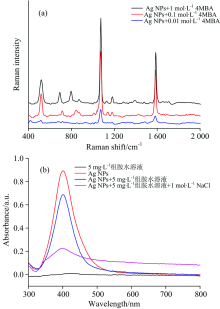 | 图2 (a)基于Ag NPs的4-MBA的SERS光谱图; (b)组胺分子(5 mg· L-1)对Ag NPs的影响Fig.2 (a)The SERS spectra of 4-MBA based on silver nanoparticles ; (b)Effect of Histamine (5 mg· L-1) on silver nanoparticles |
在使用NaCl作为团聚剂进行SERS试验之前, 分别配制了5 mg· L-1组胺水溶液、 Ag NPs、 Ag NPs+5 mg· L-1组胺水溶液(体积比为9: 1), Ag NPs+5 mg· L-1组胺水溶液+1 mol· L-1 NaCl溶液(体积比为9: 1: 3)四种溶液, 然后利用紫外-可见分光光度计分别对其进行吸光度的检测并比较说明通过添加NaCl的形式来达到SERS检测的目的。 图2(b)表明组胺标准溶液在300~800 nm的紫外可见光波长范围内没有任何吸收峰; 虽然组胺水溶液与Ag NPs结合后会使得Ag NPs的吸收峰略有下降, 但在以上溶液中继续添加NaCl后, 使得Ag NPs的最大吸收峰的下降趋势增大, 吸光度发生改变, 说明NaCl溶液使Ag NPs在溶液中发生团聚, 形成热点, 实现SERS信号增强, 进而达到对组胺检测的目的。
组胺化学名为4(5)-(2-氨乙基)咪唑, 分子式为C5H9N3, 相对分子质量111。 图3为固体组胺标品的常规拉曼光谱, 该图较为全面的揭示了组胺的分子振动特性。 953和986 cm-1介于1 100与900 cm-1之间, 因此主要与咪唑环面内弯曲和侧链骨架振动[14]; 1 167 cm-1主要是由N— H面内弯曲引起的; 1 236 cm-1主要是咪唑中C— H面内弯曲和环呼吸引起的; 1 291 cm-1主要与环伸展有关; 1 474 cm-1主要是由咪唑N— H面内弯曲振动和环伸展引起的[15]。
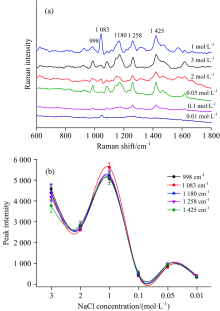
图4反映了不同浓缩倍数的Ag NPs对组胺水溶液的SERS光谱的影响。 从图4(a)中看出998, 1 083, 1 180, 1 258和1 425 cm-1的特征峰都有对应的强度值。 图4(b)中得出在浓缩倍数为2~15倍之间时, SERS光谱的特征拉曼位移峰强度与浓缩倍数成正比, 但是当浓缩倍数为20倍时, 对应的峰强度有且下降的趋势。 浓缩倍数的过高与过低均会影响样品的SERS信号, 倍数过低时, Ag NPs与样品结合不充分; 浓缩倍数过大时, Ag NPs会发生团聚, 从而与分析物的结合能力减弱, 使得SERS信号变弱。 得出浓缩倍数为15倍时得到的SERS光谱的特征拉曼位移峰强度最大。 因此在组胺检测限的实验中将Ag NPs的浓缩倍数设置为15倍。
图5反映了不同浓度的NaCl溶液对组胺水溶液的SERS光谱的影响。 在NaCl分子存在下, 组胺及其衍生物的分子可能与Ag NPs有很强的相互作用, 从图3与图5(a)比较看出它们的SERS指纹与组胺晶体的正常拉曼光谱显着不同。 加入NaCl溶液后, 组胺分子中的咪唑环上的氮原子与Ag NPs表面形成强的连接[9]。 NaCl溶液浓度过高或过低均会影响样品的SERS检测, 如图5b所示, 当NaCl浓度水平过高(> 1 mol· L-1)时, 过量的离子在Ag NPs周围形成多层, 阻碍了分析物的接近, 从而导致SERS信号的衰减[16]。 从图5(b)中看出在NaCl浓度为1 mol· L-1时, 所对应的各个特征峰的峰强度均是最高的, 因此在组胺检测限的实验中将NaCl浓度设置为1 mol· L-1。
由于组胺与Ag NPs发生偶联[17], 因此在SERS光谱中的1 180, 1 258和1 425 cm-1处的主要特征峰均发生了明显的带位移[图6(a)]。 与固体组胺拉曼光谱(图3)中1 167, 1 236和1 474 cm-1处的特征峰对比, SERS光谱中1 180, 1 258和1 425 cm-1处的特征峰分别偏移了13, 22和49 cm-1。 与固体的组胺拉曼光谱相比, 特征峰的相对强度的变化取决于许多因素, 如目标化学分子与基底表面的相互作用, 基底的吸附位置, 附着在基底上的分子取向等[18]。
图6(a)和(b)分别表示组胺水溶液和鱼肉提取液中组胺的SERS光谱。 结果显示, 组胺水溶液与鱼肉提取液均在998, 1 083, 1 180, 1 258和1 425 cm-1处均有相对应的峰强度。 但是在组胺水准溶液中可以检测到组胺的最低浓度是5 mg· L-1, 而在鱼肉提取液中检测到的组胺最低浓度是10 mg· L-1, 这是由于提取液中非目标组分(如小分子蛋白质)会对SERS样品检测存在一定的干扰, 导致鱼肉提取液的分析结果不太满意。 图6(b)显示在1 180, 1 258和1 425 cm-1附近的特征峰的强度随着提取液中的组胺浓度的增加而增加。 特征峰与组胺浓度之间存在良好的线性关系(R2=0.918 1~0.947 3), 它们之间的相关关系如表1所示, 这使得用SERS技术测定组胺的含量成为可能。 由表1可知, 组胺浓度与1 258 cm-1处特征拉曼位移峰强度的相关系数最大。 因此采用线性回归方法, 在组胺浓度(10~200 mg· L-1)与SERS光谱1 258 cm-1处的特征拉曼位移峰强度之间建立了线性回归模型Y=15.439x+287.86(R2=0.947 3), 其中Y为1 258 cm-1处的特征拉曼位移峰强度, X为鱼肉提取液中的组胺浓度。 因此, 本研究选用1 258 cm-1处的拉曼特征峰强度值对鱼肉提取液中组胺的残留量进行定量分析。
| 表1 鱼肉提取液中组胺含量(10~200 mg· L-1)与表面增强拉曼散射中突出特征峰的强度呈线性关系 Table 1 Linear relationship between the different concentrations of histamine in fish extracts (10~200 mg· L-1) and the intensities of prominent characteristic peaks in the surface-enhanced Raman scattering spectra |
应用鲐鱼鱼肉提取液中的组胺浓度分别为10, 25, 50 mg· L-1的加标样本对所得的标定曲线进行验证, 结果如表2所示。 所以必需对样品进行一定程度的提取、 净化处理。 鱼肉提取液中的组胺测得值与在1 258 cm-1处对应的拉曼特征峰强度具有良好的准确性, 其预测值分别为(10.09± 1.45), (27.64± 4.95)和(51.04± 10.88) mg· L-1, 且回收率在100%~111%之间。 因此该结果表示SERS方法适用于检测目的。
| 表2 应用拉曼峰强度所得到的回收率和预测值实验 Table 2 Recoveries and predictive values using Raman peak intensities |
通过测定实际鱼样品中的组胺浓度进一步验证了所提出的方法的适用性。 作为参考, 选取用于检测组胺的高效液相色谱法进行分析。 如表3所示, 采用本文中的SERS的结果与高效液相色谱法的结果一致, 表明了该方法的适用性。 与参考HPLC方法相比, 所开发的方法显著降低了化学品和设备的成本并减少了分析所需的时间。
| 表3 比较两种方法的检测结果 Table 3 Comparison of quantitative results by two methods |
采用表面增强拉曼光谱技术结合线性回归算法, 实现了对鱼肉提取液中组胺含量的测定。 优化条件为浓缩15倍的银纳米颗粒和1 mol· L-1 氯化钠溶液时, 得到的组胺SERS信号表现出最强的增强效应。 在该优化条件下分别采集5~250 mg· L-1的组胺水溶液和10~100 mg· L-1的鱼肉提取液中组胺的SERS光谱。 结合线性回归方法, 建立了1 180, 1 258和1 425 cm -1处的特征拉曼位移峰强度与鱼肉提取液中的组胺浓度之间的线性回归模型(R2=0.918 1~0.947 3)。 通过比较得出在1 258 cm-1处特征拉曼位移峰强度的R2值最大, 且鱼肉中组胺的最低检测浓度为10 mg· L-1, 远低于国标中水产品中组胺最大限量检测限50 mg· L-1。 通过鱼肉提取液中的组胺残留量对标准曲线进行验证, 得到回收率在100%~111%之间。 与HPLC比较, 所开发的方法显著降低了化学品和设备的成本并减少了分析所需的时间。 研究结果表明SERS结合线性回归法可用于鱼肉中组胺的快速检测, 这为在水产品中的组胺含量的快速定量分析提供了参考依据, 显示出SERS在水产鱼制品中有害物质的检测具有广泛应用潜力。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|