作者简介: 朱俊, 1972年生, 内江师范学院化学化工学院副教授 e-mail: zhjun630@163.com
通过构建碳点(CDs, 供体)和曙红B(EB, 受体)间的荧光共振能量转移(FRET)体系, 建立了一种灵敏且具有选择性的检测培氟沙星(PEFL)含量的新方法。 以紫叶草为碳源, 采用热解法制备了荧光碳点(CDs), 其在水中分散性较好、 稳定性较高、 量子产率为3.7%。 利用高分辨电子显微镜(HRTEM)、 X射线电子衍射仪(XRD)和傅里叶变换红外光谱仪(FTIR)等手段对碳点进行了形貌和结构表征, 结果表明, 所制得的碳点为无定形态, 其表面含有羟基(—OH)和羧基(—COOH)等活性基团。 利用能量转移Förster理论, 确定CDs和EB之间发生了荧光共振能量转移, 从而在CDs和EB之间构建了荧光共振能量转移体系。 并考察了影响荧光共振能量转移效应测定培氟沙星的重要因素, 如反应介质和酸度、 反应时间、 供体和受体的浓度和盐效应等。 结果表明, 在pH 3.0的磷酸盐(PBS)缓冲溶液中, 以340 nm为激发波长, 碳点将能量转移给曙红B, 使得曙红B的荧光信号增强。 加入培氟沙星之后, 由于培氟沙星与碳点之间相互作用, 从而使得碳点的荧光显著增强。 并且在优化的实验条件下, 培氟沙星的浓度在0.01686.71 μg·mL-1范围内与体系的荧光强度改变值(Δ F)之间有较好的线性关系, 检出限为0.072 5 ng·mL-1(3 s/k, n=11)。 一些常见的阳离子(如Fe3+, Al3+, Ca2+, Zn2+, Cr3+, Co2+, Cu2+, Mn2+等)、 阴离子(如Cl-, N
A fluorescence resonance energy transfer (FRET) system between fluorescence carbon dots (CDs, donor) and Eosin B (EB, acceptor) was constructed, and a new method for sensitive and selective determination of pefloxacin (PEFL) was proposed. Fluorescent carbon dots (CDs) were synthesized by pyrolysis treatment using Setcreasea purpurea boom as carbon source. The carbon dots exhibited preferable dispersibility in water, high stability and a quantum yield of 3.7%. The as-prepared CDs were characterized using high-resolution transmission electron microscopy (HRTEM), powder X-ray diffraction patterns (XRD), and Fourier transform infrared spectroscopy (FTIR). Theresults showed that the CDs demonstrated an amorphous structure with the presence of —OH and —COOH groups on their surface. Using Förster’s theory of resonance energy transfer, the FRET between CDs and EB was determined, and the FRET system was constructed between CDs and EB. Some important factors were optimized, such as reaction medium and acidity, reaction time, the concentration of donor and acceptor, salt effect. According to the result, in PBS buffer solution at pH=3.0, the energy transfer from CDs to EB occurred with λex=340 nm, which resulted in an enhancement of the fluorescence intensity of EB. Upon the addition of pefloxacin, the fluorescence intensity of CDs was significantly increased because of the interaction between pefloxacin and CDs. Under the optimized experimental conditions, the change of CDs fluorescence intensity (Δ F) with the PEFL concentration exhibited a linear relationship in range of 0.016 86.71 μg·mL-1. The detection limit was 0.072 5 ng·mL-1 based on the formula 3 s/k ( n=11). Most of common substances such as cations (Fe3+, Al3+, Ca2+, Zn2+, Cr3+, Co2+, Cu2+, Mn2+, etc. ), anions Cl-, N
培氟沙星(Pefleoxacin, PEFL)是新的甲-4-哌嗪喹诺酮类衍生物, 是第三代氟喹诺酮类抗菌药。 其具备广谱抗菌性, 对革兰氏阴性菌的体内抗菌活性与新氨基糖甙类及第三代头孢菌素相似, 在一定程度上对某些革兰氏阳性菌也有抗菌作用[1]。 PEFL因其具备生物利用度高, 在体内易吸收等优点[2]而被广泛应用于临床和食用动物中。 近年来对第三代氟喹诺酮类抗菌药产生的耐药性, 残留毒性以及不良反应的研究报道越来越多[3, 4, 5]。 目前, 测定PEFL的方法主要有化学发光法[6]、 色谱法[7, 8]、 荧光法[2]等。
荧光共振能量转移(fluorescence resonance energy transfer, FRET)作为一种分析检测技术由于其灵敏度和精度较高等特点, 被广泛用于金属、 生物和医学[9, 10, 11, 12]等方面的检测分析。 FRET是指化合物分子受光激发后, 分子内部发生了能量供体与能量受体之间的一种能量转移.能量供体的发射光谱与能量受体的吸收光谱要有一定程度的重叠, 能量供体必是一个荧光团, 但能量受体可以是荧光团, 也可以是发色团[13]。 而要发生FRET必须满足3个条件: (1) 供体能发射荧光; (2) 供体的发射光谱与受体的吸收光谱有一定程度的重叠; (3) 供受体足够接近, 作用距离一般在28 nm[14]。
碳点(carbon dots, CDs)作为一种新型荧光发光材料, 由于其具备许多优点如双光子吸收截面大、 光稳定性好、 发光范围可调、 无毒和生物相容性好、 易于功能化等[15, 16], 故成为了传统半导体量子点的理想代替者, 且扩大了CDs在生物成像、 标记、 分析检测、 光电转换和催化等领域的应用[17, 18, 19]。 近年来, CDs的制备采用的碳源有柠檬酸[20]、 葡萄糖[21]、 金针菇[22]、 紫叶草[23]等。 曙红B(Eosin B, EB)是一种硝基苯衍生物的阳离子染料, 在水中稳定性高[24], 溶液呈绿色荧光。 其作为光谱探针主要用于金属离子[25, 26]、 药物[27]等的分析测定。 近年来, 将CDs和EB用于构建FRET体系中的研究较少, 而利用CDs和EB构建FRET体系来测定药物中PEFL含量的方法尚未见报道。
本文以紫叶草为碳源利用热解法制得CDs, 基于CDs的荧光光谱和EB的吸收光谱有一定的重叠, CDs为供体, EB为受体, 构建了FRET体系。 当加入了PEFL后, CDs的荧光强度增强, 而对EB的荧光强度影响不大, 且在优化条件下, 随着PEFL浓度的增加呈现良好的线性关系。 据此建立了一种测定药物中PEFL含量的新方法。
F-4600荧光分光光度计(日本日立); JEM-2010高分辨透射电子显微镜(日本); U-3010型紫外可见分光光度计(日本日立); DX-2700型X射线衍射仪(辽宁); WQF-510A傅里叶变换红外光谱仪(北京); 2.5-10型箱式电阻炉(上海)。
紫叶草(使用前, 先用超纯水洗净, 在35 ℃烘箱中烘干, 备用); 10-3 mol· L-1 EB(使用时稀释至所需浓度); 培氟沙星(PEFL): 准确称取0.019 5 g PEFL, 用1.0 mL的1.0 mol· L-1的HCl溶液溶解, 定容至100 mL容量瓶中作储备液; PBS缓冲液: 配制0.10 mol· L-1的磷酸氢二钠和磷酸二氢钠溶液, 用pH计调至所需pH值。 除培氟沙星为标准品外, 实验所用试剂均为分析纯, 实验用水均为超纯(UP)水。
1.2.1 碳点的制备
将烘干后的紫叶草破碎, 于箱式电阻炉中300 ℃灼烧2 h, 冷却至室温, 研成粉末。 准确称取0.100 0 g上述粉末, 用12.0 mL超纯水溶解于烧杯中, 超声分散1 h, 用0.22 μ m的滤膜抽滤, 滤液透析10 h得碳点溶液。 保存于4 ℃冰箱中备用。
1.2.2 PEFL的检测
在10 mL比色管中加入一定量的CDs, EB, PEFL和pH 3.0的PBS缓冲液, 超纯水稀释至刻度, 摇匀, 并在室温下反应10 min。 以340 nm为激发波长, 测定436 nm处的荧光强度F值。 仪器的激发和发射狭缝宽度均为5 nm。
2.1.1 透射电镜(TEM)分析
图1(a)为CDs的TEM图。 在图中可以观察到CDs的形貌是球形的, 高分辨TEM图中CDs没有明显的晶格条纹[图1(a)中内插图], 说明所制备的CDs为无定形态。 CDs的尺寸分布如图1(b)所示, 平均粒径为2.4 nm。
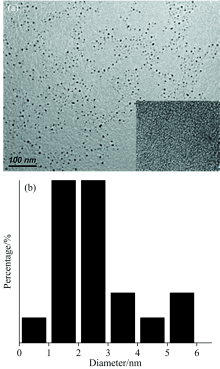 | 图1 CDs的TEM图像(a)和相应粒径的直方分布图(b)Fig.1 The TEM image of CDs (a) and the corresponding particle size distribution histogram (b) |
2.1.2 X射线衍射分析
图2(a)为CDs的X射线衍射谱图(XRD)。 在图中接近ca.21° (2θ )左右, 有一个宽的且强度低的单峰, 进一步表明所制得的CDs为无定型态, 这和TEM的结果相符合。
2.1.3 红外光谱分析
图2(b)为CDs的红外光谱图。 在3 490 cm-1左右有一个宽的吸收峰, 为— OH/— NH的伸缩振动特征峰。 在1 600 cm-1左右的吸收峰为— C═O的伸缩振动峰, 该结果表明, 所制得的CDs表面含有— OH和— COOH/— NH基团, 说明CDs在水中具有良好的分散性能。
2.1.4 量子产率
采用参比法来测定CDs的荧光量子产率, 选用硫酸奎宁作为标准物, 其量子产率为0.54, 分别测定了CDs和硫酸奎宁的荧光光谱和吸光度。 CDs的量子产率的计算公式如下
式中, YCDs, YR分别是CDs和硫酸奎宁的荧光量子产率, I是荧光光谱积分面积, A是吸光度, n是溶剂的折射率, R表示的是硫酸奎宁的标准值[28, 29]。 相关数值代入上述公式计算得YCDs为3.7%。
2.1.5 相关参数
对CDs的荧光光谱和EB的吸收光谱进行了分析, 并计算了相关参数。 根据能量转移Fö rster理论, 相关参数的计算公式如下[30, 31]
式中, J指供体的荧光光谱和受体的吸收光谱之间的光谱重叠积分, F(λ )是荧光供体在λ 处的荧光强度, ε (λ )为受体在λ 处的摩尔吸收系数。 F为加入能量受体后供体的荧光强度, F0为没有加入受体时供体的荧光强度, k2为偶极空间取向因子, 能量供体和受体在空间分布可认为是随机且均等的, 故k2取2/3, N为水和有机溶剂的平均折射率, E是能量转移效率, R0为Fö rster半径, 是指能量转移效率为50%时供体和受体之间的距离, r是能量供体和受体之间的能量转移距离。 相关数值代入上述公式通过计算得J为1.22× 10-12 cm3· L· mol-1, E=0.15, R0=3.48 nm, r=4.63 nm, 结果表明, R0和r在28 nm之间, 故说明CDs能和EB发生荧光共振能量转移(FRET)。
如图3所示, CDs具有荧光, 在420 nm处产生1个较强的荧光峰。 EB的最佳吸收峰位于516 nm, 其与CDs的荧光峰之间相差96 nm。 CDs的荧光光谱(图3, 曲线b)与EB的吸收光谱(图3, 曲线c)有较好的重叠, 并且CDs的吸收峰和EB的发射峰能明显的分开。
 | 图3 a: CDs的吸收光谱; b: CDs的发射光谱; c: EB的吸收光谱; d: EB的发射光谱Fig.3 a: Absorption of CDs; b: emission of CDs; c: absorption of EB; d: emission of EB (CDs: 17.0 μ g· mL-1; EB: 2× 10-6mol· L-1) |
为了得到较好的转移效果, 以340 nm处的光激发CDs-EB混合体系, 构建了CDs-EB的FRET体系。 如图4所示, 当固定CDs的浓度, 改变EB的浓度时, 发现随着EB浓度的增加, 供体CDs将能量转移给了受体EB, 导致CDs的荧光强度下降, EB的荧光强度增加。 因此, 在FRET体系中, CDs作为供体, 而EB作为受体。 当固定EB的浓度, 改变CDs的浓度时, 随着CDs浓度的增加, CDs和EB的荧光强度都增加(图5)。 由此表明CDs和EB间发生了有效的FRET。 图6进一步说明CDs与EB之间的确发生了有效的FRET。
 | 图4 EB浓度对FRET体系的影响Fig.4 Effect of the concentration of EB on FRET system (CDs: 17.0 μ g· mL-1; EB(a— d): 0, 2× 10-7, 3× 10-7, 5× 10-7, 2× 10-6 mol· L-1) |
 | 图5 CDs浓度对FRET体系的影响Fig.5 Effect of the concentration of CDs on FRET system(CDs (a— d): 0, 1.7, 5.1, 8.5, 17.0 μ g· mL-1; EB: 2× 10-6mol· L-1) |
在图7中, 加入PEFL后能明显的增强CDs的荧光, 而对EB的荧光强度影响不大。 且随着PEFL浓度的增大, Δ F在一定范围内与PEFL的浓度呈良好的线性关系, 故建立了一种检测PEFL含量的新方法。
2.4.1 反应介质及酸度的影响
探究了PBS(磷酸盐), Tris-HCl, NaAc-HAc, NaAc-HCl, B-R(Britton-Robinson)5种缓冲液对CDs-EB的FRET体系的影响。 结果表明, 以PBS缓冲液为反应介质, 体系的线性关系和灵敏度较好, 故选择PBS缓冲溶液为最佳缓冲介质。 在图8中, 当pH 3.0时体系的荧光变化值Δ F最大, 在pH 3.0之后Δ F值开始下降, 在pH 6.0和10.0略有上升, 但都没有pH 3.0变化大, 故确定体系的最佳pH值为3.0。 在图9(a)中, 当用量为1.0 mL时, Δ F值最大, 之后又依次减小, 故1.0 mL为该PBS缓冲液的最佳用量。
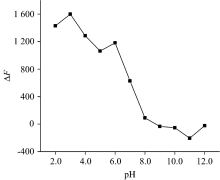 | 图8 pH值对CDs-EB-PEFL体系的影响Fig.8 Effect of pH on the CDs-EB-PEFL system (CDs: 17.0 μ g· mL-1; EB: 2× 10-6mol· L-1; PEFL: 3.35 μ g· mL-1; PBS pH 3.0 1.0 mL) |
 | 图9 PBS用量的影响(a)和时间扫描(b)Fig.9 Effect of PBS dosage (a) and the time scanning (b) (CDs: 17.0 μ g· mL-1; EB: 2× 10-6 mol· L-1; PEFL: 3.35 μ g· mL-1; PBS pH 3.0 1.0 mL) |
2.4.2 稳定性
在优化的实验条件下, 探究反应时间对CDs-EB的FRET体系测定PEFL含量的影响。 由时间扫描结果可知[图9(b)], 该体系受反应时间影响不大。 为使反应充分, 可定容后放置10 min, 这个时间段体系较稳定, 且放置1 h后体系基本稳定不变, 故说明该体系稳定性较好。
为了证明CDs-EB-PEFL这个体系的选择性, 探究了不同干扰物质对测定3.35 μ g· mL-1 PEFL的影响, 如图10所示。 常见的阳离子如Fe3+, Al3+, Ca2+, Zn2+等13种阳离子对体系不造成影响, 阴离子如Cl-, N
为了进一步探究FRET体系的稳定性, 考察了盐浓度的影响, 结果如图11所示。 在0.02.0 mol· L-1范围内, 随着NaCl的浓度的增加, CDs的荧光值基本不变, 说明在较高的离子强度下荧光强度变化不大, 该体系较稳定。
在构建好的CDs-EB的FRET体系中, 在最优的条件下, 以荧光强度改变值Δ F为纵坐标, 以PEFL的浓度为横坐标, 绘制工作曲线(图12)。 体系的荧光改变值Δ F与PEFL的浓度ρ 在0.016 86.71 μ g· mL-1范围内有良好的线性关系, 线性方程为Δ F=693.54ρ +23.64, 相关系数r为0.998 5, 检出限为0.072 5 ng· mL-1(3s/k, s为11次平行测定的标准偏差, k为线性方程的斜率)。
为了探究CDs-EB的FRET体系测定培氟沙星的可行性和实用性, 考察了该方法测定甲磺酸培氟沙星胶囊(浙江迪尔药业有限公司, 0.2 g· 粒-1按培氟沙星计)和片剂(内蒙古通辽制药股份有限公司, 0.1 g· 片-1按C17H20FN3O3计)中的培氟沙星含量。 按照参考文献[32]进行样品预处理: 将甲磺酸培氟沙星胶囊、 片剂研细, 分别准确称取0.100 0 g, 用30 mL 0.10 mol· L-1的HCl溶解定容至100 mL, 摇匀过滤。 分别准确移取适量滤液, 按2.2.2的实验方法进行测定, 并同时进行加标回收实验。 结果如表1所示, 甲磺酸培氟沙星胶囊、 片剂的回收率分别为100.4%和105.1%, 相对标准偏差分别为0.86%和2.5%。 由此表明了CDs-EB荧光共振能量转移体系测定培氟沙星的方法可行。
| 表1 样品的分析结果 Table 1 Analytical results of samples (n=5) |
以CDs为供体、 EB为受体, 构建了CDs-EB的FRET体系, 并用于药物中PEFL含量的检测。 在最佳实验条件下, 该方法对PEFL的检测范围是0.001 686.71 μ g· mL-1, 相关系数r为0.998 5, 检出限达0.072 5 ng· mL-1 (3σ /k, n=11) 。 该方法分别用于检测甲磺酸培氟沙星胶囊与片剂中培氟沙星的含量, 回收率分别为100.4%和105.1%, 相对标准偏差(RSD, n=5)分别为0.86%和2.5%。 综上可知该方法操作简单, 选择性好, 灵敏度高, 线性范围较宽, 故可建立一个检测药物中PEFL含量的新方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|








