作者简介: 韩忠保, 1994年生, 沈阳师范大学化学化工学院硕士研究生 e-mail: 781720336@qq.com
五环三萜化合物齐墩果酸(OA)与熊果酸(UA)为同分异构体, 具有相似的理化性质和稍有差异的药理活性。 目前人们主要采用各种色谱、 质谱类方法实现对OA与UA的异构体识别, 未见使用荧光光谱法的报道。 提出了一种使用荧光猝灭法实现对OA与UA异构体识别的方法。 首先考察了两种常见的血清蛋白—牛血清白蛋白(BSA)与人血清白蛋白(HSA)同OA与UA的作用情况, 结果表明OA与UA均可有效地猝灭BSA与HSA的荧光发射。 对所得荧光猝灭数据计算可知OA, UA与BSA, HSA作用的双分子猝灭速率常数( Kq)均远大于生物大分子荧光猝灭所观察到的最大散射碰撞速率常数2.0×1010 L·(mol·s)-1, 说明猝灭类型均为静态猝灭, 即OA与UA均是通过与BSA及HSA形成稳定复合物方式实现荧光猝灭的。 应用双对数方程对所得荧光猝灭数据计算可知OA, UA与BSA, HSA所形成的复合物中结合位点数在0.90~1.26之间, 说明所形成的复合物为1:1型。 BSA与OA, UA所形成复合物的表观结合常数( KA)为同一数量级, 相差不大, 但是HSA与OA, UA所形成复合物的 KA差别很大, HSA-UA复合物的KA比HSA-OA复合物高124.91倍, 表明HSA-UA复合物的稳定性更强。 同步荧光实验结果显示, OA与UA的加入对于HSA波长差(Δ λ)为60 nm同步荧光光谱的影响大于Δ λ为15 nm的同步荧光光谱, 由此可以说明OA与UA在HSA上的结合位点可能位于Trp残基附近。 分子对接模拟计算结果表明OA与UA均对接在HSA结构中一个疏水性空腔中, 主客体之间存在强烈的氢键与疏水作用。 OA同Arg218, His242, Pro447等残基间存在氢键作用, 键长分别为2.95, 2.97与3.17 Å, 此外还与Lys195, Lys199, Trp214, Arg222, Leu238, Asp451和Tyr452等七个氨基酸残基间存在疏水作用。 UA同Trp214, Arg218和Lys444等残基存在氢键作用, 键长分别为3.01, 2.88与2.65 Å, 此外还与Leu198, Gln221, Arg222, Asn295, Val343, Pro447, Cys448, Asp451和Val455等9个氨基酸残基间存在疏水作用。 由于UA同HSA作用位点数目多于OA, 说明UA与HSA疏水性空腔的空间匹配程度更高。 因此, 认为HSA-UA与HSA-OA复合物间稳定性差异是HSA实现对OA与UA异构体识别的原因。
Oleanolic acid (OA) and ursolic acid(UA) are isomeric pentacyclic triterpenoid compounds, which share the similar physical and chemical properties but a little bit different pharmacological activity. At present, various chromatography and mass spectrometry methods have been used to discriminate OA and UA isomerically, but there seems no fluorescence spectroscopy-based method reported. This paper presents a method for the identification of OA and UA isomers using fluorescence quenching. Firstly, two common serum albumins, bovine serum albumin (BSA) and human serum albumin (HSA), interacting with OA and UA are examined, respectively. Experimental result shows that OA and UA can effectively quench fluorescence emission of BSA and HSA. The result of obtained fluorescence quenching data shows the bi-molecular quenching constants of BSA (or HSA) and OA (or UA) are much higher than the maximum scatter collision-quenching rate constant generally observed for any quencher against biopolymer (2.0×1010 L·(mol·s)-1), indicating the type of quenching is static quenching, namely, OA and UA can form stable complexes with BSA and HSA. Double logarithm equation was also applied to the fluorescence quenching data and binding site numbers of the complexes formed by OA or UA and BSA or HSA are obtained between 0.90 and 1.26, indicating all complexes are 1:1 type. The apparent binding constants (KA) of BSA-OA and BSA-UA complexes are at the same order of magnitude, but those of HSA-OA and HSA-UA are very different. The KA of HSA-UA is 124.91 times higher than that of HSA-OA, indicating HSA-UA has much higher stability. Synchronous fluorescence experimental result shows that the spectrum at 60 nm wavelength difference (Δ λ) can be quenched more effectively than that of 15 nm Δ λ alongwith the addition of OA and UA, showing the binding sites of OA and UA at HSA may beclose toTrp residues. The results of molecular docking simulation show that both OA and UA are docked at a hydrophobic cavity in HSA, and there is strong hydrogen bonding and hydrophobic effect between the host and the guest. In addition, three hydrogen bonding interaction are found between OA and Arg218, His242 and Pro447 residues of HSA with bond lengths of 2.95, 2.97 and 3.17 Å, respectively. There are seven amino acid residues of HSA that has hydrophobic effect with OA including Lys195, Lys199, Trp214, Arg222, Leu238, Asp451 and Tyr452. Whereas UA forms three hydrogen bonds with Trp214, Arg218 and Lys444 residues of HSA with bond length of 3.01, 2.88 and 2.65 Å, respectively. Nine amino acid residues including Leu198, Gln221, Arg222, Asn295, Val343, Pro447, Cys448, Asp451 and Val455 have hydrophobic effect with UA. Since UA has stronger hydrogen bonding and more hydrophobic effect with HSA, it is more spatially fitted to the HSA’s hydrophobic cavity. Thus, according to the fluorescence spectral data and molecular docking results, the stability difference of HSA-OA and HSA-UA may be responsible for discrimination of OA and UA isomers.
齐墩果酸(oleanolic acid, OA)与熊果酸(ursolic acid, UA)同为五环三萜类化合物, 二者为同分异构体, 共同存在于多种植物中, 具有相似的理化性质和药理活性。 已有研究表明OA与UA对于不同类型肝损伤具有一定程度的修复作用[1], 可抑制NS5B聚合酶剂具有抗丙肝病毒活性[2]。 但在面对某些病症时OA与UA表现出一定的活性差异, 例如在抑制革兰氏阳性菌活性时, UA反馈的效果更为明显[3]。 因此, 对于OA与UA的识别在医学上具有积极意义。
人们大都采用各种色谱分离方法识别OA与UA。 Liu等[4]采用胶束电动毛细管色谱法实现了OA与UA的区分, Gao等[5]采用毛细管区带电泳法实现了OA与UA的识别。 此外Janicsak等[6]采用了气相色谱法区分OA与UA。 但气相色谱法的测定条件较为苛刻, 因此人们大多转而采用高效液相色谱法(HPLC), 如Kamatou等[7]通过HPLC法证明了OA和UA富含于鼠尾草中, Xu等[8]通过RP-HPLC法实现了枇杷叶片中OA与UA的定量检测。 此外, 各种色谱-质谱联用技术[9, 10, 11]也常用来进行OA与UA的区分或识别, 如于湛等[12]通过质谱技术也实现了对OA与UA的识别。
本文使用荧光光谱法, 选用常见的两种血清蛋白— 牛血清白蛋白(bovine serum albumin, BSA)与人血清白蛋白(human serum albumin, HSA)作为识别试剂, 研究其对OA与UA的异构体识别。 本文发现OA与UA对HSA的荧光猝灭程度不同, 所形成的复合物的稳定常数存在较大差异, 并通过分子对接技术推测了HSA与OA及UA所形成复合物的结构。
Cary Eclipse型荧光光谱仪(美国Varian公司), LAMBDA 25型紫外-可见光谱仪(美国PE公司), FE20K型pH计(上海梅特勒托利多公司)。
BSA购自美国Sigma公司, HSA与三羟甲基氨基甲烷(Tris)购自美国Amersco公司, OA与UA购于上海如吉生物技术有限公司, 其余试剂均购自国药集团化学试剂有限公司, 实验用水为二次去离子水。 上述试剂均为分析纯或更高, 且在实验中未经预处理而直接使用。
配制浓度均为1.0× 10-3 mol· L-1的OA与UA的乙醇溶液备用。 使用Tris, NaOH, HCl与NaCl配制pH分别为5.4, 6.4, 7.4, 8.4与9.4的缓冲溶液并保证其中Tris与NaCl浓度均为0.1 mol· L-1。 BSA与HSA使用上述缓冲溶液配置为5× 10-4 mol· L-1储液备用。
依次将20 μ L BSA(或HSA)储液、 1 000 μ L缓冲溶液以及适量的OA(或UA)储液加入离心管中并使用去离子水定容至4 000 μ L, 恒温水浴一定时间后, 立即测其荧光发射强度。
荧光光谱仪设置如下, 激发波长λ ex为280 nm, 扫描范围为280~450 nm, 激发与发射狭缝宽度均为5 nm。 同步荧光实验光谱仪设置如下: 扫描范围为200~350 nm, 激发与发射狭缝宽度均为5 nm, Δ λ 分别为15与60 nm。
BSA与HSA结构来自RSCB蛋白质数据库, 编号分别为4F5S与1AO6。 OA与UA的三维结构取自PubChem网站, 并通过Avogadro程序的MMFF94[13]分子力场优化。 本文使用Autodock 4.2程序[14]进行分子对接模拟。 分子对接所需格子(Grid)采用边长为12.6 nm的立方体, 格子间隔为0.037 5 nm。 OA与UA分子中可旋转的单键数量按照AutoDock默认值选取。 采用LGA算法优化对接结果, 几个重要的参数设置如下: ga_pop_size为150, ga_num_evals为2.5× 107, ga_run为300, 其余参数均使用默认值。 使用LigPlot+程序分析主客体间的相互作用。
由于物质的荧光发射受溶液条件影响较大, 因此在荧光猝灭实验之前需要考察各种溶液条件对实验结果的影响。 本文配制含有一定量的血清蛋白与猝灭剂(OA或UA)的混合溶液后, 分别置于生理温度(37 ℃)下水浴0, 10, 30, 60, 90和120 min, 随后立即测试其荧光强度, 结果显示随着水浴时间的延长, 血清蛋白的荧光发射均呈现下降随后稳定不变的趋势, 转折点均发生在10~30 min。 考虑到水浴时间过短会导致血清蛋白与猝灭剂结合不充分, 而过长会增加蛋白质暴露在空气中被氧化的可能, 因此本文中水浴时间设置为30 min。
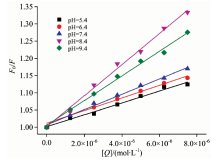
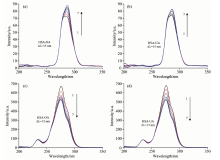
本文以UA猝灭BSA为例, 考察了pH对荧光猝灭的影响。 图2为不同pH下, 不同浓度UA猝灭2.5× 10-5 mol· L-1 BSA的F0/F(无猝灭剂与有猝灭存在时荧光物质发光强度之比)对[Q](猝灭剂浓度)关系图。 由图2可见, 在pH 8.4时UA对于BSA的猝灭效果最好, 这与类似报道的结论不同[15, 16]。 一般认为, pH 7.4时血清蛋白的结构最接近真实结构, 所形成的疏水性口袋具有最强的结合能力, 但本文实验结果显示高于7.4的pH更有利于UA猝灭BSA, 我们推测这可能是由于UA体积较大, 当BSA在pH> 7.4条件下发生部分变性, 松散的疏水空腔可以与UA的结合更强的缘故。 当使用HSA与OA时, 所得实验结果相同, 因此后续实验中选择pH 8.4。
猝灭剂对荧光物质激发波长或发射波长的吸收而产生的内滤效应会对实验结果产生一定影响, 可通过下述式(1)对荧光强度进行修正
其中Fcorr与Fobs为校正后与实验观察到的荧光强度, Aex与Aem为溶液在发射波长与激发波长下的吸光度。
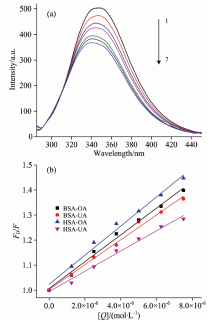
图3(a)给出了在温度为37 ℃、 pH 8.4时, 校正内滤效应后UA对BSA的猝灭曲线。 由图可见, 随着UA浓度的增加, BSA的荧光发射明显减弱, 这表明了BSA与UA之间存在相互作用。 当使用UA猝灭HSA或使用OA猝灭BSA, HSA时, 所得结果与上述类似。
为了探究猝灭剂对血清蛋白的猝灭机理, 本文采用Stern-Volmer方程(2)分析了OA(或UA)猝灭BSA(或HSA)的猝灭曲线, 所得结果见图3(b)与表1。
| 表1 OA, UA与BSA, HSA的相互作用常数 Table 1 Binding constants of the interaction between OA or UA and BSA or HSA |
式中: Kq为双分子猝灭速率常数, τ 0为生物大分子独立存在时的平均荧光寿命, [Q]为猝灭剂浓度。
由图3可见无论OA还是UA, 其F0/F对[Q]均呈现良好的线性关系, 即猝灭剂的加入可促使血清蛋白荧光均匀地猝灭, 据此可初步判断猝灭剂与血清蛋白只存在一种结合类型。 由于Kq值均在1012 L· (mol· s)-1数量级, 远大于各类剂对生物大分子最大扩散控制的碰撞猝灭速率常数2.0× 1010 L· (mol· s)-1, 因此说明OA或UA对BSA或HSA的荧光猝灭作用是静态猝灭, 即猝灭剂与荧光剂之间形成了稳定的复合物。
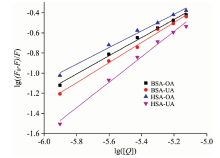
随后本文利用双对数方程[17](3)分析了静态猝灭发生时猝灭剂与荧光剂的表观结合常数KA及结合位点数n, 所得结果见图4与表1。
由表1中数据可以看出OA与UA都可与BSA或HSA形成1:1型复合物, 但是KA值之间相差十分明显。 BSA-OA与BSA-UA复合物的KA均处在相同的数量级, 但是HSA-OA与HSA-UA之间的KA相差两个数量级, 由此可见OA, UA与HSA形成的复合物稳定性上存在明显差异, 即HSA可识别OA与UA。
荧光猝灭法显示的HSA中所有的芳香性氨基酸荧光发射叠加结果, 可通过同步荧光光谱法检测HSA中Trp与Tyr残基受客体的影响情况, 考察客体对HSA构象的影响。 当Δ λ =60 nm时所得为HSA中Trp残基的同步荧光光谱; Δ λ =15 nm时所得为HSA中Tyr残基的同步荧光光谱, 见图5。
当Δ λ =15 nm时, 可以观察到HSA的荧光发射强度随着OA与UA浓度的增加而增强, 这由于OA与UA自身所产生的荧光与HSA荧光发射叠加的结果。 当Δ λ =60 nm时, HSA的荧光发射强度随着OA与UA浓度增加而呈现明显的下降, 显示OA, UA与HSA的结合对于其Trp残基的微环境存在明显的影响, 其结合位点可能位于Trp残基附近。
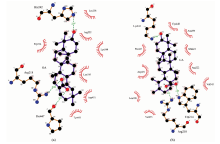
利用AutoDock软件对OA, UA与HSA所形成复合物的结构进行了模拟研究, 考察HSA对OA与UA的识别机理。 图6给出了HSA-OA与HSA-UA能量最低分子对接结果中主客体间相互作用情况。 由图可见, OA与UA均对接在HSA结构中一个疏水性空腔中, 主客体之间存在氢键与疏水作用。 OA同Arg218, His242, Pro447等残基间存在氢键作用, 键长依次为2.95, 2.97与3.17 Å , 此外还与7个氨基酸残基间存在疏水作用; UA同Trp214, Arg218, Lys444残基间存在氢键作用, 键长依次为3.01, 2.88与2.65 Å , 此外还与9个氨基酸残基间存在疏水作用。 由于UA同HSA作用位点数目多于OA, 说明UA与HSA疏水性空腔的空间匹配度更高, 从而印证了HSA-UA复合物的稳定常数大于HSA-OA。
通过荧光猝灭法结合分子对接研究了BSA与HSA对OA与UA的异构体识别作用。 实验表明在水浴温度为37 ℃、 水浴时间为30 min, pH为8.4的条件下, OA与UA对BSA及HSA都具有明显的猝灭作用。 进一步研究表明OA与UA猝灭BSA与HSA均为静态猝灭, 是通过形成1:1型复合物实现荧光猝灭。 实验结果表明BSA-OA与BSA-UA复合物的稳定常数在同一数量级, 而HSA-OA与HSA-UA的稳定常数之间相差两个数量级, 显示HSA对于OA与UA具有一定的识别能力。 同步荧光光谱数据显示OA与UA均结合在HSA的Trp214残基附近。 分子对接研究结果表明, 促使形成HSA-OA与HSA-UA复合物形成的驱动力是氢键与疏水作用, 而且UA与HSA的结合要强于OA, 这可能是UA与HSA所形成复合物具有更大稳定常数的原因。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|