作者简介: 檀贯妮, 女, 1994年生, 中国林业科学研究院林产化学工业研究所硕士研究生 e-mail: tanguanni@126.com
对三苯胺进行溴代和C-N偶联反应合成4-萘基三苯胺(a), 对脱氢枞酸进行酯化、 溴代、 硝化、 还原和C-N偶联反应合成13-[N,N-(4-萘基苯基)-苯基]胺基-脱异丙基脱氢枞酸甲酯(b)及13-[N,N-双(4-萘基苯基)]胺基-脱异丙基脱氢枞酸甲酯(c)两个化合物, 通过1H MNR,13C MNR及MS对化合物的结构进行表征。 为了研究化合物结构与光谱性能之间的关系, 首先利用Gaussian 09程序采用密度泛函DFT/B3LYP方法, 对三个化合物的空间构型进行全优化, 得到它们的键长、 键角和二面角, 对比发现脱氢枞酸骨架和萘环的引入会影响化合物的共平面性, 而萘环的引入会增大化合物的共轭程度。 光谱性能方面, 研究了三种化合物在甲醇、 二氧六环、 四氢呋喃、 二氯甲烷和环己烷这5种极性逐渐减小的溶剂中的荧光发射光谱和紫外吸收光谱。 结果表明, 在荧光光谱中, 化合物a, b和c在不同极性溶剂中最大荧光发射波长均有不同程度位移, 在甲醇中最大, 在环己烷中最小, 但是位移并非随着极性的增大而只发生红移, 在二氯甲烷、 四氢呋喃和二氧六环3种极性依次增大的溶剂中, a, b, c的荧光发射波长均随着溶剂极性的增大而发生较大程度的蓝移; 在同一溶剂中, 化合物b和c相对于a的荧光发射波长依次发生红移, c的红移程度与b差距不大。 紫外吸收光谱中, 三个化合物在不同极性溶剂中的最大吸收波长也有差异, 在200~250 nm区间, 三个化合物均在二氯甲烷中有较大位移, 在300~350 nm区间, 在甲醇中位移较大, 而在250~300 nm区间, 最大吸收波长差别不大; 在同一溶剂中, 它们在300~350 nm区间的最大吸收波长差别较大, 化合物c较a红移26 nm。 结合结构优化所得数据可以证明, 化合物的共轭程度对荧光发射光谱和紫外吸收光谱均有影响, 而共平面性对荧光发射光谱影响较大。 化合物a, b和c在不同极性溶剂中荧光发射光谱和紫外吸收光谱的较大变化, 表明它们有明显的溶致变色行为, 具有作为分子探针探测外部环境极性大小的潜能。
Three compounds 4-naphthyltriphenylamine(a), methyl 13-[N,N-(4-naphthylphenyl)- phenyl]aminodeisopropyldehydroabietate(b) and methyl 13-[N,N-Bis(4-naphthylphenyl)]aminodeisopropyldehydroabietate(c) were synthesized by esterification, bromine reaction, nitration reaction, reduction reaction and C-N coupling reaction using triphenylamine and dehydroabietic acid respectively. Their structures were characterized by1H MNR,13C MNR, and MS. In order to study the relationship between structures and spectral properties of compounds, molecular configuration of compounds were optimized by DFT/B3LYP using Gaussian 09, then their bond lengths, bond angles, and dihedral angles were obtained and compared. The results show that the introduction of dehydroabietic acid skeletons and naphthalene rings affect the coplanarity and the introduction of naphthalene rings increase their conjugated degree. Their fluorescence emission spectra and UV absorption spectra in five solvents with decreasing polarity, such as methanol, dioxane, THF, dichloromethane and cyclohexane were also studied. The results show that the maximum fluorescence emission wavelengths of compounds differ greatly in different polar solvents. The fluorescence emission wavelength is the largest in methanol, and which is the smallest in cyclohexane, however, the fluorescence emission wavelengths are not increase with increasing polarity, the fluorescence emission wavelengths of compounds have large degree of blue-shift in dichloromethane, THF and dioxane with increasing polarity. In the same solvent, the maximum fluorescence emission wavelengths of compounds b and c were red-shift relative to compound a, the red-shift degree of compound c was similar to that of compound b. In UV absorption spectra, the maximum absorption wavelengths of compounds a, b and c in different polar solvents are also different. In 200~250 nm range, their maximum absorption wavelengths have big shift in dichloromethane from which is in other four solvents, but in 300~350 nm range, their maximum absorption wavelengths have big shift in methanol, and they have almost the same wavelengths in five solvents in 250~300 nm range. In the same solvent, their maximum absorption wavelengths in 300~350 nm range differ greatly, and compound c has a big red-shift (26 nm) from a. Combining with the structural optimization datas, it shows that the conjugated degree of compounds has a great effect on the fluorescence emission spectra and the UV absorption spectra, however, coplanarity affects the fluorescence emission spectra of compounds significantly. The differences in fluorescence emission spectra and UV absorption spectra of compounds a, b and c in different polar solvents indicate that three compounds have significant solvatochromism effect, which means they have potential to be used as fluorescent probes in different polar environment.
分子内电荷转移(intranelecular charge transfer, ICT)态化合物作为小分子有机电致发光材料体系中的一类, 一直受到国内外学者的广泛重视[1, 2]。 分子内电荷转移反应是指发生在分子内部不同基团之间的电荷转移反应。 通过分子内电荷转移反应可以调节分子能隙, 实现对分子光电性能的调控, 是一种获得多色显示的方法[3]。 通常将发生反应的两个基团分别被定义为电子给体(Donor)和电子受体(Acceptor), 该分子称为D-A结构分子。 D-A结构分子的电子给体主要包括苯胺、 咔唑、 噻吩、 吡咯及呋喃等富电子基团[4, 5], 电子受体(A)包括萘酰亚胺[6, 7], 二苯砜[8], 苯并噻二唑[9], 三嗪[10], 丙二腈、 茚酮和萘酮[11], 蒽[12, 13, 14]和萘[15]等吸电子基团。 其中, 以三苯胺为电子给体, 萘为电子受体的D-A结构分子可作为发光材料用于发光二极管、 太阳能电池以及薄膜转换器中[15]。
溶致变色现象是一种溶液与有机荧光分子相互作用而产生颜色改变的现象。 由于溶剂的极性发生变化, 引起有机染料的吸收光谱或发射光谱产生不同响应性, 从而诱导有机荧光染料表现出不同的显色能力[16]。 因此溶致变色染料是一种具有良好属性的基本材料, 被广泛应用于荧光探针、 指示剂、 显色剂及分子识别等领域[17]。 在前期研究中, 对脱氢枞酸三芳胺化合物在不同极性溶剂中的荧光光谱进行了研究, 这些共轭芳族化合物, 激发时发生π → π * 跃迁, 其荧光光谱受溶剂极性的影响较大, 呈现“ 溶致变色效应” [18]。 而以脱氢枞酸三芳胺为供体构建的D-A结构分子是否也具有溶致变色行为? 它们的溶致变色行为与结构的关系怎样? 为了探求以上问题的答案, 以三苯胺、 脱氢枞酸三芳胺及萘硼酸为原料, 通过C-N偶联反应合成了3个具有大共轭结构的D-A型化合物, 通过优化其分子结构和测试其在不同溶剂中的荧光发射光谱及紫外吸收光谱, 研究它们在不同溶剂中光谱的变化规律, 探索化合物的结构与其光谱性能之间的关系。
IKA-C-MAG HS 7磁力搅拌器, 德国IKA; EYEL-1001旋转蒸发仪, 上海爱朗仪器有限公司; PE LS55荧光分光光度计, 美国PE; 基质辅助激光解离飞行时间质谱仪, 德国Bruker; Aduance Ⅲ 300 MHz核磁共振仪, 德国Bruker; UV2450紫外-可见光谱仪, 日本岛津; 脱氢枞酸三芳胺(实验室自制), 二氧六环、 四氢呋喃及二氯甲烷为色谱纯, 其他试剂和溶剂均为分析纯。
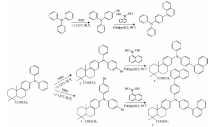
脱氢枞酸三芳胺按照文献方法合成。 化合物a, b, c的合成路线如图1, 具体方法如下:
1.2.1 4-萘基三苯胺(a)
将10 mmol三苯胺及9.8 mmol N-溴代丁二酰亚胺(N-bronosuccinimide, NBS)分别溶于乙腈中, 再将NBS溶液缓慢滴入三苯胺溶液中, 25 ℃下避光反应24 h, 反应结束后, 减压蒸除乙腈, 用乙醇重结晶, 得4-溴三苯胺(1)。
将5 mmol 4-溴三苯胺(1)、 5 mmol萘硼酸、 0.42 mmol Pd(dppf)Cl2溶于乙二醇二甲醚(Ethylene glycol dinethyl ether, DME)中后转移到三口烧瓶中, 将25 mmol K2CO3溶于30 mL水之后也转移到该烧瓶中, 在90 ℃下反应8 h。 反应结束后, 冷却至室温, 加入CHCl3和水, 萃取有机相, 加入无水硫酸镁, 静置, 抽滤, 减压蒸除溶剂。 柱层析分离提纯(洗脱剂, 石油醚: 乙酸乙酯1:16~1:20), 得到4-萘基三苯胺(a)。
1.2.2 13-[N, N-(4-萘基苯基)-苯基]胺基-脱异丙基脱氢枞酸甲酯(b)
将5 mmol脱氢枞酸三芳胺及4.9 mmol NBS分别溶于乙腈中, 将NBS溶液缓慢滴入脱氢枞酸三芳胺溶液中, 25 ℃下避光反应24 h, 反应结束后, 减压蒸除乙腈, 用乙醇重结晶, 得到13-[N, N-(4-溴苯基)-苯基]胺基-脱异丙基脱氢枞酸甲酯(2)。
将1 mmol 13-[N, N-(4-溴苯基)-苯基]胺基-脱异丙基脱氢枞酸甲酯(2)、 1 mmol萘硼酸、 0.08 mmol Pd(dppf)Cl2加入DME中, 将5 mmol K2CO3溶于20 mL水之后加入DME中, 在90 ℃下反应8 h。 反应结束后, 冷却至室温, 加入CHCl3和水, 萃取有机相, 加入无水硫酸镁, 静置, 抽滤, 减压蒸除溶剂。 柱层析分离提纯(洗脱剂, 石油醚: 乙酸乙酯1:16~1:20), 得13-[N, N-(4-萘基苯基)-苯基]胺基-脱异丙基脱氢枞酸甲酯(b)。
1.2.3 13-[N, N-双(4-萘基苯基)]胺基-脱异丙基脱氢枞酸甲酯(c)
将5 mmol脱氢枞酸三芳胺及10 mmol NBS分别溶于乙腈中, 将NBS溶液滴入脱氢枞酸三芳胺溶液中, 25 ℃下避光反应24 h, 反应结束后, 减压蒸除乙腈, 用乙醇重结晶, 得到13-[N, N-双(4-溴苯基)]胺基-脱异丙基脱氢枞酸甲酯(3)。
将1 mmol 13-[N, N-双(4-溴苯基)]胺基-脱异丙基脱氢枞酸甲酯(3)、 2 mmol萘硼酸、 0.16 mmol Pd(dppf)Cl2加入DME中, 将10 mmol K2CO3溶于34 mL水之后加入DME中, 在90 ℃下反应8 h。 反应结束后, 冷却至室温, 加入CHCl3和水, 萃取有机相, 加入无水硫酸镁, 静置, 抽滤, 减压蒸除溶剂。 柱层析分离提纯(洗脱剂, 石油醚: 乙酸乙酯1:16~1:20), 得13-[N, N-双(4-萘基苯基)]胺基-脱异丙基脱氢枞酸甲酯(c)。
1.4.1 荧光发射光谱
准确称取化合a, b和c移入100 mL容量瓶中, 用甲醇定容, 配置成浓度为1× 10-4 mol· L-1的储备溶液。 分别移取50 μ L于10 mL容量瓶中, 分别用不同极性的溶剂无水甲醇、 二氧六环、 四氢呋喃、 二氯甲烷和环己烷(溶剂极性依次从大到小)定容, 得到浓度为5× 10-7 mol· L-1的各试样, 在室温下测试其荧光发射光谱。
1.4.2 紫外吸收光谱
移取2 mL上述1× 10-4 mol· L-1的储备溶液于10 mL容量瓶中, 烘干除去甲醇, 然后分别用不同极性的溶剂无水甲醇、 二氧六环、 四氢呋喃、 二氯甲烷和环己烷(溶剂极性依次从大到小)定容, 得到浓度为2× 10-5 mol· L-1的各试样, 在室温条件下测试其紫外吸收光谱。
a: 白色固体, 得率60%, mp: 132 ℃, 1H NMR (300 MHz, DMSO-d6, ppm) δ 7.99 (d, 1H, CH), 7.93 (d, 2H, 2CH), 7.62~7.48 (m, 3H, 3CH), 7.45 (s, 1H, CH), 7.42 (d, 1H, CH), 7.40~7.30 (m, 5H, 5CH), 7.11 (t, 8H, 8CH); 13C NMR (300 MHz, DMSO-d6, ppm) δ : 122.60(2C), 123.15(2C), 124.13(4C), 125.21, 125.45, 125.75, 126.14, 126.63, 127.25, 128.22, 129.50(4C), 130.66(2C), 130.79, 133.41, 133.77, 138.98, 146.49, 147.02(2C); MALDI-TOF MS[M+H]+371.0。
b: 淡黄色固体, 得率57.2%, mp: 136~141 ℃, 1H NMR (500 MHz, DMSO-d6, ppm) δ 7.99 (d, 1H, CH), 7.91 (dd, 2H, 2CH), 7.60~7.49 (m, 3H, 3CH), 7.45 (t, 2H, 2CH), 7.40 (d, 1H, CH), 7.38 (d, 1H, CH), 7.33 (t, 1H, CH), 7.30~7.24 (m, 1H, CH), 7.12 (s, 1H, CH), 7.10 (d, 1H, CH), 7.08 (d, 1H, CH), 7.06 (s, 1H, CH), 6.99 (d, 1H, CH), 6.91 (t, 1H, CH), 6.82 (d, 1H, CH), 3.61 (s, 3H, CH3), 2.33 (t, 1H, CH), 2.08 (t, 1H, CH), 1.60 (d, 1H, CH), 1.42~1.33 (m, 2H, 2CH), 1.33~1.26 (m, 1H, CH), 1.26~1.05 (m, 8H, 2CH3和CH2), 0.95 (dd, 1H, CH), 0.89~0.80 (m, 2H, CH2), 13C NMR(500 MHz, DMSO-d6, ppm) δ : 16.21, 17.93, 20.85, 24.62, 26.25, 29.14, 36.13, 36.51, 44.71, 46.86, 51.77, 113.72, 122.08, 122.55, 122.81, 122.85, 122.90, 123.81, 124.62, 124.96, 125.21, 125.26, 125.49, 125.64, 125.79, 126.18, 126.68, 127.21, 127.32, 128.26, 129.43, 130.60, 130.77 (2C), 130.82, 132.12, 133.28, 133.44, 146.66, 177.89 (C=O); MALDI-TOF MS[M+H]+565.1。
c: 淡黄色固体, 得率56.7%, mp: 149~156 ℃, 1H NMR (500 MHz, DMSO-d6, ppm) δ 7.99 (d, 2H, 2CH), 7.93 (s, 4H, 4CH), 7.60~7.49 (m, 6H, 6CH), 7.44 (d, 6H, 6CH), 7.33 (s, 1H, CH), 7.20 (s, 4H, 4CH), 7.03 (s, 1H, CH), 6.94 (s, 1H, CH), 3.62 (s, 3H, CH3), 2.83 (t, 2H, CH2), 2.34 (d, 1H, CH), 2.09 (d, 1H, CH), 1.60 (d, 1H, CH), 1.40 (s, 2H, CH2), 1.32 (s, 1H, CH), 1.22 (d, 7H, 3CH3 and CH), 0.87 - 0.79 (m, 2H, CH2), 13C NMR (500 MHz, DMSO-d6, ppm) δ : 16.22, 17.94, 20.88, 24.62, 26.25, 29.19, 36.53, 39.00, 44.71, 46.87, 51.77, 122.68(4C), 123.14, 125.27(2C), 125.50(2C), 125.64, 125.79(2C), 126.17(2C), 126.68(2C), 127.26(2C), 128.25(2C), 130.74(4C), 130.82(3C), 133.44(2C), 133.74(2C), 135.94, 139.06(2C), 143.98, 145.30, 146.49(2C), 177.91 (C=O); MALDI-TOF MS[M+H]+691.2。
在B3LYP/6-31G* 水平下, 得到了a, b及c的优化构型如图2所示。
 | 图2 在B3LYP/6-31G* 水平下优化得到的(a), (b)和(c)的空间构型Fig.2 Optimized spatial configurations of (a), (b), and (c) at B3LYP/6-31G* levels |
化合物a, b和c中与氮原子相连分别有三个苯环, 分别标记为a-1~a-3, b-1~b-3, c-1~c-3, a-1, b-1, c-1及c-3上各连有一个萘, 化合物空间构型分别是以a-1, b-1, c-1苯环平面的正前方观察得到的, 如图2。 综合图2和表1, 从二面角的数据可以看出, 化合物b中苯环b-1所在平面与苯环b-2之间的二面角(C28-N-C56-C58)为41.28° , 化合物c中苯环c-1与苯环c-2之间的二面角(C28-N-C53-C55)为40.62° , 而化合物a中对应的苯环a-1与苯环a-2之间的二面角(C5-N-C20-C22)为38.4° , 可见, 化合物c和c中脱氢枞酸骨架的引入导致空间位阻增大, 因此二面角也相应增大。 化合物b中苯环b-3所在平面与b-2所在平面之间的二面角(C46-C45-N-C28)为-139.8° , 化合物a和c中对应位置的二面角分别为(C10-C9-N-C5)-137.2° 、 (C46-C45-N-C28)-139.2° , 同样说明脱氢枞酸骨架的引入会增大两个芳环之间的扭曲程度。 化合物b中b-3平面与b-1平面之间的二面角(C46-C45-N-C56)为41.67° , 化合物c中对应位置c-1与c-3之间的二面角为(C46-C45-N-C53)为41.69° , 可以看出脱氢枞酸三芳胺上引入不同个数的萘环对三芳胺上三个苯环之间扭曲程度的影响很小。 化合物b中萘环与b-1平面之间的二面角(C61-C63-C66-C67)为56.06° , 化合物c中对应位置萘环与c-1之间的二面角(C58-C60-C63-C64)为55.57° , 二者相差不大。
| 表1 化合物a, b, c优化得到的部分键长、 键角和二面角 Table 1 Partial bond lengths, bond angles, and dihedral angles optimized for compounds a, b, and c |
而化合物c中另一个萘环与c-2平面之间的二面角(C49-C51-C80-C82)为129.03° , 可见萘环的增加, 使得分子中苯环与萘环之间发生较大程度的扭曲。
由表1可以看出, 三个化合物的键长和键角的数据相差不大, 且化合物中的C-N键长都在0.142 nm左右, 介于C-N单键(0.146 nm)和C=N双键(0.137 nm)之间[21], 说明芳环连接于N原子上增加了电子的离域, 增强了C-N键的强度, 可以预测合成的化合物可能具有较好的荧光性质。
测试了化合物a, b和c在无水甲醇、 二氧六环、 四氢呋喃、 二氯甲烷和环己烷(溶剂极性逐渐减小)5种不同极性溶剂中荧光发射光谱, 化合物a, b和c在不同极性溶剂中的荧光发射光谱图如图3中(a), (b)和(c)所示, 化合物a, b和c在同一种溶剂甲醇中的荧光发射光谱图如图3(d)所示, 它们在不同溶剂中的最大发射波长及最大荧光强度如表2。
| 表2 化合物a, b和c在不同极性溶剂中的最大发射波长和荧光强度 Table 2 Maximum emission wavelengths and fluorescence intensities of compounds a, b, and c in different polar solvents |
由图3(a), (b), (c)和表2可以看出, 三个化合物在不同极性溶剂中最大荧光发射波长均有较大程度的位移, 由表2可以看出, 三个化合物在极性最大的甲醇中的发射波长最大, 分别为439.5, 446.5和449.5 nm, 在极性最小的环己烷中最小, 分别为386, 393.5和396.5 nm。 在二氯甲烷、 四氢呋喃和二氧六环3种极性依次增大的溶剂中, a, b和c的荧光发射波长均随着溶剂极性的增大而发生较大程度的蓝移, 分别蓝移22.5, 28和31 nm, 由表2还可以看出, 化合物在不同极性溶剂荧光强度相差较大, 它们均在弱极性溶剂环己烷中的具有最大的荧光强度。
由图3(d)可见, 化合物a, b和c在同一溶剂甲醇中的最大荧光发射波长和荧光强度均不同, 最大荧光发射波长分别为439.5, 446.5和449.5 nm, 化合物b, c较a分别红移了7和10 nm。 化合物b与c与a的不同之处为它们具有脱氢枞酸骨架, 而化合物c比化合物b多了一个萘环。 从理论上讲, 化合物c由于具有更大的共轭体系其荧光发射波长应该有更大红移, 但是化合物的荧光性能不仅与共轭程度有关, 与它的共平面性亦有关。 从上面结构优化数据中看出, 化合物c中另一个萘环的引入使得分子发生较大的扭曲, 其共平面性更差, 从而影响了它的荧光性能。
测试了化合物a, b和c在无水甲醇、 二氧六环、 四氢呋喃、 二氯甲烷和环己烷(溶剂极性逐渐减小)5种不同极性溶剂中的紫外吸收光谱, 化合物a, b和c在不同极性溶剂中的紫外吸收光谱图如图4(a), (b), (c)所示, 化合物a, b和c在同一种溶剂环己烷中的紫外吸收光谱图如图4(d)所示, 它们在不同溶剂中的最大吸收峰波长及最大吸光度如表3。
| 表3 化合物a, b和c在不同极性溶剂中的最大吸收波长和吸光度 Table 3 Maximum UV absorption wavelengths and absorbances of compounds a, b, and c in different polar solvents |
三个化合物均有多个吸收峰, 将吸收峰的位置按波长分成200~250, 250~300和300~350 nm三个区间。 由图4(a), (b), (c)和表3可以看出, 同一化合物在不同极性溶剂中最大吸收峰波长并不完全相同。 200~250 nm波长区间内, 化合物a, b, c在甲醇、 二氧六环、 四氢呋喃和环己烷中最大吸收波长相差不大, 而在二氯甲烷中的最大吸收波长较甲醇中发生了约10 nm红移; 250~300 nm波长区间内, 化合物a在甲醇和环己烷中出现了吸收峰, 化合物b只在环己烷中出现吸收峰, 而化合物c则在5种溶剂中都有吸收峰, 且三个化合物的最大吸收波长相差不大。 300~350 nm波长区间内, 化合物a在二氧六环、 四氢呋喃、 二氯甲烷和环己烷中最大吸收波长基本相同, 而在甲醇中相对其他4种溶剂中红移了约20 nm; 化合物b和c在二氧六环、 四氢呋喃、 二氯甲烷和环己烷中最大吸收波长基本相同, 而在甲醇中发生了蓝移, 其中化合物b蓝移较小而化合物c蓝移较大。 三个化合物在不同极性溶剂中的吸光度也有不同, 化合物a在三个波长区间的最大吸收峰吸光度值差别都较大, 而化合物b和c在200~250 nm区间峰的吸光度值差别很大, 在另外两个区间的最大吸收峰吸光度值差别较小。
结合图4(d)及表3可以看出, 化合物a, b, c在同一溶剂环己烷中最大吸收波长不尽相同, 吸光度也略有变化。 三个化合物在200~250和250~300 nm两个区间内最大吸收波长相差不大, 而在300~350 nm区间最大吸收波长不同, 化合物c与b较a分别红移了3和26 nm。 同样, 从化合物结构看, 化合物c有两个萘环, 较化合物a和b具有更大的共轭程度, 吸收波长发生明显红移。
综上所述, 化合物a, b和c在不同极性溶剂中荧光发射光谱和紫外吸收光谱均有较大变化, 表明它们有明显的溶致变色行为。
(1)利用酯化、 溴代、 硝化、 还原和C-N偶联反应合成了4-萘基三苯胺(a)、 13-[N, N-(4-萘基苯基)-苯基]胺基-脱异丙基脱氢枞酸甲酯(b)及13-[N, N-双(4-萘基苯基)]胺基-脱异丙基脱氢枞酸甲酯(c)三个具有D-A结构的化合物, 采用1H NMR和13C NMR及MS对其结构进行确认。
(2)采用Gaussian 09程序的密度泛函DFT/B3LYP方法, 对三个化合物的几何构型进行全优化。 结果表明, 脱氢枞酸骨架的的引入和萘环个数的增加影响化合物的共平面性, 萘环个数的增加影响其共轭程度, 进而影响其荧光性能及紫外吸收性能。
(3)对化合物a, b和c在不同极性溶剂中荧光发射光谱和紫外吸收光谱进行研究, 结果显示溶剂的极性对化合物a, b和c的荧光性能和紫外吸收性能均具有较大影响, 表明三个化合物均具有较明显的溶致变色行为, 具有作为分子探针探测外部环境极性大小的潜能。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|