作者简介: 王金霞, 女, 1980年生, 重庆工程职业技术学院副教授 e-mail: 42219423@qq.com
藻类的大量繁殖对饮用水源、 养殖业、 旅游业以及人类健康造成了极大的影响。 溶藻细菌作为一种生物控制手段, 在控制藻类爆发方面显示出了极大的潜力。 课题组前期分离获得一株金黄杆菌属溶藻菌 Chryseobaterium sp.S7, 研究发现该菌株具有明显的溶藻作用, 作用方式为通过分泌溶藻物质进行间接溶藻, 为进一步揭示该菌的溶藻特征及机理, 以铜绿微囊藻为目标藻种, 运用UV-Vis, EEMs, FTIR和FCM技术, 分析 Chryseobaterium sp.S7溶藻过程的光谱特性。 实验结论如下: 将菌株发酵液与藻液共培养7 d, 利用UV-Vis和EEMs技术对藻细胞Chla含量与PC荧光值变化趋势进行分析, 结果显示: 藻细胞Chla含量在第1 d便开始下降, 表明在短时间内, 细菌胞外溶藻物质便可快速作用于藻细胞, 第7 d时Chla去除率为59.37%。 藻细胞PC荧光值也呈现下降趋势, 与Chla变化趋势表现为一致性, 表明在溶藻过程中伴有Chla和PC的减少。 FTIR分析结果显示: 藻细胞结构中的C═O C—H, O—H键分别在1 647, 2 927和3 475~3 437 cm-1处的吸收峰强度明显减弱, 表明藻细胞内的多糖物质和蛋白质结构可能被破坏, 处于2 500~1 700 cm-1范围的若干小吸收峰则进一步表明藻细胞解体的现象。 分别在共培养第3 d和第7 d时对藻液进行PI特异染色, 应用FCM对藻细胞PI特异性荧光和Chla, PC自发荧光特性进行分析, 结果显示, 在细菌S7的溶藻过程中, 藻细胞PI特异性荧光逐渐增强, Chla、 PC自发荧光呈下降趋势、 表明藻细胞膜、 Chla、 PC三者破坏程度在溶藻过程中具有紧密的内在联系和较高的一致性。 溶藻过程中藻细胞表现为多种形式的损伤, 且损伤处于动态变化过程中, 由Q1(Q5)区细胞按顺序逐步向Q4(Q8)区细胞移动。 推测 Chryseobaterium sp.S7可能的溶藻过程为: 细菌将溶藻活性物质释放到细胞外, 溶藻活性物质通过破坏铜绿微囊藻细胞膜中的多糖和蛋白质的结构, 增加膜的通透性, 进一步破坏胞体内的Chla, PC和DNA/RNA等物质, 使藻体裂解死亡, 最终形成细胞碎片。 通过对 Chryseobaterium sp.S7溶藻过程藻细胞的光谱学特性的分析, 初步揭示了 Chryseobaterium sp.S7的溶藻机理, 为微生物控藻及修复技术提供了理论依据。
The proliferation of algae has had a major impact on drinking water sources, aquaculture, tourism and human health. As a kind of biological control, algae-lysing bacteria, have shown great potential in controlling algal blooms. The research group isolated a strain of Chrysosporium sp. S7 in the early stage and found that, by secreting algae-dissolving substances, the strain had obvious algae-dissolving effect on algae in an indirect way. In order to reveal its algae-dissolving characteristics and mechanism, this study, with the Microcystis aeruginosa as the target algae species, employed S7 UV-Vis, EEMs, FTIR and FCM techniques to analyze the spectral characteristics of the algae-dissolving process of Chryseobaterium sp. S7. By co-culturing the fermentation broth of the strain with the solution of algae for 7 days and by analyzing the change trend of Chla content and PC fluorescence value of algae cells through UV-Vis and EEMs techniques, the research group got the following results: the content of Chla in algae cells began to decrease on the 1st day, which indicated that the extracellular algae-dissolving substances of bacteria could quickly act on algae cells in short time, and the removal rate of Chla was 59.37% on the 7th day. In addition, the fluorescence value of PC cells in algae cells also showed a similar downward trend with the trend of Chla, indicating a decrease in Chla and PC during the algae-dissolving process. The research group found that the absorption peaks of C═O C—H and O—H bonds in the algal cell structure showed a significant downtrend at 1 647, 2 927 and 3 475~3 437 cm-1 respectively, which suggested that the polysaccharide content in algae cells and the protein structure might be destroyed, while several small absorption peaks in the range of 2 500~1 700 cm-1 further indicated the phenomenon of disintegration of algae cells. The research group also carried out PI-specific staining of algae liquid on the 3rd and 7th day, and analyzed the PI-specific fluorescence of algae cells and the auto fluorescence characteristics of Chla and PC by FCM technique. The results showed that, the PI-specific fluorescence of cells increased gradually in the algae-dissolving process of bacteria S7, and the autofluorescence of Chla and PC showed a downward trend, indicating that the damage degree of algal cell membrane, Chla and PC had a close internal relationship with each other and high consistency in the algae-dissolving process. During the algae-dissolving process, the algae cells showed various forms of damage, and the damage was in the process of dynamic change, with the Q1 (Q5) quadrant cells gradually moving to the Q4 (Q8) quadrant cells in sequence. Therefore, the possible algae-dissolving process of Chryseobaterium sp. S7 could be speculated as follows: The bacteria release the algae-dissolving active substance to the outside of the cell, and the algae-removing active substance changes the structure and permeability of the algal cell membrane by destroying the structure of the polysaccharide and protein in the cell membrane of Microcystis aeruginosa, which will further destroy Chla in the cell body, PC, DNA/RNA and other substances. All these will cause the algae to lyse and die, eventually forming cell debris. This study, by analyzing the crystallization characteristics of algae cells in the algae process of Chryseobaterium sp. S7, reveals the algae-dissolving mechanism of algae-lysing bacteria, and thus provides a theoretical basis for microbial algae control and restoration technology.
近年来, 有害藻类水华的爆发在我国部分湖(库)十分严重, 不仅影响水体水质、 危害水生生态系统, 其中蓝藻代谢产生的藻毒素还直接影响饮水安全和人类健康[1, 2]。 因此, 蓝藻水华近年来受到了越来越广泛的重视[3]。 溶藻细菌不仅可以在一定程度上控制(降低)藻类泛滥繁殖[4, 5]。 更因其环境友好性和可持续性, 成为目前蓝藻生物防治法研究的热点之一。 但藻-菌共培养体系成分十分复杂, 既含有正常藻细胞和死亡藻细胞、 又有不同生理状态下的损伤藻细胞、 以及它们各自复杂的代谢产物, 而且所有的这些成分都处于不断变动中。 由于藻-菌共同培养体系的复杂性使溶藻机理的研究变得十分困难。 近年来, 有研究者应用光谱技术对溶藻过程中的产物及机理进行了研究。 紫外-可见吸收光谱(UV-Vis absorption spectra, UV-Vis)技术被广泛应用于检测有害藻类的叶绿素a(Chlorophyll a, Chla)含量[6]。 藻蓝蛋白(Phycocyanin, PC)是蓝藻特有的蛋白质, 且具有荧光属性, 因此可以检测藻细胞的荧光值来间接表示藻细胞PC的含量[7]。 孔赟等运用傅里叶红外光谱(infrared spectroscopy, FTIR), 荧光光谱(fluorescence spectroscopy, EEMs)等技术初步揭示了Streptomyces sp.HJC-D1的溶藻机理。
流式细胞术(flow cyto metry, FCM)技术可对整个复杂体系里单个细胞水平的荧光强度进行测量, 应用FCM技术能从微粒物质、 死细胞和混合藻类中区分出活的藻细胞, 还可进行多参数设定, 测定其细胞形态、 Chla、 PC含量、 外加特异荧光等, 反映细胞膜完整性、 含量等生理生化特征。
课题组前期从三峡库区彭溪河中分离获得一株金黄杆菌属溶藻菌Chryseobaterium sp.S7, 发现该菌株通过分泌溶藻物质对铜绿微囊藻具有明显的抑制作用[7], 为进一步揭示溶藻特征及机理, 运用UV-Vis, EEMs, FTIR和FCM技术, 以PI染色外源特异性荧光、 PC、 Chla自发荧光分析Chryseobaterium sp.S7溶藻过程的光谱特性, 检测Chryseobaterium sp.S7溶藻过程中藻细胞生理特性周期性变化, 种群数量上的变动, 初步揭示溶藻菌的溶藻机理, 以期为微生物控藻及水源的生物修复技术提供理论依据。
1.1.1 藻种
以铜绿微囊藻(Microcystis aeruginosa 905)为研究对象, 将实验藻种置于恒温光照培养箱中培养, 选择BG11培养基, 培养温度设置为25 ℃, 光照强度设置为2 200 lux, 每天进行14 h: 10 h的光暗交替培养。
1.1.2 菌种
溶藻菌Chryseobaterium sp.S7, 采用牛肉膏蛋白胨斜面培养基对菌株S7进行保种, 保存温度为4 ℃, 采用牛肉膏蛋白胨液体培养基对菌株S7进行扩大培养, 培养温度设置为30 ℃, 摇床转速设置为1 500 r· min-1, 培养时间为24 h。 10 000 r· min-1离心15 min, 保留上清液, 备用。
1.2.1 菌株S7对藻细胞Chla的影响
将40 mL上清液添加至100 mL藻液中, 对照组加入40 mL灭菌细菌培养基进行共培养。 每个样品均设置3个平行样, 每日定时用721型可见分光光度计(上海)检测铜绿微囊藻Chla含量(λ =680 nm)。
1.2.2 菌株S7对藻细胞PC的影响
将40 mL上清液添加至100 mL藻液中, 对照组加入40 mL灭菌细菌培养基进行共培养。 每个样品均设置3个平行样, 每日用F-7000荧光分光光度计(日本)检测铜绿微囊藻PC特征荧光强度(λ 激发波长=620 nm, λ 发射波长=650~660 nm)[8, 9]。
1.2.3 藻细胞FTIR特性分析
将20 mL上清液添加至50 mL藻液中, 对照组中加入20 mL灭菌细菌培养基进行共同培养, 在7 d后分别取适量对照组、 实验组藻液进行离心并取其沉淀, 用双蒸水洗涤后再离心, 制成藻干粉, 再采用KBr压片的方法应用EQUINOX55型傅里叶变换红外光谱仪(德国)测定藻干粉的红外吸收光谱。
1.2.4 藻细胞荧光特性分析
取10 mL上清液添加到100 mL藻液中进行共培养, 对照组藻液加入10 mL灭菌细菌培养基。 于共培养的第3 d和第7 d, 吸取2 mL培养液至试管中, 加入200 μ L浓度为100 mmol· L-1的 PI溶液, 在25 ℃暗室中温育15 min, 加入1 mL PBS缓冲液, 将流式细胞仪Becton Dickinson FACS Calibur(美国)激发波长设为488 nm, 荧光检测波长设置为560~590 nm, 在FL2-A道收集PI荧光, 检测细胞膜完整性, 在FL4-A道收集PC荧光, 荧光检测波长大于630 nm, 在FL3-A道收集Chla荧光。
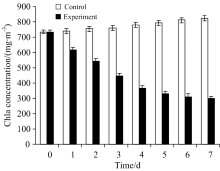
图1为实验组与对照组藻细胞Chla的含量随实验时间变化的柱状图, 由图1可知, 藻细胞Chla初始含量为718 mg· m-3, 对照组第7 d藻细胞Chla含量为812 mg· m-3, 对照组的藻细胞Chla含量呈增加的趋势, 而实验组藻细胞Chla含量在第1 d后便开始出现下降趋势, 表明在短时间内, 细菌胞外溶藻物质便可以快速作用于藻细胞, 2 d后藻液出现黄化现象, 并且藻细胞Chla含量继续下降, 第7 d时Chla含量为330 mg· m-3 , 此时Chla去除率为59.37%。 有学者报道了不同菌株对藻细胞Chla的含量均具有一定的影响。 Su[10]分离的Acinetobacter sp. J25对藻细胞Chla的去除率高达87.86%。 另有研究表明: Raoultella sp. R11在第6 d时对藻细胞Chla的去除效率高达94.28%[11]。 从菌株对藻细胞 Chla去除率结论可以看出, 菌株S7对藻细胞Chla含量的影响比其他菌株对藻细胞Chla影响低。
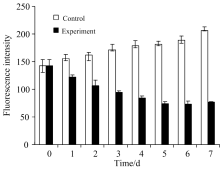
图2为实验组与对照组藻细胞PC荧光值随实验时间变化的柱状图, 从图2可知, 藻细胞PC初始荧光值为142.33, 对照组第7 d藻细胞PC荧光值为206.83, 呈增加的趋势, 实验组第7 d藻细胞PC荧光值测定值为76.40, 呈明显下降趋势, PC与Chla含量的变化趋势呈现正相关趋势。
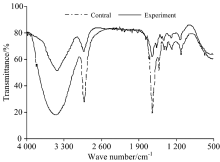
图3为藻细胞红外吸收光谱图, 从图中可以看出, 对照组与实验组藻细胞谱图主要吸收峰的位置变化不大, 峰型相似, 但主要吸收峰的相对强度均有所减弱, 对主要吸收峰进行分析发现, 实验组谱图在3 475~3 437 cm-1处吸收峰由原来的光滑峰变为尖锐峰, 且吸收强度有所减弱, 可能与藻细胞结构中O— H伸缩键被破坏有关; 在2 927和1 647 cm-1处吸收峰位置未发生变化, 但其吸收峰强度减弱, 说明藻细胞结构中C— H键与C═O键可能遭到破坏; 在2 500~1 700 cm-1范围内谱图出现了较多尖锐小峰, 这可能是藻细胞的完整形态被破坏后胞质被吸收的原因。 藻细胞红外谱图分析结果表明, 在溶藻过程中, 藻细胞内多糖物质和蛋白质类物质结构可能被破坏。 孔赟也发现铜绿微囊藻溶藻前后FTIR光谱峰型非常相近, 且在3 334 cm-1处的O— H键、 2 925 cm-1处的C— H、 1 656 cm-1处的C═O键均遭到破坏。
图4和图5分别为第3 d和第7 d对照组与实验组的FCM测试结果图, 其中(a— c)图分别为PI荧光(FL2-H)、 Chla荧光 (FL3-H)、 PC荧光(FL4-H)的直方图, M值表示具有荧光强度的藻细胞所占百分比。 (d)图为前向角与侧向角散射光(FSC-SSC-H)二维散点图。 (e)图表示PI/Chla (FL2/FL3) 荧光二维分布点图: Q1区代表PI-/Chla+细胞, 表征为藻细胞膜完整无损, 生理状态良好, 因此无PI荧光, Chla荧光强; Q2区代表PI+/Chla+细胞, 表征为藻细胞外形可能与正常细胞无差别, 但实质上细胞膜已被损伤, 因此有PI荧光, 有Chla荧光; Q3区代表PI+/Chla-细胞, 表征为死细胞, 因此PI荧光强, 无Chla荧光; Q4区代表Pl-/Chla-细胞, 又称双阴细胞, 表征为藻细胞几乎被分解, 细胞内能与PI结合的DNA/RNA被破坏, 死亡细胞对PI拒染, 因此无PI荧光、 无Chla荧光。 (f)图为PI/PC (FL2/FL4)荧光二维分布点图。
比较图4和图5可知, (a)图结果显示: 在第3 d时, 实验组PI荧光的M1值为10.7%, 较对照组M1增加了5.59%, 到了第7 d, 实验组PI荧光逐渐增强, 且出现了双峰现象。 此时M1为49.5%, 较对照组第7 d增加了44.28%, 比实验组第3 d增加了38.8%, 表明藻细胞膜完整性被破坏, Sun[12]也通过荧光染色分析表明, 菌株ZJU上清液主要影响细胞膜, 从而影响藻细胞的膜通透性和膜电位。 (b)图与(c)图结果显示: 在第3 d时, 对照组Chla荧光M2值和PC荧光M4值均大于85%, 实验组M2和M4分别为68.1%和66.6%, 明显低于对照组。 到了第7 d, 对照组M2和M4值均大于95%, 表明对照组藻细胞生长状态正常, 细胞膜完整, Chla和PC含量高, 实验组第7 d的M2和M4分别为58.3%和55.0%, 低于对照组。 实验组第7 d的M2值低于第3 d, 说明在溶藻的整个过程中, Chla荧光出现明显下降的趋势, 表示随着细菌S7的作用, 使原有Chla荧光的藻细胞不断变成了无Chla荧光的死细胞, 正常藻细胞数量逐步衰减。 Li[13]的研究结果也证实在溶藻过程中细胞色素含量显著降低, 藻细胞结构和形态受到严重破坏。 实验组第3 d和第7 d的M4分别为66.6%和为55%, 相比对照组而言, 实验组PC荧光变化也呈现下降趋势, 且与Chla荧光变化趋势一致。
从图4和图5可以看出, 第3 d对照组PI荧光值为35.3, 实验组PI荧光值为20.4, 但到了第7 d, 对照组PI荧光值降至13.3, 实验组PI荧光值增加至56.8, 对照组PI低荧光值说明了对照组藻细胞膜具有良好的完整性。 FCM检测时可以用荧光值代表浓度, 且植物细胞的光合作用与相对荧光强度呈正相关的关系, Chla和PC荧光强度即代表了细胞的代谢强度。 从第3 d至第7 d, 对照组Chla的荧光值从747增至923, PC荧光值由474增至536, 这表示对照组藻细胞密度在增加, 藻细胞代谢能力增强, 表现为Chla和PC荧光值增加。 实验组Chla荧光值则从639降至357, PC的荧光值由393降至199, 这表示在细菌的作用下, 藻细胞密度和代谢能力逐渐下降, 表现为Chla和PC荧光值下降。
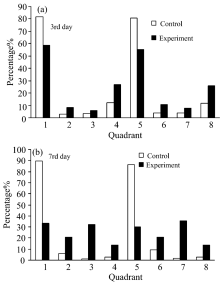
(d)图结果显示: 对照组的颗粒大小没有明显变化, 表示铜绿微囊藻细胞处于正常生长状态。 实验组(d)图中的颗粒大小发生了变化, 表明细菌的溶藻作用显著。 将(e— f)图各象限细胞的百分比分布变化进行统计(见图6), 由图6可知, 在第3 d, 对照组PI拒染的藻细胞占了94%(Q1+Q4)和92.1%(Q5+Q8), 实验组未被PI染色的藻细胞为85.9% (Q1+Q4)和81.3%(Q5+Q8), 有5.88% (Q3) 和7.76% (Q7)细胞代表细胞膜已经受损, 有27.1% (Q4)和26% (Q8)表现为PI拒染的死细胞, PI拒染原因为核酸物质受损, 造成PI不染, 到了第7 d对照组PI无染色的藻细胞占了92.57%(Q1+Q4)和89.24%(Q5+Q8), 实验组没有被PI染色藻细胞为46.9% (Q1+Q4)和43.9% (Q5+Q8), 细胞膜受损的细胞分别为32.4% (Q3) 和35.7% (Q7), 比实验组第3 d有所上升, 另有13.7% (Q4)和13.8% (Q8)表现为PI拒染的死细胞。 这说明随着时间的延长实验组藻细胞逐渐死亡, Chla和PC荧光降低, PI染色则增强。 通过分析可知在坐标轴的各象限中, Chla和PC荧光变化具有一致性, 这表明藻细胞在整个生长过程中, Chla和PC的生长代谢、 周期性变化呈现正相关的趋势。
综上, 细菌S7在溶藻过程中的损伤形式表现为: 有的无胞膜损伤存在Chla荧光(Q1)和PC荧光(Q5); 有的胞膜损伤但仍存在Chla荧光(Q2)和PC荧光(Q6), 有的胞膜损伤不存在Chla荧光(Q3)和PC荧光(Q7); 有的胞膜损伤不存在Chla荧光(Q4)和PC荧光(Q8), 即部分细胞为死细胞, 此处“ 藻细胞” 胞膜和DNA/RNA都已经受损。 在溶藻过程中, 各象限的藻细胞处于动态变化的过程, 由Q1(Q5)区细胞按顺序逐步向Q4(Q8)区移动。 Tan[14]应用FCM研究结果表明: A marine bacterium Bacillus sp. Ts-12使藻细胞Chla含量的降低, 细胞膜完整性遭到破坏, 叶绿体和核结构被破坏。 Li[14]实验结果显示在溶藻过程中塔玛亚历山大藻细胞的形态和结构受到严重损伤, 细胞器也受到严重损害。
(1)利用UV-Vis和EEMs技术对藻细胞Chla含量与PC荧光值变化趋势进行分析, 结果表明在细菌分泌的溶藻物质的持续作用下, Chla含量与 PC荧光值均随着实验时间延长呈现下降趋势, 表明在溶藻过程中藻细胞生物量呈现下降的趋势, 且伴有Chla和PC减少。
(2)根据FTIR分析显示: 藻细胞结构中的C═O C— H, O— H键分别在1 647, 2 927和3 475~3 437 cm-1处的吸收峰强度明显减弱, 意味着藻细胞内的多糖物质和蛋白质结构可能被破坏, 处于2 500~1 700 cm-1范围的若干小吸收峰则进一步表明藻细胞解体的现象。
(3)应用FCM对藻细胞PI特异性荧光和Chla、 PC自发荧光特性进行分析, 结果显示, 在细菌S7的溶藻过程中, 藻细胞PI特异性荧光逐渐增强, Chla、 PC自发荧光呈下降趋势、 表明藻细胞膜、 Chla、 PC三者破坏程度在溶藻过程中具有紧密的内在联系和较高的一致性。 溶藻过程中藻细胞表现为多种形式的损伤, 且损伤处于动态变化过程中, 由Q1(Q5)区细胞按顺序逐步向Q4(Q8)区细胞移动。
(4)初步推测Chryseobaterium sp.S7溶藻机理为: 溶藻活性物质通过破坏铜绿微囊藻细胞膜中的多糖和蛋白质的结构, 损坏细胞膜完整性, 进一步破坏胞体内的Chla、 PC、 DNA/RNA等物质, 最终使藻体裂解死亡, 形成细胞碎片。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|