作者简介: 石东坡, 1981年生, 长江大学化学与环境工程学院教授 e-mail: shidongpo2006@126.com
采用紫外吸收光谱法检测十二烷基二苯醚二磺酸钠(SLDED)与十二烷基磺酸钠(SDS)二元复合体系中SLDED的含量。 结果表明, 在复合溶液中SDS能增强SLDED的吸光度, 加入0.500 mmol·L-1复合组分SDS后, 0.500 mmol·L-1 SLDED的吸光度由0.631增加至0.682, 增幅达8.1%; 同时SDS还可以明显降低SLDED在水溶液中的表观临界胶束浓度( cmc), 当SDS的浓度从0增加至0.500 mmol·L-1时, SLDED的表观 cmc由1.12 mmol·L-1降低至0.702 mmol·L-1。 研究结果还表明, 羟丙基-β-环糊精(HP-β-CD)能有效消除SDS对SLDED紫外光谱的干扰, 加入1.000 mmol·L-1HP-β-CD后, 0.500 mmol·L-1 SLDED与0.500 mmol·L-1 SDS/0.500 mmol·L-1 SLDED复合溶液在281 nm处的吸光度分别为0.796和0.798, 相差仅0.3%, 远低于不添加HP-β-CD时的增幅。 在SLDED/SDS复合溶液中, SLDED形成胶束的标准摩尔吉布斯函变 Δγ
Ultraviolet absorption spectrophotometry was applied to the determination of sodium lauryl diphenyl ether disulfonate (SLDED) in SLDED and sodium dodecyl sulfonate (SDS) complex systems. The results indicated that the existence of SDS not only can improve the ultraviolet absorption intensity of SLDED but also can greatly decrease the apparent critical micelle concentration values of SLDED in aqueous solution. With the addition of 0.500 mmol·L-1 SDS, the ultraviolet absorption intensity of SLDED increased from 0.631 to 0.682, with an increase of 8.1%. In addition, the apparent critical micelle concentration values of SLDED reduced from 1.12 to 0.702 mmol·L-1 when the concentrations of SDS respectively increased from 0 to 0.500 mmol·L-1. The results also showed that the interference of SDS on the ultraviolet absorption intensity of SLDED could be greatly reduced by HP-β-CD. With the addition of 1.000 mmol·L-1 HP-β-CD, the ultraviolet absorption intensity of 0.500 mmol·L-1 SLDED increased from 0.796 to 0.798, with an increase of only 0.3%, much lower than the increase without HP-β-CD. SLDED molecules were more likely to form inclusion complexes with HP-β-CD rather than micelles. Thus, the standard molar Gibbs free energy for SLDED from aqueous SDS/SLDED binary blend solution to the micelle, Δγ
三元复合驱技术属油田开发的关键技术, 强化三元复合驱技术将为我国的油气田开发提供持续的创新动力[1, 2]。 十二烷基二苯醚二磺酸钠(SLDED)是三元复合驱最常用的阴离子表面活性剂之一, 准确检测三元复合驱溶液中SLDED的含量, 是了解SLDED在地层孔隙间的吸附性能及评价复合驱效率的基本途径。 SLDED分子含有独特的双磺酸盐基团, 可在分子内产生超共轭效应, 一般具有良好的表面活性。 在三元复合驱过程中, SLDED还通常与其他表面活性剂等复配形成表面活性更佳的复合驱体系, 以进一步提高SLDED的复合驱效率。
目前检测磺酸盐类表面活性剂的方法主要有光谱法、 色谱法、 界面张力法等[3, 4, 5, 6, 7], 可是已有研究表明, 复合驱体系中SLDED与其他组分(特别是表面活性剂组分)之间的协同干扰作用及混合胶束化作用[8, 9], 致使光谱法、 色谱法、 界面张力法等均难以准确测定复合驱体系中的SLDED。 鉴于此, 本文以复配组分为十二烷基磺酸钠(SDS)表面活性剂为例, 采用羟丙基-β -环糊精(HP-β -CD)包络SLDED, 通过HP-β -CD的包结作用一方面“ 阻断” SDS与SLDED之间的相互作用, 另一方面“ 阻止” SLDED分子聚团形成混合胶束[10, 11], 同时降低相互协同作用干扰以及混合胶束化行为对检测产生的影响。 与当前的检测方法相比, 本方法能准确检测三元复合驱体系中的SLDED, 回收率可达100.8%~101.4%。
SLDED, AR, 广东翁江化学试剂有限公司; SDS, AR, 江苏聚成精细化工有限公司; HP-β -CD, 国药集团化学试剂有限公司; Bruker-500核磁共振谱仪(D2O作为溶剂), 瑞士Bruker公司; NICOLET 6700 型红外光谱仪, Thermo Scientific; TU-1810型紫外-可见分光光度计, 北京普析通用仪器有限责任公司。
采用紫外光谱法分析SDS对SLDED紫外吸光度及表观临界胶束浓度(cmc)的干扰作用; 再加入HP-β -CD以修正SLDED的紫外光谱, 进而分析HP-β -CD对SLDED紫外光谱的抗干扰作用; 结合红外光谱表征(FTIR)和核磁氢谱表征(1H-NMR) 分析HP-β -CD与SLDED之间的作用机理。
分别测定0.500 mmol· L-1 SDS水溶液、 0.500 mmol· L-1 SLDED水溶液以及0.500 mmol· L-1 SDS/0.500 mmol· L-1 SLDED二元复合水溶液的紫外光谱图, 如图1。 同时检测SDS的浓度对二元复合水溶液中SLDED表观cmc的影响, 如图2。
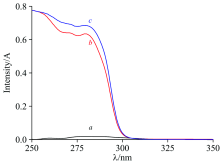 | 图1 SDS(a), SLDED(b)及SDS/SLDED复合水溶液(c)的紫外光谱图Fig.1 UV spectra of SDS (a), SLDED (b) and SDS/SLDED (c) in aqueous solution |
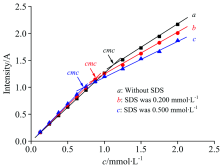 | 图2 SLDED紫外吸光度随SDS浓度变化的曲线Fig.2 Plot of ultraviolet absorbance versus SLDED concentration in the presence of different SDS concentrations |
图1中曲线a表明, SDS在250~350 nm内的紫外吸光度接近于0。 对比图1中曲线b和曲线c可知, 加入0.500 mmol· L-1复合组分SDS后, 0.500 mmol· L-1 SLDED在最大吸收波长281 nm处的吸光度由0.631增加至0.682, 增幅达8.1%, 表明了SDS能对SLDED的紫外吸光度产生明显干扰。 图2表明, SLDED在纯水中的cmc为1.12 mmol· L-1(曲线a), 加入复合组分SDS后, SLDED的表观cmc降低, 这可能是由于SDS与SLDED之间的协同作用致使二者共同参与了胶束形成过程, 当SDS的浓度分别为0.200和0.500 mmol· L-1时, SLDED在水溶液中的表观cmc分别降低至0.889及0.702 mmol· L-1, 可见SDS还能显著降低SLDED在水溶液中的表观cmc。
在水溶液中加入HP-β -CD至浓度为1.000 mmol· L-1, 再分别测定HP-β -CD水溶液中0.500 mmol· L-1 SDS, 0.500 mmol· L-1 SLDED以及0.500 mmol· L-1SDS/0.500 mmol· L-1SLDED复合溶液的紫外光谱图, 如图3。
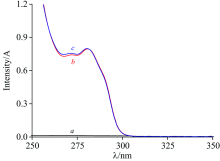 | 图3 SDS (a), SLDED (b)及SDS/SLDED复合组分(c)在HP-β -CD水溶液中的紫外光谱图Fig.3 Ultraviolet absorbance of SDS (a), SDBS (b) and SBS/SDBS (c) in HP-β -CD aqueous solution |
图3中曲线b和曲线c表明, 加入1.000 mmol· L-1 HP-β -CD后, 0.500 mmol· L-1 SLDED与0.500 mmol· L-1 SDS/0.500 mmol· L-1 SLDED复合溶液在最大吸收波长281 nm处的吸光度分别为0.796和0.798, 相差仅0.3%, 远低于不添加HP-β -CD时的增幅8.1%(见图1分析结果), 可见HP-β -CD确能显著降低SDS对SLDED紫外光谱的干扰。 这可能是因为HP-β -CD与SLDED形成了包结物, 阻断了SDS与SLDED之间的相互作用[12, 13]。 另外, 分别对比图1及图3可知, 加入1.000 mmol· L-1 HP-β -CD后, SLDED的吸光度明显变大, 可见HP-β -CD还兼具增强SLDED吸收强度的作用[13], 一般而言, 提高吸收强度有利于提高检测灵敏度。
为了明确HP-β -CD与SLDED形成包结物时二者的浓度关系, 采用等摩尔连续变化法(Job’ s法) 分析SLDED/HP-β -CD包结物的包结比。 保持水溶液中SLDED与HP-β -CD的浓度之和为1.000 mmol· L-1, 逐渐改变二者的比例, 检测时始终以相同浓度的SLDED水溶液作为检测背景, 扣除检测背景后SLDED在HP-β -CD水溶液中的吸光度随摩尔分率变化曲线如图4。
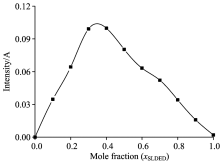 | 图4 SLDED在HP-β -CD水溶液中的Job’ s曲线Fig.4 Job’ s plot for inclusion complexation of SDBS and HP-β -CD in aqueous solution |
从图4可以看出, SLDED/HP-β -CD包结物中SLDED的摩尔分率约为0.35, 据此可推测出在水溶液中SLDED分子与HP-β -CD分子按照物质的量比1∶ 2进行包结(即SLDED/HP-β -CD包结比为1∶ 2)。
在SDS/SLDED复合水溶液中加入HP-β -CD, 保持水溶液中SDS的浓度为0.500 mmol· L-1, 逐渐提高SLDED的浓度, 复合溶液中SLDED在不同浓度HP-β -CD水溶液中的吸光度随浓度变化曲线如图5。
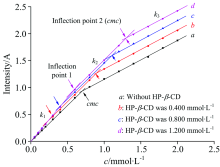 | 图5 复合溶液中SLDED在不同浓度HP-β -CD水溶液中的吸光度随浓度变化曲线Fig.5 Plot of ultraviolet absorbance versus SLDED concentration in SDS/SLDED complex in the presence of different HP-β -CD concentrations |
图5中表明, 加入HP-β -CD后, 随着SLDED浓度的增加, 复合溶液中SLDED的吸光度曲线斜率均发生了两次改变, 分别对应图5中曲线b, c和d的两个拐点, SLDED的表观cmc即第二拐点处所对应的浓度[14]。 由图5可知, SLDED的表观cmc随HP-β -CD浓度的增加而增大, 当HP-β -CD浓度为0, 0.400, 0.800及1.200 mmol· L-1时, SLDED的表观cmc分别为0.702, 0.901, 1.100和1.303 mmol· L-1。 与不添加HP-β -CD相比, SLDED表观cmc的增加幅度分别为0.199, 0.398和0.601 mmol· L-1, SLDED表观cmc的增幅与HP-β -CD浓度增幅的比例接近1∶ 2, 该比例关系与二者形成包结物时的比例关系相吻合, 表明在复合水溶液中, SLDED优先同HP-β -CD形成包结物, 包结物形成时SLDED的吸光度与浓度关系对应于图5中曲线b, c和d在第一拐点之前的直线k1。
依据王键吉等[15]采用的方法可计算出SLDED在HP-β -CD水溶液中形成胶束过程的标准摩尔吉布斯函数变化及SLDED/HP-β -CD包结物的包结比, 见表1。 表1中n为HP-β -CD的浓度, cmc* 为SLDED在HP-β -CD水溶液中的表观cmc, γ 为SLDED胶束的解离度, cmc为SLDED在纯水中的临界胶束浓度, R为复合体系中SLDED/HP-β -CD包结物的包结比。
| 表1 HP-β -CD水溶液中25 ℃时SLDED的热力学参数 Table 1 Thermodynamic parameters for SLDED in HP-β -CD aqueous solution at 25 ℃ |
由表1可知, 复合溶液中SLDED形成胶束过程的标准摩尔吉布斯函数变Δ γ
从表1还可以看出, SLDED/HP-β -CD包结物的包结比计算值在1.997~2.010之间, 表明了SLDED/HP-β -CD按物质的量计量比1∶ 2进行包结。
按照物质的量1∶ 2加入HP-β -CD, 建立SLDED水溶液的定量标准曲线, 曲线方程为y=1.601x+0.001, 再采用该定量标准曲线及纯水中SLDED的定量标准曲线(图2中曲线a), 测定一系列SDS/SLDED复合溶液中SLDED的回收率, 结果见表2。
| 表2 SDS/SLDED复合体系水溶液中SLDED的浓度分析(单位: mmol· L-1) Table 2 Analysis of SLDED for SDS/SLDED complex system in water (Unit: mmol· L-1) |
由表2可以看出, 基于纯水中SLDED的定量标准曲线难以准确测定复合溶液中SLDED的浓度, 计算出的SLDED的回收率为90.7~106.0%。 加入HP-β -CD后, 在0.100~1.500 mmol· L-1内, 复合溶液中SLDED的回收率为100.8%~101.4%, 可见HP-β -CD能够消除SDS与SLDED之间的相互作用以及胶束化作用对检测复合溶液中SLDED产生的干扰, 表明了SDS不会对HP-β -CD与SLDED的包结过程产生明显影响。
按物质的量1∶ 2制备HP-β -CD/SLDED包结物, 对SLDED及其包结物进行红外光谱(FTIR)和核磁氢谱(1H-NMR, D2O作溶剂)分析, 结果见图6及表3。
| 表3 HP-β -CD/SLDED包结物形成后HP-β -CD分子的1~6H的化学位移值 Table 3 1H-NMR chemical shift of HP-β -CD and the inclusion of HP-β -CD and SLDED |
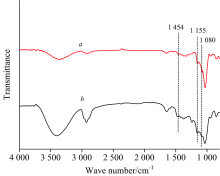 | 图6 HP-β -CD(a)以及HP-β -CD/SLDED(b)包结物的IR光谱Fig.6 IR spectra of HP-β -CD (a) and the inclusion of HP-β -CD/SLDED (b) |
由图6可知, HP-β -CD与SLDED形成包结物结构后, HP-β -CD的红外光谱谱图骨架结构无明显变化。 但在1 080 cm-1, 归属于HP-β -CD分子中连接D-吡喃葡萄糖的C— O— C基团的弯曲振动峰强度发生了明显改变, C— O— C基团位于HP-β -CD分子内腔的中部, 表明了包结物结构中SLDED分子已经进入至HP-β -CD分子的空腔中部。 图6中1 155 cm-1处归属于HP-β -CD分子窄口径端的— CH2OH基团的振动峰强度无明显改变, 而在1 454 cm-1处位于HP-β -CD分子宽口径端的— OH基团振动峰强度发生了较大改变, 表明了在包结物结构中SLDED的两个苯磺酸根基团可能偏向于HP-β -CD分子的宽口径端。
从表3可知, 包结物形成后, HP-β -CD分子中仅3H的化学位移值发生了较大改变, 而3H位于HP-β -CD分子空腔内侧偏宽口径端, 可见SLDED的苯磺酸根基团确已进入了HP-β -CD分子空腔, 并偏向于HP-β -CD分子的宽口径端。
结合以上分析结果可推测出SLDED与HP-β -CD包结物可能的形成过程如图7。
复合体系中SDS与SLDED之间的相互作用, 能明显影响SLDED的紫外吸光度及表观cmc, 致使依据SLDED吸光度与浓度关系建立的定量标准曲线不能有效测定复合体系中SLDED的浓度。 在水溶液中加入HP-β -CD后, 复合水溶液中SLDED形成胶束的Δ γ
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|