作者简介: 顾家毓, 女, 1993年生, 北京中医药大学中药学院硕士研究生 e-mail: 1922643786@qq.com
药物与生物膜相互作用的研究对于了解药物药效和改善其生物性能具有重要的意义。 但生物膜的组成复杂, 直接研究药物活性成分与生物膜的相互作用比较困难。 以脂质体作为生物膜模型, 研究了吴茱萸碱与脂质体的相互作用, 分析了吴茱萸碱分子在脂质体中的包封位置, 探讨了吴茱萸碱抗炎作用可能的作用机制。 以二棕榈酰磷脂酰胆碱(DPPC)为膜材, 应用薄膜分散法制备含有不同摩尔百分比( x)的吴茱萸碱脂质体, 应用傅立叶变换红外光谱(FTIR)和差示扫描量热(DSC)技术分析随着脂质体中药物摩尔百分比的增大, DPPC分子各红外特征吸收峰频率、 峰形及量热参数的变化情况, 从而探讨药物在脂质体中的包封位置及吴茱萸碱分子对脂质体膜流动性的影响。 实验数据表明, 在0< x<10 mol%的浓度范围内, DPPC头部区域磷酸基团的不对称伸缩振动频率没有明显变化, 脂质体相变温度和相变焓均随药物摩尔百分比的增大而减小。 在0< x<5 mol%浓度范围内, DPPC界面区域的水化的羰基峰的吸收波数由1 726.0 cm-1增加到1 731.8 cm-1, 当 x=10 mol%时, 该波数又减小到1 728.0 cm-1。 在10 mol%≤ x<20 mol%浓度范围内, 磷酸基团的不对称伸缩振动的波数由1 242.0 cm-1减小为1 236.3 cm-1, 水化的羰基峰的吸收频率没有明显变化, 脂质体相变温度和相变焓均随药物摩尔百分比的增大而增大。 纯DPPC脂质体中亚甲基的对称伸缩振动波数为2 848.4 cm-1, 载药后该波数都增大到2 850.3 cm-1。 这些结果表明吴茱萸碱在脂质体中的包封位置具有浓度依赖性: 在0< x<10 mol%浓度范围内, 吴茱萸碱主要作用于DPPC分子的疏水尾链区域, 少部分药物分子作用于DPPC分子的界面区域。 在10 mol%≤ x<20 mol%浓度范围内, 吴茱萸碱分子则主要作用于DPPC分子的头部区域, 少部分药物分子作用于DPPC分子的疏水尾链区。 所有载药脂质体的相变温度均低于纯DPPC脂质体的相变温度, 即不同浓度的吴茱萸碱均可以使脂质体的膜流动性增加, 并且, 当药物摩尔百分比为10 mol%时, 吴茱萸碱对生物膜流动性的增加效应最为明显。 研究工作对于进一步揭示吴茱萸碱与生物膜的相互作用机制具有重要意义。
The study of the interaction between drugs and biomembrane is of great significance to the understanding of the drug efficacy and the improvment of their biological properties. However, the composition of biomembrane is complex, which makes it difficult to study the interaction between active components of drugs and biomembrane directly. We used liposome as mimetic biomembrane, investigated the interaction of evodiamine with liposome, analyzed the entrapment position of evodiamine among liposome, and the possible mechanism of the anti-inflammatory effect of evodiamine was also discussed. 1,2-Dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) has been used as membrane material in this study and liposomes containing different molar percentage of evodiamine ( x) were prepared by thin-film dispersion method. Fourier transform infrared spectroscopy (FTIR) and Differential scanning calorimetry (DSC) were used to analyze the frequency and shape of infrared absorption peaks and the changes of the calorimetric parameters of DPPC molecules with the increasing of the molar percentage of drugs. The entrapment position of the evodiamine in liposome and the effect of this drug on the fluidity of liposome membrane were discussed. Data showed that the frequency of the asymmetric stretching vibration of the phosphate group in the DPPC head region hardly changed in the concentration range of 0< x<10 mol%, but the phase transition temperature and enthalpy of the liposome decreased with increasing x in this concentration range. In the concentration range of 0< x<5 mol%, the absorption wave number of hydrated carbonyl in the DPPC interface region increased from 1 726.0 to 1 731.8 cm-1, however, this wave number decreased to 1 728.0 cm-1 at x=10 mol%. In the concentration range of 10 mol%≤ x<20 mol%, the wave number of asymmetric stretching vibration of phosphate group decreased from 1 242.0 to 1 236.3 cm-1, but the absorption frequency of hydrated carbonyl hardly changed, and the phase transition temperature and enthalpy of liposome increased with increasing x. The wave number of the symmetrical stretching vibration of methylene in pure DPPC liposomes was 2 848.4 cm-1, which increased to 2 850.3 cm-1 after drug loading. These results indicated that the entrapment location of evodiamine in liposomes is concentration-dependent: in the concentration range of 0< x<10 mol%, evodiamine molecules mainly incorporate into the hydrophobic region of DPPC molecules and a few locate at the interfacial region of DPPC molecules. In the range of 10 mol%≤ x<20 mol%, evodiamine molecules mainly incorporate into the hydrophilic head region of the DPPC molecules and a few locate at the hydrophobic tail chain of DPPC molecules. The phase transition temperatures of all drug containing liposomes are lower than those of pure DPPC liposomes. That is to say, the membrane fluidity of the liposomes could be increased by different concentrations of evodiamine. Moreover, at x=10 mol%, the membrane fluidity of liposomes is the largest. This study will play an important role in the further investigation of the interaction mechanism of evodiamine with biomembrane.
吴茱萸碱(Evodiamine, 结构式见图1)是从芸香科植物吴茱萸Euodia rutaecarpa (Juss.) Benth., 石虎Euodia rutaecarpa (Juss.) Benth. var. officinalis (Dode) Huang, 疏毛吴茱萸Euodia rutaecarpa (Juss.) Benth. var. bodinieri (Dode) Huang 的干燥近成熟果实中提取的一种重要生物碱[1]。 现代医学研究表明, 吴茱萸碱具有降血糖、 抗炎、 镇痛、 抗肿瘤等多种药理作用[2, 3, 4]。
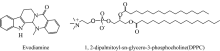 | 图1 吴茱萸碱和二棕榈酰磷脂酰胆碱的分子结构Fig.1 Molecular structure of evodiamine and 1, 2-dipalmitoyl-sn-glycero-3-phosphocholine |
研究药物与生物膜的作用对于进一步了解药效和改善其生物性能具有重要的意义。 由于生物膜具有繁复的组分和复杂的结构, 这一特性使得直接研究药物活性成分与生物膜的相互作用变得相当困难。 研究表明, 脂质体具有与生物膜极其类似的结构, 并能够作为药物的载体用于疾病的治疗。 因此, 现代科学研究常把脂质体作为生物膜的简单化模型, 用于研究药物与生物膜的相互作用。 卢杉杉[5]等采用脂质体作为生物膜模型, 研究了乌头碱与生物膜的相互作用, 揭示了药物在体内的吸收情况。 Nunes[6]等以脂质体模拟生物膜研究了五种非甾体抗炎药对生物膜的扰动作用, 揭示了非甾体抗炎药可能的作用机制。
DPPC (1, 2-dipalmitoyl-sn-glycero-3-phosphocholine, 二棕榈酰磷脂酰胆碱, 结构式见图1)是一种胆碱类磷脂, 为大多数哺乳动物细胞膜的主要成分, 因其相变温度接近于生理温度, 常作为脂质体的膜材被广泛应用[7, 8]。 本实验采用DPPC作为脂质体的膜材, 采用傅立叶变换红外光谱(FTIR)法和差示扫描量热(DSC)法研究吴茱萸碱与脂质体的相互作用, 揭示吴茱萸碱在脂质体中的包封位置与载药浓度之间的关系, 并探讨了吴茱萸碱发生抗炎作用时与生物膜可能的相互作用机制。
二棕榈酰磷脂酰胆碱(DPPC, 美国Sigma公司, 纯度> 99%); 吴茱萸碱(上海源叶生物科技有限公司, 纯度≥ 98%); 其他国产试剂均为分析纯。
傅里叶变换红外光谱仪(美国Thermo-Nicolet公司); DSC3型差示扫描量热仪(瑞士梅特勒-托利多公司); XSE105DU 型电子天平(瑞士梅特勒-托利多公司); RE-52AA型旋转蒸发仪(上海亚荣); DZF6050型真空干燥设备(上海一恒)。
1.3.1 吴茱萸碱脂质体的制备
参照文献[9]制备脂质体: 按计量比例称取DPPC和吴茱萸碱, 溶解于氯仿中, 通过旋转蒸发除去氯仿, 至烧瓶内
壁形成均匀透明的薄膜, 后置于真空干燥箱中过夜以除去残留的有机溶剂。 而后加入超过量的Tris-HCl(pH 7.4)缓冲溶液, 置于65 ℃水浴1 h, 经旋涡混合后室温放置20 min, 如此循环3次, 至体系均匀分散, 得吴茱萸碱摩尔百分比(x)分别为0, 2, 5, 10, 15和20的吴茱萸碱脂质体。 由于用蒸馏水配置的Tris-HCl(pH 7.4)缓冲溶液制备的脂质体在进行红外光谱测定时会对DPPC的羰基吸收峰造成影响, 因此, 本实验采用由重水配置的Tris-HCl(pH 7.4)缓冲溶液制备脂质体进行红外光谱羰基吸收峰的测定。
1.3.2 傅里叶变换红外光谱实验
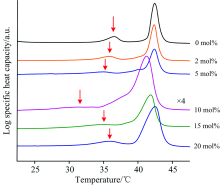
波数范围为4 000~900 cm-1, 扫描次数为64次, 对涂抹在CaF2窗片上的样品进行红外扫描。 实验结果见图2、 图3与表1。
| 表1 不同摩尔百分比的吴茱萸碱脂质体的红外特征吸收带的峰位置 Table 1 The peak-position of infrared characteristic absorption bands for DPPC liposomes containing different molar percentage of evodiamine |
 | 图2 不同摩尔百分比的吴茱萸碱/DPPC脂质体的FTIR吸收光谱Fig.2 FTIR absorption spectra of DPPC liposomes containing different molar percentage of evodiamine |
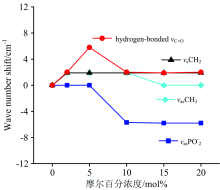 | 图3 DPPC不同基团红外吸收波数的移动值与吴茱萸碱摩尔百分比的关系曲线Fig.3 The relationship between the infrared wave number shift of different group of DPPC and the molar percentage of evodiamine |
1.3.3 差示扫描量热(DSC)实验
采用高灵敏度传感器HSS8+, 实验气氛为N2, 以空白坩埚做参比。 为了保证样品在升温过程中处于相平衡的状态, 选择较低的升温速率1 ℃· min-1。 实验结果见图4、 图5与图6。
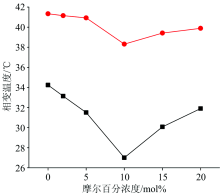 | 图5 脂质体相变温度与吴茱萸碱摩尔百分比的关系图 ●: 主相变; ■: 前相变Fig.5 The relationship between phase transition temperature and molar percent age of evodiamine among liposomes ●: Main phase transition; ■: Pre-transition |
FTIR光谱是在亚分子水平上表征药物与脂质体相互作用的有力手段。 外源分子与磷脂分子的相互作用会引起磷脂官能团红外振动频率的变化。 DPPC分子极性的头部区域、 界面区域和非极性的疏水尾部区域代表性的基团分别为P
磷酸基团的不对称伸缩振动(ν asP
羰基的伸缩振动C═0可用来研究药物对DPPC界面区域的影响[11]。 由于水的红外吸收峰会对羰基吸收峰造成影响, 因此, 采用由重水配置的缓冲溶液制备的脂质体进行红外光谱羰基吸收峰的测定。 在高度水化的脂质体膜中, 羰基的伸缩振动带常分裂为两个峰, 分别为游离的羰基峰(non-hydrogen-bonded C═0和水化的羰基峰(hydrogen-bonded C═0 不同的药物对DPPC的羰基的伸缩振动谱带的影响不同, 在脂质体界面区域, DPPC分子中羰基会与H2O分子形成氢键, 形成水化的羰基峰, 可见位于界面区域的羰基基团, 是一个潜在的氢键形成中心[12]。 由图2和表1可知, 纯DPPC游离的羰基和水化的羰基的伸缩振动带的峰位分别位于1 737.6和1 726.0 cm-1处, 吴茱萸碱的加入对游离的羰基峰未造成明显的影响, 其峰位基本保持不变, 但是却对水化的羰基峰造成了明显的影响。 在0 mol%< x< 5 mol%浓度范围内, 随着药物浓度的增大, 水化的羰基峰的吸收频率增大, 由最初的1 726.0 cm-1处移动到1 731.8 cm-1附近, 波数移动值为5.8 cm-1(波数移动值随药物浓度的变化见图3), 说明在此浓度范围内, 有部分药物进入了DPPC分子的界面区域, 并与界面区域的羰基结合, 使羰基的水化程度减小。 在10 mol%≤ x< 20 mol%范围内, 水化的羰基峰又向低频方向移动, 峰位位于1 728.0 cm-1附近, 说明在此浓度范围内, 吴茱萸碱分子与DPPC界面区域的羰基的结合程度有所降低。 这与前文ν asP
亚甲基的不对称(ν asCH2)和对称伸缩振动(ν sCH2)以及甲基的不对称伸缩振动(ν asCH3)可用来分析吴茱萸碱的加入对DPPC酰基链的影响。 由图2和表1可知, 纯DPPC的ν asCH2, ν sCH2和ν asCH3的峰位分别位于2 917.8, 2 848.4和2 954.5 cm-1处, 与Beré nyi和Kamiń ski等的报道相一致[13, 14]。 各浓度吴茱萸碱的加入使得载药脂质体的ν sCH2谱带的峰位均移动到了2 850.3 cm-1处, 说明各浓度载药脂质体中DPPC的疏水尾链区都有药物分子存在, 这一结论与之后DSC实验结论相一致。 Wu等报道胆碱类磷脂分子疏水尾链混乱度增大将导致ν sCH2吸收谱带的蓝移[15, 16]。 本实验ν sCH2谱带峰位的蓝移, 说明药物的加入使DPPC疏水酰基链的混乱度增大, 进而将导致主相变温度降低, 这一点可由之后DSC实验证实。 虽然吴茱萸碱对ν asCH2谱带峰位的影响较小, 但是却对其谱带的带宽具有明显的影响。 ν asCH2谱带宽度的变化可以间接反映药物分子对生物膜流动性的影响[17]。 在0 mol%< x< 10 mol%浓度范围内, 图2显示ν asCH2谱带明显展宽, 预示着生物膜的流动性增加, 说明在此浓度范围内有药物分子作用于DPPC疏水尾链区; 当x> 10 mol%时, ν asCH2谱带的带宽又开始减小, 说明此时疏水尾链间的药物浓度开始减少, 药物对生物膜的流动性的影响也减弱。 此后DSC实验也可验证这一结论。 药物的加入对ν asCH3谱带位置也有明显的影响。 由图2和表1可知, 在0 mol%< x< 10 mol%浓度范围内, 载药脂质体的ν asCH3谱带的峰位发生了明显的移动, 从最初的2 954.5 cm-1处移动到了2 956.4 cm-1处, 波数移动值为1.9 cm-1(见图3), 说明在此浓度范围内, DPPC的疏水尾链末端区域含有大量的吴茱萸碱分子。 但当x> 10 mol%时, 载药脂质体的ν asCH3谱带的频率又与纯DPPC脂质体的ν asCH3谱带的频率相等, 说明在此浓度范围内DPPC的疏水尾链“ 末端区域” 几乎不再有药物分子。
作为生物膜的模型膜, 脂质体与生物膜一样, 在温度、 pH等外界条件的影响下, 会呈现不同的相态, 如层状凝胶相(Lβ ')、 波动凝胶相(Pβ ')和层状液晶相(Lα )等。 随着温度的升高DPPC脂质体一般会经历两个相变, 分别为前相变和主相变[18, 19]。 在本实验中, 采用DSC曲线的起始温度(onset temperature, 用DSC仪器自带的STARe 软件确定)作为各脂质体的相变温度。 由图4可知, 纯DPPC脂质体在34.2和41.3 ℃, 分别发生了前相变和主相变。
主相变代表着Pβ '相向Lα 相的转变[18], 与DPPC分子中碳氢链的变化有关。
根据图5与图6 主相变温度和主相变焓随浓度的变化可知, 在0 mol%< x< 10 mol%浓度范围内, 主相变温度与主相变焓随着药物浓度的增加均呈现逐渐减小的趋势。 有文献报道药物作用于磷脂分子疏水尾链将减弱疏水尾链之间的相互作用, 使主相变温度和主相变焓下降[7, 18, 20, 21]。 本实验结果说明在0 mol%< x< 10 mol%浓度范围内, 吴茱萸碱分子主要作用于DPPC分子疏水尾链区, 减小了DPPC分子疏水尾链间的相互作用, 使得DPPC分子的疏水尾链变的更加的无序, 致使载药脂质体更易发生主相变, 因而主相变温度和主相变焓均随药物浓度的增大而减小, 这一结论与2.1节红外光谱数据得到的结论一致。
根据图5与图6, 在10 mol%≤ x< 20 mol%浓度范围内, 随着吴茱萸碱药物浓度的增加, 主相变温度与主相变焓均呈增加趋势。 且当x≥ 15 mol%时, 载药脂质体的主相变焓已经明显高于纯DPPC脂质体的主相变焓, 而载药脂质体的主相变温度则始终低于纯DPPC脂质体的主相变温度。 这可能与主相变过程中DPPC头部和疏水尾链区域存在不同步的变化有关: Wu等报道DPPC脂质体的主相变过程是由疏水尾链启动的[15]。 因此主相变温度主要取决于DPPC分子疏水尾链周围的环境[7]。 而主相变焓代表着DPPC分子在主相变过程中尾部和头部分子所吸收的热量的总和, 因此主相变焓与DPPC分子疏水尾链周围的环境和头部基团周围的环境都有关[7]。 前已述及, 药物与DPPC疏水尾链区域结合, 会使得DPPC尾链间的相互作用减小, 从而使主相变焓减少。 由图1可知, 吴茱萸碱的分子结构中含有亚氨基, 可能与DPPC分子头部的活性基团形成氢键, 使DPPC头部区域分子间作用力增大, 从而导致主相变焓增加。 由载药保留脂质体的主相变温度随药物浓度增大而逐渐升高, 却始终低于纯DPPC脂质体的主相变温度这一现象可知, 在此浓度范围内, DPPC的疏水尾链周围一直存在吴茱萸碱, 但是, 随着药物浓度的逐渐增大, 处于DPPC疏水尾链间的药物含量逐渐减少。 由载药脂质体的主相变焓随药物浓度增大而逐渐增加并最终明显高于纯DPPC脂质体的主相变焓这一现象可知, 在此浓度范围内, 有吴茱萸分子进入了DPPC的头部区域, 并与DPPC的头部区域的基团发生了相互作用。 由以上的分析可知, 在10 mol%≤ x< 20 mol%浓度范围内, 随着吴茱萸碱药物浓度的增加, 新增加的药物会进入DPPC的头部区域, 同时位于疏水尾链中的部分药物也有部分向头部转移。 这一结论与前文红外光谱数据得到的结论一致。
前相变是指Lβ '到Pβ '的转变。 通过前相变温度和前相变焓随药物浓度的变化也可得到上述结论。 由图5和图6可知, 在0 mol%< x< 10 mol%浓度范围内, 载药脂质体前相变温度与前相变焓均低于纯DPPC脂质体的前相变温度与前相变焓, 且二者随药物浓度的增加而逐渐减小。 前相变与DPPC分子头部基团的变化密切相关。 前已述及, 吴茱萸碱的亚氨基可能与DPPC分子头部的活性基团形成氢键, 使得脂质体发生前相变时的相变温度和相变焓均增加, 因此在此浓度范围内吴茱萸碱分子不可能大量进入DPPC分子的头部区域。 但当药物作用于DPPC的疏水尾链时, 药物的加入会使得DPPC疏水尾链间的相互作用力减少, 使得疏水尾链变的更加的无序。 DPPC分子作为一个整体, 尾链间的混乱也会对头部基团产生一定的影响, 使得脂质体发生前相变时, 相变温度降低, 相变焓减小。 结合图5和图6数据可知, 在0 mol%< x< 10 mol%的浓度范围内, 吴茱萸碱分子主要进入DPPC分子的疏水尾链区域而不是头部极性区域, 与前文根据主相变量热数据得到的结论一致。 在10 mol%≤ x< 20 mol%浓度范围内, 载药脂质体的前相变温度和前相变焓均随药物浓度的增大呈现逐渐增加的趋势, 因此在该浓度范围内, 吴茱萸碱分子主要进入DPPC分子头部的极性区域, 也与前文根据主相变量热数据得到的结论一致。
生物膜的流动性是其生命活动的重要保证。 在0 mol%< x< 10 mol%浓度范围内, 图2显示ν asCH2谱带明显展宽, 预示着生物膜的流动性增加; 当x> 10 mol%时, ν asCH2谱带的带宽又开始减小, 说明此时药物对生物膜的流动性的影响也减弱。 研究药物对脂质体模拟生物膜相变温度的影响, 也可揭示药物对生物膜流动性的影响[6, 22]。 相变温度越低, 说明生物膜流动性越强。 由图5可知, 随着药物浓度的增加, 载药脂质体的相变温度始终低于纯DPPC脂质体的相变温度, 这说明吴茱萸碱分子可以使生物膜的流动性增加。 同时, 实验数据也表明, 当x=10 mol%时, 载药脂质体的前相变温度和主相变温度均达到最小值, 预示着在此药物浓度下, 吴茱萸碱分子使生物膜流动性增加的程度最大。
吴茱萸碱具有抗炎的药理作用[2], 在炎症反应中, 细胞膜会发生脂质过氧化反应, 造成细胞膜流动性的降低。 Nunes 等的研究表明, 生物膜流动性的增加将使之不易被氧化[23]。 本实验由FTIR和DSC实验结果显示, 吴茱萸碱具有增大生物膜流动性的作用, 并且, 当药物浓度为10 mol%时, 吴茱萸碱对生物膜流动性的增加最为明显。 这一结论将有助于进一步揭示吴茱萸碱的抗炎作用机制。
FTIR和DSC研究表明, 吴茱萸碱在脂质体中的包封位置具有浓度依赖性: 在0 mol%< x< 10 mol%的浓度范围内, 吴茱萸碱主要作用于DPPC分子的疏水尾链区, 少部分药物分子作用于DPPC分子的界面区域。 在10 mol%≤ x< 20 mol%浓度范围内, 吴茱萸碱分子则主要作用于DPPC分子的头部区域, 少部分药物分子作用于DPPC分子的疏水尾链区。 不同浓度的吴茱萸碱与DPPC脂质体相互作用, 可使ν asCH2谱带发生不同程度的展宽, 并均使脂质体的相变温度低于纯DPPC脂质体的相变温度, 即不同浓度的吴茱萸碱均可以使脂质体膜流动性增加, 并且, 当药物浓度为10 mol%时, 吴茱萸碱对脂质体膜的流动性增加最为明显。 本研究对于进一步揭示吴茱萸碱与生物膜的相互作用机制及吴茱萸碱的抗炎作用机制具有重要意义。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|