作者简介: 张 旭, 1993年生, 西北大学光子学与光子技术研究所硕士研究生 E-mail: 13709146215@163.com
发展新型药物检测技术不仅能够杜绝假药对健康和生命的危害, 更可以避免假药对社会道德和商业风气等产生不良影响。 该研究工作, 通过建立逆向空间偏移拉曼光谱(SORS)实验装置, 克服了传统拉曼探测深度有限(约几百微米)的应用瓶颈, 以无损、 非接触的方式, 克服不/半透明容器光学背景对光谱测量结果产生的影响, 实现多种空间偏移量(Δ s)条件下, 样品特征光谱信息检测与分析, 为开发基于逆向SORS技术的新型药物检测方法奠定实验基础。 实验装置搭建过程中, 采用785 nm半导体激光器与WITec UHTS300型拉曼光谱仪构建逆向SORS光谱分析装置。 通过使用准直光束照射锥透镜形成环形激发光斑, 并控制锥透镜与样品之间的距离, 实现Δ s连续可控变化。 利用所搭建的光谱检测装置, 分别测量聚乙烯方瓶(厚度为1.5 mm)和聚四氟乙烯离心管(厚度为4 mm)内对乙酰氨基酚和甲硝唑的拉曼特征光谱。 利用环形光束照射会抑制容器峰强度这一特点, 选取容器拉曼特征峰作为标准峰, 分别对点光斑(Spot)和环形(Ring)光斑测量结果进行归一化处理, 并将其强度相减(Ring-Spot), 得到逆向SORS光谱测量结果。 实验结果表明, 逆向SORS光谱检测方法能够克服表层容器光学背景对测量结果产生的干扰性因素, 真实反映不/半透明容器内样品的分子指纹光谱信息。 在实验测量范围内, 当环形光束半径增大1倍时, 聚乙烯方瓶内对乙酰氨基酚拉曼特征峰强度增大6倍, 而聚四氟乙烯离心管内的甲硝唑各特征峰强度增强1倍。 以上实验结果表明, 逆向SORS技术能够准确检测不/半透明容器内, 或有漫散射介质覆盖的样品深层化学成分的指纹光谱。 通过提高系统信噪比并优化系统结构与功能, 在建立小型化、 集成化检测系统的条件下, 逆向SORS技术可与现有的多种药物检测技术相互补充, 发展成一种快捷、 准确、 操作简便的新型药物检测手段。
The identification of counterfeit medicines has been a serious problem confronted by the contemporary world, particularly for the developing countries. Thus, anti-counterfeit innovations can help find solutions on avoiding the hazards to health and lives, as well as for the harmful effects on social morality and commercial culture. In this work, a modular Inverse Spatially Offset Raman Spectroscopy (Inverse SORS) system was built for overcoming the limitations of traditional Raman spectroscopy whose detection depth is confined to a few hundred micrometers. Besides, it can also effectively avoid the background of the container for realizing the detection and analysis of deep chemical components in a non-destructive and non-intrusive way by using different spatially offset values (Δ s), which will lay the foundation for a simple and efficient method for direct detection of drugs. A 785 nm diode laser and WITec UHTS300 Raman spectrometer were employed to construct Inverse SORS system. During the experiments, a collimated beam passed through an axicon lens to form a ring beam, and its radius was adjusted by controlling the distance between the cone lens and sample. The Raman spectra of paracetamol and metronidazole in polyethylene(PE)bottles (with a 1.5 mm thickness) and polytetrafluoroelene (PTFE) centrifuge tubes (with a 4 mm thickness) were respectively measured by using a built-in spectral detection device. One of the container’s Raman peaks was selected as the reference peak for normalizing and processing acquired results. The featured Raman spectra of drugs were obtained by a scaled subtraction of the two spectra (Ring-Spot). The experimental results showed that the Inverse SORS not only avoided the optical background from the opaque container, but also truly presented the molecular fingerprint information of the sample inside. When the radius of the ring beam doubled its size, the intensity of acquired paracetamol spectra increased by six times, whereas the characteristics of Raman peaks of metronidazole in the PTFE tube increased by 100%. The above results showed that the inverse SORS can accurately detect the fingerprint spectrum of the chemical components inside the opaque/translucent container. Moreover, by optimizing system performance and adopting a variety of data processing methods, inverse SORS technology, which is expected to be a fast, accurate and convenient detection method, will be an indispensable complement to the existing pharmaceutical analysis technologies.
拉曼光谱分析法是一种基于光与物质相互作用发生能量交换, 产生非弹性散射光的光谱分析方法。 通过分析拉曼散射光谱特定成分相对强度以及相对于入射光的频移, 能够获得被测分子体系化学组成信息— — 分子特征拉曼光谱。 拉曼光谱分析技术具有快速、 无损和高灵敏度等特点[1, 2], 已被广泛应用于药物成分检测、 真伪药品识别和药物合成实时监控等研究领域, 特别是在假药筛选工作中具有重要的应用价值[3, 4, 5, 6]。 传统拉曼光谱受到测量深度的限制(只能达到表面以下几百微米的深度)[7], 无法实现用于在不/半透明介质包装内药品的非接触式检测与分析, 严重制约了这一技术在药物筛查中的应用。
空间偏移拉曼光谱技术(spatially offset Raman spectroscopy, SORS)是根据光子迁移理论提出的一种新型光谱技术, 与传统背散射式拉曼光谱技术差别在于, 激发光位置和信号光谱采集位置之间存在距离为Δ s的空间偏移量。 当激光垂直照射到样品表面后, 透射光子在样品内部传输过程中发生侧向散射(瑞利散射与拉曼散射), 其中一部分拉曼散射光子经过样品内部多次散射后到达样品表面, 在与激发光照射位置距离为Δ s处溢出样品表面并被探测接收, 探测到的拉曼信号不仅含有瑞利光谱还携带有样品深层成分光谱信息[8]。 根据光谱激发与探测方式的不同, SORS技术又分为常规SORS(spatially offset Raman spectroscopy, SORS)和逆向SORS(inverse spatially offset Raman spectroscopy, Inverse SORS)[9, 10]。 相比于前者, 尽管逆向SORS光谱探测效率较低, 然而, 通过采用锥透镜实现半径可控的环状激发光斑(Δ s连续变化), 在使用光纤探头提高探测性噪比条件下, 更方便于光学系统的集成与封装[11, 12]。
本研究基于逆向SORS技术原理, 搭建了模块化、 半集成光谱分析装置, 并利用这一装置对不/半透明材料包覆下的对乙酰氨基酚粉末和甲硝唑片进行实验测量, 实现不同空间偏移量条件下样品深层特征光谱信息的检测与分析, 揭示了逆向SORS在药物非接触、 快速、 高灵敏度检测中的应用价值。
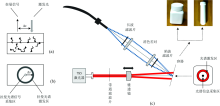
逆向SORS光谱分析装置主要由激发端和光谱采集端两个部分组成, 其结构示意图如图1(c)所示。 在激发模块中, 使用波长785 nm功率连续可调半导体激光器(MDL-Ⅲ -785-lock, 长春新产业), 并配合带通滤波片(LD01-785/10-25, Semrock)选择(785± 5) nm作为激发光波长。 激发光通过光纤耦合并结合光束准直器(F260APC-780, Thorlab), 实现了均匀准直光斑(直径约3.3 mm)输出。 激发光束透过锥透镜(AX255-B, Thorlab)形成环状激发光斑, 通过改变锥透镜到样品之间的距离对激发光斑大小实现精准控制(Δ s连续变化)。 在光谱采集端, 利用消色差双胶合透镜对(MAP105050-B, Thorlab)采集环形光斑中心处的拉曼散射信号, 并作为光纤耦合器, 将采集到的光信息耦合进光谱仪连接光纤(QMMJ-3A3A-IRVIS-100/140-3AS-3, OZ Optics)。 使用一个陷波滤波片(NF785-33, Semrock)与一个长波滤波片(LP02-785RU-25, Semrock), 减少瑞利散射光和其他杂散光对实验结果造成影响。 实验所用到的光谱仪型号为UHTS300(WITec公司), 能够实现具有较高信噪比的光谱信息检测与分析, 实验前, 通过测量标准硅片的拉曼光谱实现波长校准, 并采用标准汞灯对光谱采集强度进行校准。
逆向SORS的关键在于形成环形光束, 可以通过一个锥透镜(折射率n, 角度α , 环形光束光斑宽度r)实现。 如图2所示, 锥透镜的轴对称轴线与入射激光束轴线重叠。 在几何近似下, 半径为r0的平行激光束透射过锥透镜后, 将形成一个半径为rinner的环形光斑。 环半径rinner可以通过改变锥透镜顶端到样品之间的距离D来控制。
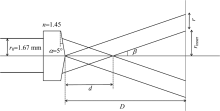 | 图2 利用锥透镜形成半径可调的环形光斑原理图Fig.2 Schematic diagram depicting the principle of forming a ring-shaped laser beam of adjustable radius using an axicon |
根据如图2 所示的参数, 可以计算得出环形光束半径和宽度分别为
实验中使用的样品为石药集团生产的对乙酰氨基酚片, 和金花集团生产的甲硝唑片; 容器分别为聚乙烯半透明方瓶(壁厚约1.5 mm)和聚四氟乙烯离心管(壁厚约4 mm)。 实验测量前, 利用拉曼分析系统(Alpha 500R WITec GmbH), 测量对乙酰氨基酚与甲硝唑样品的特征拉曼光谱信息; 然后, 分别将对乙酰氨基酚粉末放置于聚乙烯方瓶、 甲硝唑片放置于聚四氟乙烯离心管内用于实验测量分析。 测量过程中, 首先, 利用点光斑照射容器表面, 获得容器及其内部样品的光谱信息; 其次, 通过调整锥透镜与容器之间的距离, 实现不同半径环形光斑激发, 测量分析不同Δ s条件下样品光谱信息。
选取500~1 700 cm-1波数范围考察样品光谱特征峰, 并利用5阶多项式拟合与Savitzky-Golay方法去除荧光背景与平滑光谱特征曲线。 然后, 选取容器峰对其进行归一化处理, 将点光斑和环形光斑激发所得到的光谱进行相对强度减法, 获得不/半透明容器内化学药品的拉曼特征光谱。
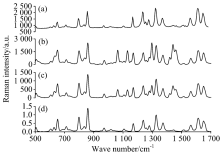
利用逆向SORS对半透明塑料方瓶(壁厚约1.5 mm; 聚乙烯材料)内的对乙酰氨基酚粉末进行分析。 首先, 使用显微拉曼光谱分析系统(Alpha 500R), 测得的对乙酰氨基酚粉末的拉曼特征光谱, 如图3(a)所示。 其光谱信息主要包括, 对乙酰氨基酚分子内部苯环变形振动(653 cm-1), 苯环环伸缩振动(798 cm-1), 对位双取代苯环呼吸振动(860 cm-1), 苯环面内CN伸缩(1 169 cm-1), 对位双取代苯环振动(1 238 cm-1), 酰胺CN伸缩(1 326 cm-1), 苯环简并环伸缩振动(1 613 cm-1), 羰基CO伸缩振动(1 650 cm-1)等分子振动特征。 图3(b)是用点光斑(Δ s=0 mm)检测容器内药品粉末的拉曼光谱信息。 将其与图3(a)进行对比可以看出, 采用单点激发的方式, 测得的拉曼光谱与对乙酰氨基酚特征光谱除了在653, 798, 860, 1 169, 1 238, 1 326, 1 613和1 650 cm-1处有重叠外, 还在1 064, 1 129, 1 297, 1 440和1 460 cm-1附近存在明显的谱峰差异。 这些拉曼峰分别对应于聚乙烯分子内部碳原子间非对称伸缩振动(1 064 cm-1), 碳原子间对称伸缩振动(1 129 cm-1), 碳与氢原子间摇摆振动(1 297 cm-1), 以及碳与氢原子间非对称弯曲振动(1 440和1 460 cm-1)等振动模式[13]。 图3(c)是用环形光束(Δ s=4 mm)照射容器表面, 得到分别含有表层容器和内部样品特征信号峰的拉曼谱图。 将其与图3(b)进行比较后, 可以看出, 由于采用了环形光斑激发, 所测量得到的光谱强度明显降低, 并包含部分容器背景噪声。 选择聚乙烯方瓶1 064 cm-1峰作为标准峰, 分别对点光斑光谱测量结果[spot, 图3(b)]和环形光斑测量结果[ring, 图3(c)]进行归一化处理, 并将其强度进行相减(ring-spot)后, 得到逆向SORS光谱测量结果, 如图3(d)所示。 将图3(a)与图3(d)进行对比, 可以看出逆向SORS光谱测量结果与对乙酰氨基酚标准光谱完全吻合。 这一结果表明, 逆向SORS分析方法能够有效避免容器拉曼光谱特征对光谱测量结果产生的干扰性因素, 真实反映聚乙烯方瓶内对乙酰氨基酚的光谱信息。
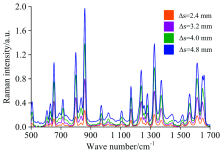
在进一步实验中, 采用四组不同半径环形光束(Δ s=2.4, 3.2, 4.0和4.8 mm)对样品进行光谱激发, 得到了其相应拉曼光谱图, 如图4所示。 由图中的显示结果可以看出, 在最小空间偏移量Δ s=2.4 mm时, 已出现清晰可见的拉曼尖峰; 并且, 在实验测量的范围内, 随着空间偏移量(Δ s)的不断增大, 测得的塑料容器内对乙酰氨基酚的特征峰强度不断增强, 当环形光束半径Δ s由2.4 mm增大至4.8 mm时, 对乙酰氨基酚拉曼特征峰强度均增大6倍。
利用逆向SORS对不透明离心管(壁厚约4 mm; 直径约22 mm; 聚四氟乙烯材料)内的甲硝唑片进行检测分析。 图5(a)是采用显微拉曼光谱分析系统测的的甲硝唑片特征拉曼光谱, 分别体现甲硝唑分子内部CH面外弯曲振动(825 cm-1), 环呼吸(1 182 cm-1), CH变形振动(1 267 cm-1), NO2伸缩振动(1 353 cm-1), 环伸缩(1 376, 1 485 cm-1), CO伸缩振动(1 531 cm-1)等分子振动信息。 图5(b)是用点光斑(Δ s=0 mm)照射容器表面得到的, 包含聚四氟乙烯容器及其内部样品的特征拉曼光谱。 将其与图5(a)进行对比可以看出, 样品表面光谱除与药品光谱在825, 1 182, 1 267, 1 353, 1 376, 1 485和1 531 cm-1处有重叠外, 还在731 cm-1附近存在明显的拉曼峰, 它对应于聚四氟乙烯材料内部碳原子间共振效应[14]。 实验过程中选择容器的731 cm-1拉曼峰作为标准峰, 分别对点光斑光谱测量结果[spot, 图5(b)]和环形光斑测量结果[ring, 图5(c)]进行归一化处理后, 将其强度相减(ring-spot)后, 得到逆向SORS光谱测量结果, 如图5(d)所示。 通过将图5(a)与图5(d)相比较, 可以看出逆向SORS 光谱测量结果与甲硝唑标准光谱完全吻合。
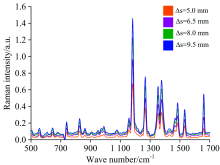
在此基础上, 为了验证Δ s对实验结果的影响, 选取四个不同半径(Δ s=5.0, 6.5, 8.0和9.5 mm)的激发光斑进行光谱检测。 实验结果表明, 在光谱测量范围内, 随着环形光束半径(Δ s)增大, 离心管内甲硝唑的拉曼特征峰信号不断增强(见图6)。 当环形光束半径增大接近1倍时, 甲硝唑各分子指纹峰强度增强1倍。 与对乙酰氨基酚的实验结果对比, 当环形光束半径增大相同倍数时, 甲硝唑拉曼峰强度增幅相较于对乙酰氨基酚拉曼峰强度增幅较小, 这是因为离心管的壁厚远大于聚乙烯方瓶, 并且对乙酰氨基酚是以粉末状填充于容器, 而甲硝唑则是片状放置于离心管中。
通过建立逆向SORS实验装置, 突破了传统背照式拉曼光谱检测技术的应用瓶颈(探测深度局限于几百微米, 不能对非透明介质内深层成分进行分析), 实现了厚度分别为1.5和4 mm容器(聚乙烯方瓶和聚四氟乙烯离心管)内部不同药品成分(对乙酰氨基酚和甲硝唑)的光谱检测与分析。 主要结论如下:
(1)通过建立逆向SORS光谱分析装置, 以无损、 非接触的方式, 有效避免非透明容器光学信息对测量结果产生的干扰因素, 从而实现深层化学成分的检测和分析;
(2)实验分析结果表明, 针对不同容器光谱性质作归一化运算, 可以得到容器内药品的特征拉曼光谱, 并且随着空间偏移量Δ s的不断增大, 所测药品指纹光谱强度不断增强;
(3)采用逆向SORS光谱测量原理, 采用半径可控的环形激发光斑, 更有利于系统集成与小型化。 在此条件下, 通过优化系统结构并采用多种数据处理方法, SORS技术可与现有的多种药物检测技术相互补充, 有望发展成一种快捷、 准确、 操作简便的新型药物检测手段。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|