作者简介: 聂 敏, 1964年生, 西安邮电大学通信与信息工程学院教授 E-mail: niemin@xupt.edu.cn
交通事故、 高空坠落、 重物砸伤等原因, 可能导致人体脊髓损伤(spinal cord injury, SCI)。 SCI中断了人体神经信号的传输信道, 患者大多高位截瘫, 丧失肢体功能, 大小便失禁, 导致终生残疾, 生活异常艰难。 2016年世界卫生组织统计数据显示, 全世界SCI患病率为(258~785人)/百万人口, 每年新发病率为(13.8~86人)/百万人口。 目前全球约有SCI患者600万人, 并且每年新增约60万人。 脊髓损伤一直是医学界的重难点研究课题, 医生和科研人员经过长期的研究与探索, 目前仍未找到有效的治疗方案来修复脊髓损伤后的微环境以及促使损伤神经的再生。 该方法主要针对以下两方面问题: (1) 常规的检测仪器如X射线、 核磁共振MRI检查、 CT等传统仪器只是影像和形态学方面的观察, 不能对脊髓损伤部位的神经细胞进行定位和实时的活性分析, 致使医生和科研人员对患者的病情不能精确把握, 极有可能延误患者病情, 甚至危及患者生命。 (2) 2013年12月, 西安邮电大学量子通信团队提出采用量子中继“搭桥”的方式, 即利用量子纠缠传态在脊髓损伤上断点和下断点建立“连接”, 来实现人体神经信号中继的方法; 并联合西安交通大学医学院进行大鼠和白兔的实验, 取得了突破性进展。 2015年1月16日, 中国科学院再生医学研究团队联合中国武警脑科医院, 结合间充质干细胞, 使用神经细胞再生支架完成世界首例脊髓损伤“搭桥”手术, 并取得了良好的治疗效果。 如何保证“搭桥”是建立在活性神经细胞上, 而不是已经坏死的神经细胞上? 如何找到合适的“桥墩”位置, 使“搭桥”的距离尽可能小以保证神经信号传输的保真度能够尽可能的高? 该文提出的方法可以实现对脊髓损伤后的神经细胞进行精确定位。 光谱分析越来越广泛的被应用在生物医学领域, 对某些疾病的早期发现和无创或微创的高效检测起着至关重要的作用。 神经特异性核蛋白可以用来特异性识别神经细胞, 由于存活的神经细胞才会产生神经递质, 因此, 在动物实验的基础上, 通过蒙特卡洛模型模拟光子在生物组织中的传输, 对平面 Oxy建立极坐标转换, 得出光在生物组织中的衰减系数矩阵的计算方法, 对脊髓损伤前后的相同位置进行近红外光检测, 用聚类算法对神经元特异性核蛋白和神经递质的检测数据进行处理, 通过matlab仿真, 得出脊髓损伤前后衰减系数的二维分布图, 确定 Oxy平面中脊髓损伤部位体素的 X和 Y坐标, 在 Oxy平面的异常部位选取异常点 W与 Z轴建立 Ozw平面, 最终确定脊髓损伤部位神经细胞的位置坐标。 该方法可以为医生和科研人员在脊髓损伤患者肢体功能重建的研究中提供理论依据。
Traffic accidents, falling from high altitude, and bruises caused by heavy objects may cause Spinal Cord Injury (SCI). SCI interrupted the transmission channel of human nerve signal. Most patients had paraplegia, lost their physical function, and had incontinence resulting in permanent disability . According to the statistics of the World Health Organization in 2016, the prevalence of SCI in the world is (258~785) per million people, and the annual incidence rate is (13.8~86) per million people. At present, there are about 6 million patients in the world, and about 600 000 people are newly added every year. SCI has been a difficult research topic in the medical community. After long-term’s research and exploration, doctors and researchers have not found an effective treatment method to repair the micro-environment and promote the regeneration of injured nerve after SCI. The method proposed in this paper focuses on the following aspects: (1) Conventional detection instruments such as X-ray, MRI, CT and others only in imaging and morphological observations, which can not locate the nerve cells in the SCI area and can not analyze the activity in real-time. As a result, doctors and researchers can’t grasp the condition of the patient accurately and it is likely to delay the patient’s condition and even endanger the patient’s life. (2) In December 2013, the quantum communication team of Xi’an University of Posts &Telecommunications proposed the quantum relay “bridge” method, which uses quantum entanglement to establish a “connection” between the upper and the lower break point of SCI to achieve human neural signal relay. And the University together with the Xi’an Jiaotong University completed the experiments on rats and rabbits which have made breakthroughs; on January 16, 2015, the Chinese Academy of Sciences regenerative medicine research team and the Chinese Armed Police Brain Hospital combined with mesenchymal stem cells and used nerves. The Cell Regeneration Scaffold completed the “first bypass” surgery for the first SCI in the world and achieved a good therapeutic effect. How to ensure that the “bridge” is built on the alive nerve cells, not on the died nerve cells? How to find a suitable “bridge pier” position so that the “bridge” distance is as short as possible to ensure that the fidelity of the neural signal transmission can be higher? By the method proposed in this paper, we can find the accurate position of nerve cells after SCI. Spectroscopic analysis techniques are widely used in the biomedical field and play a crucial role in the early detection and have a highly efficient detection in certain diseases. Neuron-specific nuclear protein can be used to specifically identify nerve cells. Since the surviving nerve cells can produce neurotransmitters, this article based on animal experiments, simulates photon transmission in biological tissues through the Monte Carlo model. Establishing a polar coordinate transformation in the plane Oxy, calculating the attenuation coefficient matrix of light in biological tissues, detecting near-infrared light at the same position before and after SCI, the clustering algorithm was used to process the neuron-specific nuclear protein and neurotransmitter detection data. Through matlab simulation, a two-dimensional distribution map of the attenuation coefficient before and after SCI was obtained. The coordinates of the voxels in the spinal cord injury area in Oxy are determined, in the anomalous part of the plane Oxy, the abnormal point W and the Z axis are selected to establish the plane Ozw, and the position coordinates of the nerve cells at the site of the SCI are finally determined. The method proposed in this paper can provide theoretical basis for doctors and researchers in the study of limb function reconstruction in patients with SCI.
随着社会的发展和进步, 车祸、 高空跌落等原因导致脊髓损伤患者的数量呈现大幅增长的趋势, 给患者、 家属乃至整个社会带来无尽的痛苦和沉重的经济负担[1]。 近些年来, 随着医疗技术和科学技术的发展, 对于脊髓损伤的治疗和康复虽然有了显著的进步, 但尚无行之有效的治愈方法[2]。
进入21世纪以来, 光子学越来越广泛的被应用在生物医学领域, 对某些疾病的早期发现和无创或微创的高效检测起着至关重要的作用。 蒙特卡洛方法一直被视为研究光在组织中传输的标准模型。 基于光子学技术、 蒙特卡洛模型, 针对现有检测仪器的不足之处, 我们提出一种脊髓损伤后神经细胞定位的方法。
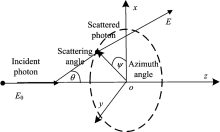
如图1所示, 假设事件光子由坐标系原点垂直进入组织表层。
光子的传输步长[3]
其中, μ a和μ s分别为光在生物组织中的吸收和散射系数, ξ 在(0, 1)中服从均匀分布。 光子的散射方向可以用偏转角θ 和方位角ψ 来表示, 其中ψ =2π ξ 。
可计算出散射后的方向余弦(μ 'x, μ 'y, μ 'z)为
将人体的某一组织视为光子的传输信道, 光子与生物组织相互作用的过程符合扰动方程[4, 5, 6]
其中, H, HM, HR, HN为哈密顿(Hamilton)算符, 分别表示总辐射场、 分子场、 辐射场、 分子场与辐射场的相互作用[7]。 量化辐射场HR的表达式为
其中, akv为湮灭算符,
量En的表达式可写为
其中, nkv为条件(k, v)下的光子数。
光波的Hamilton量会在光通过人体组织时发生相应变化, 由文献[8]将湮灭算符akv更改为
其中,
l为光在组织中的传播距离, η (ω )为介质的反射指数[9, 10], χ a(ω )为组织衰减系数, 为外部场所致的衰减, c为光在组织中的传输速度。 由式(8)和式(10)可知,
则变化后辐射场的Hamilton量H'R
则量化辐射场的总能量变化为E'n
光在经过生物组织前后, 辐射场总能量En和E'n相对变化的程度δ
则衰减系数χ a(ω )为
由式(18)可以知道, 当δ =0时, 表示生物组织正常, 衰减系数随生物组织异常程度的加深而增大。 由于变化的生物组织内部致病物质的特性和含量不同, 导致不同变化程度的生物组织对不同波数的光产生的衰减不同, 因此可以通过衰减系数χ a(ω )和变化程度δ 的关系, 对生物组织的异常情况进行研究。
当近红外光通过脊髓部位时, 可以得到脊髓损伤部位某一断层中, 在一条直线上各体素因为对光产生吸收、 散射等作用而得到在该直线上衰减系数之和的表达式
其中, n为一条直线上包含的体素数目, 直线上所有被检测的体素衰减系数的总和为χ c, E0为初始时刻近红外光波的能量, E为近红外光波在传输距离l后的能量, χ c为第i个体素的衰减系数, 且
其中, χ ai为第i个体素中各种物质对光的吸收产生的衰减系数之和, χ bi为散射的系数之和[11]。
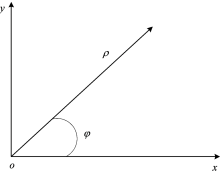
对Oxy平面进行断层扫描, 并进行极坐标转换, 如图2所示。
可以得到χ c与ρ , φ 对应的函数关系。 其中g(ρ , φ )为
其中, ρ 为极径, φ 为极角。 对g(ρ , φ )进行h(ρ )的滤波处理
其中,
由f'(x, y, φ )可以得到扫描断层中各体素衰减系数的关系式f(x, y)
对f'(x, y, φ )进行离散化处理, 可得:
其中, d为极径的取样间隔, Δ φ 为极角的取样间隔, 极径的取样点数为M, 极角的取样点数N。 第i个被扫描到的体素的衰减系数μ i
在扫描断层中由χ i可以构建各体素对近红外光产生衰减系数的二维分布矩阵χ , 最后确定脊髓损伤部位的衰减系数矩阵为
其中, χ b和χ k分别是异常和正常部位的衰减系数矩阵。
实验目的: 检测白兔和大鼠脊髓损伤前后的近红外光谱。
实验方法: 选取成年健康白兔5只, 体重范围1 300~1 500 g; 健康的成年大鼠5只, 体重范围320~380 g。 5只大鼠和5只白兔分设为A和B组, 并且A, B组中都各自含有实验组和对照组。 实验组为将正常的5只大鼠和白兔在测量位置人为切断, 实验动物的提供以及脊髓损伤模型的建立, 均由西安交通大学动物实验中心完成。
测量脊髓损伤模型建立位置: A组为胸椎T7— T8位, B组为胸椎T9— T10位。
实验仪器: 计算机, Anritsu红外光谱仪。
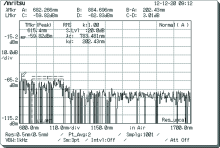
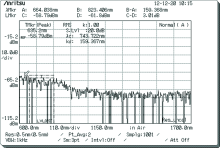
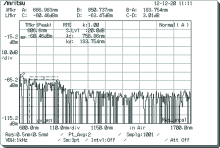
以随机选取A组中某一大鼠的测量结果为例, 如图3和图4, 其中图3为该大鼠对照组检测结果, 图4为实验组检测结果。
由图3和图4可以看出, 该大鼠脊髓损伤后与健康时相对比, 由于损伤处脊髓中物质有所减少, 因此所检测位置光谱图的部分区域有明显的消失或减弱。
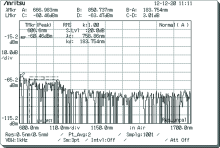
随机选取B组中某一白兔的测量结果, 如图5和图6, 其中图5为该白兔对照组检测结果, 图6为实验组检测结果。
由图5和图6可以看出, 该白兔脊髓损伤后与健康时相对比, 由于损伤处脊髓中物质有所减少, 因此所检测位置光谱图的部分区域有明显的消失或减弱。 综合图3和图4与图5和图6看出, 由于动物种类以及损伤程度不同, 测量结果也有差异, 表明脊髓损伤后光谱测量结果具有唯一性。
以动物实验中所选大鼠为例, 扫描区域相同, 对Oxy平面中的衰减系数进行仿真并说明。
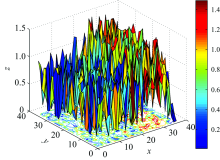
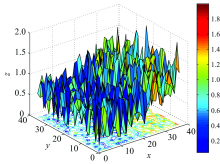
图7是在脊髓损伤前的衰减系数分布, X轴表示体素在扫描断层中的横坐标, Y轴表示体素在扫描断层中的纵坐标, Z轴表示在断层平面上体素的衰减系数值。
图8为脊髓损伤后的衰减系数分布, X轴表示体素在扫描断层中的横坐标, Y轴表示体素在扫描断层中的纵坐标, Z轴表示在断层平面上体素的衰减系数值。
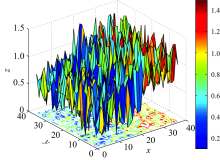 | 图8 实验组大鼠Oxy平面的衰减系数分布Fig.8 Oxy plane attenuation coefficient distribution of rat in experimental group |
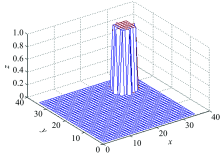
由式(24)计算出脊髓损伤后的衰减系数矩阵χ b, 如图9所示, 其中突出位置为大鼠脊髓损伤部位在断层中的精确位置, 由此确定Oxy平面脊髓损伤部位的X和Y坐标。 在确定平面Oxy的脊髓损伤位置后, 选取一个异常点W与对应衰减系数建立Ozw平面, 求出Ozw平面的脊髓损伤部位衰减系数矩阵的二维分布, 由此确定Z坐标的值。 图10即为Ozw平面的衰减系数仿真。
 | 图10 实验组大鼠Ozw平面的衰减系数分布Fig.10 Ozw plane attenuation coefficient distribution of rat in experimental group |
由图11, 通过Ozw平面的脊髓损伤部位衰减系数分布可以确定Z坐标的值, 从而可确定脊髓损伤部位体素的X, Y和Z的坐标值, 从而确定脊髓损伤部位神经细胞的坐标位置。
为了对SCI后神经细胞进行定位, 将蒙特卡洛模型和近红外光谱的特性运用到损伤处微环境的分析中, 对SCI处建立数学模型并对实验数据进行处理及仿真, 实现对神经细胞的定位。 为临床医学提供一种神经细胞定位的方法。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|