作者简介: 李 硕, 女, 1988年生, 吉林大学物理学院工程师, 吉林大学分子酶学工程教育部重点实验室博士后e-mail: lishuo10013@jlu.edu.cn
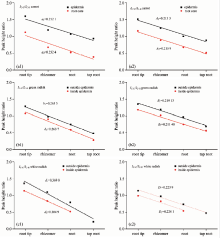
β-胡萝卜素广泛存在于植物体中, 是典型的线性多稀分子, 具有重要的生物功能。 由于β-胡萝卜素是碳碳单、 双键(C—C, C=C)交替的短链共轭多稀分子, 含有大量离域的π电子, 具有重要的光电特性。 根据Andreas等对拉曼散射强度的研究, 当激发光波长落在分子的电子吸收带时, 会产生共振拉曼效应, 能使拉曼光谱强度提高106倍。 利用共振拉曼光谱技术, 测量了β胡萝卜素分子及胡萝卜、 青萝卜、 白萝卜肉质直根不同部位其拉曼光谱, 发现含β-胡萝卜素较高的胡萝卜的拉曼光谱与β-胡萝卜素的吻合很好。 Gellerman等研究表明, 样品浓度与拉曼峰强成正比关系, 从拉曼光谱中容易发现三种萝卜的光谱强度纵向根头到主根及横向表皮到根芯逐渐降低, 且青萝卜和白萝卜拉曼光谱强度都很低, 并在碳碳单键的振动峰处发生峰劈裂。 分别计算了碳碳单键和碳碳双键与碳氢键拉曼强度比, 三种萝卜的 IC=C / IC—H随着测量部位(横向和纵向)的不同变化幅度接近: 胡萝卜的表皮和根芯纵向的变化率分别为 A1=0.213 3和 A2=0.215 9, 青萝卜表皮外和里的变化率分别为 B1=0.219 1和 B2=0.211 4, 白萝卜表皮外和里分别为 D1=0.223 9和 D2=0.224 1; 而对于 IC—C/ IC—H随着测量部位不同其变化率相差很大: 胡萝卜的变化率 a1=0.212 1和 a2=0.232 4, 青萝卜的变化率 b1=0.263 5和 b2=0.268 7, 白萝卜的变化率 d1=0.369 0和 d2=0.304 9。 对比发现三种萝卜的碳碳单键与碳氢键振动强度比随着测量部位的不同变化幅度相差很大, 而从碳碳双键与碳氢键振动强度比发现三种萝卜中不同部位的β胡萝卜含量有相似的分布。 这是由于青萝卜和白萝卜中β-胡萝卜素的含量少, 随着测量部位的不同C—C伸缩振动峰发生峰劈裂, 即在1 130和1 156 cm-1处出现两个振动峰, 经过计算和分析这两个峰都属于碳碳单键的伸缩振动峰, 且随着β-胡萝卜素含量的减少C—C整体的强度降低, 劈裂的新峰峰强度却有增加的趋势, 这使得原峰位的峰强度大幅度降低, 这与计算 IC—C/ IC—H的结果一致, 不同品种的萝卜中β-胡萝卜素含量随测量部位的不同变化幅度截然不同。 因此, 当样品中β-胡萝卜含量较少时, 利用C=C振动峰峰强度同时分析样品不同部位的β-胡萝卜素含量分布变化会更准确。 同时, 研究和了解萝卜中不同部位β-胡萝卜素的含量为日常消费和膳食营养提供了很好的理论依据。
The β-carotene, with carbon-carbon single and double bonds (C—C, C=C )is a typical linear polyenes, which widely exists in plants and has important biological function and plays an important role in investigating the π-electron conjugated properties. According to the Andreas’s study, when the exciting wavelength falls in electron absorption band, it will produce the resonance Raman effect and the Raman intensity can enhance 106 times. The Raman spectra of different parts of the carrot, white radish and green radish and the β-carotene are measured by using the resonance Raman spectroscopy, finding that the Raman spectra of carrot match well with β-carotene due to a high β-carotene content in carrots. Studies from Gellerman et al. show that the sample concentration is directly proportional to Raman peak intensity, which is clearly seen from the β-carotene Raman spectrum: the Raman intensity of three kinds of radish vertical root head to taproot and lateral skin to core gradually decrease, and the Raman intensity of C—C of the green and white radishes are lower and occur peak splitting. Calculating to intensity ratio of carbon-carbon single and double bonds to the carbon-hydrogen (C—H), the variation rates of IC=C / IC—H of different measuring parts (horizontal and vertical) of three kind radish are close: the rates of change of epidermis and root core of carrot are A1=0.213 3 and A2=0.215 9, and the outside and inside of green radish are B1=0.219 1 and B2=0.211 4, and the outside and inside of white radish are D1=0.223 9 and D2=0.224 1; However, variation rates of IC—C/ IC—H with the different measuring parts are greatly different: the carrot are a1=0.212 1 and a2=0.232 4, and the green radish are b1=0.263 5 and b2=0.268 7, and the white radish are d1=0.369 0 and d2=0.304 9. It is found that Raman intensity ratios of C—C to the C—H of three kinds with the different parts are greatly different, but the ratios of C=C to C—H has similar distribution. This is due to the low levels of β-carotene in green and white radishes, the vibrational peak of C—C occurs peak splitting, namely, two vibrational peaks appear at 1 130 and 1 156 cm-1. As the amount of β-carotene decrease, the intensity of C—C peak reduces, and the intensity of new peak is induce, making the peak intensity of the original peak greatly reduce. This is consistent with the results of IC—C/ IC—H. Therefore, using the Raman intensity of C=C to analyze the β-carotene content of different parts is more accurately. Furthermore, studies of the content of the β-carotene in different parts of radish can help to provide a good theoretical basis for daily consumption and dietary nutrition.
类胡萝卜素是一类碳氢化合物及其氧化衍生物, 广泛存在于植物体中, 是形成人体必需的维生素A重要来源, 其中以β -胡萝卜素最为典型。 在医学上, β -胡萝卜素能增加人体的免疫力[1], 具有氧化性可以清除自由基, 并且人体血清中β -胡萝卜素的含量与前列腺癌、 肺癌和胃癌等的发病率呈负相关[2]; β -胡萝卜素是碳碳单、 双键(C— C、 C=C)交替的短链共轭多稀分子, 含有大量离域的π 电子, 它具有重要的光电特性和生物功能。
萝卜中含有丰富的维生素、 酚类物质和膳食纤维等成分。 近年来对其营养品质及保健价值的研究已有很多, 但多集中于对其根肉的研究, 且方法繁琐[3]。 本工作利用共振拉曼光谱技术, 对胡萝卜、 青萝卜及白萝卜不同食用部位进行横纵在体测量, 以全面了解其营养价值, 测量手段简便。
当激发光波长恰好落在分子的电子吸收带内时, 会产生共振拉曼效应, 能使自发拉曼光谱强度提高106倍[4]。 采用514.5 nm激发光在体测量了胡萝卜、 青萝卜及白萝卜中β -胡萝卜素的共振拉曼光谱。 通过比较实验结果发现, 胡萝卜素含量都有相似的分布, 根据肉质直根的定位分析, 三个品种从根头到主根, 从根皮到根芯, β -胡萝卜素含量均呈递减趋势, 这对解释萝卜从幼苗发育成肉质直根过程细胞中β -胡萝卜素含量的变化有重要意义, 分析植物体中促进β -胡萝卜素合成的有关因素, 且果实颜色与β -胡萝卜素的含量密切相关。 本工作为在体分析水果和蔬菜中β -胡萝卜素含量提供了方法和依据, 为人们日常消费和膳食营养提供了很好的理论依据, 并且通过计算特征峰拉曼强度比, 得到利用拉曼光谱中C=C的特征峰强度去分析样品, 可以得到不同样品不同部位的β -胡萝卜素的相对含量。
当入射的激发光落在样品的吸收带内, 电子跃迁和共振态相耦合就会发生共振拉曼效应, 这使某些拉曼带的强度大幅度增加。 Andreas通过对拉曼散射强度的研究, 得到分子某一振动的拉曼光谱强度与极化率成正比[5]。
式(1)中, α ρ , σ 为散射光张量的ρ 和σ 分量, (α ρ , σ )mn为m向n跃迁的极化张量的第ρ 和σ 矩阵元。 当入射光频率ν 0趋近于ν γ m时, 强度Imn会大幅度增加。 实验研究结果也证明, 共振拉曼效应可以使拉曼强度提高106倍, 因而, 应用该技术探测研究蔬菜中生物分子是简单有效的。
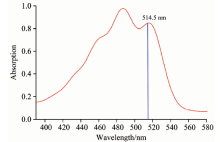
β -胡萝卜素吸收光谱跃迁的主要吸收带是π — π * 跃迁, 如图1所示, β -胡萝卜素吸收光谱在波长范围370580 nm内有很宽的电子吸收带。 使用波长为514.5 nm的激发光, 恰好落在吸收带范围内, 因此能够产生严格的共振拉曼效应。
采用的萝卜样品种类包括胡萝卜、 青萝卜、 白萝卜。 实验前将所有样品用去离子水洗净后, 分别在萝卜肉质直根样品的根头、 根颈、 根体、 和主根处切取1 cm厚度的样品切片, 依次测量。 可见吸收光谱由TU-1901双光束光谱仪测量; 拉曼光谱由Renishaw InVia型共聚焦氩离子激光器的拉曼光谱仪测量。 激发光波长为514.5 nm, 功率4.3 mW, 积分时间20 s, 分辨率为1 cm-1。
图2为胡萝卜、 青萝卜和白萝卜根头部果皮处与β -胡萝卜素粉末的共振拉曼光谱。 1 005~1 020 cm-1范围属于碳氢键(C— H)的平面摇摆振动峰, 1 130~1 172 cm-1范围属于碳碳单键(C— C)的伸缩振动峰, 1 511~1 520 cm-1范围属于碳碳单键C=C的伸缩振动峰, 2 670 cm-1附近处属于碳碳单键和双键振动的和频峰, 2 310和3 040 cm-1附近处分别属于碳碳单键和双键的倍频峰[6]。 从图2比较发现, 由于萝卜中含有大量的β -胡萝卜素, 因此, 三种萝卜样品的拉曼光谱与β -胡萝卜素粉末的基频拉曼峰趋于一致, 且由于胡萝卜中的β -胡萝卜素含量较高, 其拉曼光谱的和频与倍频峰吻合也较好。
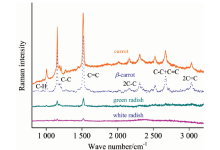 | 图2 β -胡萝卜素, 胡萝卜, 青萝卜和白萝卜的共振拉曼光谱Fig.2 Resonance Raman Spectra of β -carotene, carrot, green radish and white radish |
图3为胡萝卜纵向的跟头、 根茎、 根体和主根四个部位及横向从表皮到根芯的拉曼光谱图, 用origin软件扣除了荧光背景。 根据Gellerman[7]等研究表明, 样品浓度与拉曼峰强是成正比关系
式(2)中I514为共振拉曼光谱强度, P514为514.5 nm的激发光功率, N为β -胡萝卜素的浓度, σ 为514.5 nm激发光激发时的拉曼散射截面。 从式(2)中看出β -胡萝卜素的浓度与拉曼峰强度成正比关系, 即拉曼峰越强, 其浓度越高。 从图3中β 胡萝卜素C— C和C=C两个特征峰的拉曼光谱很明显看到, 纵向由根头向主根, 横向由表皮到根芯β -胡萝卜素的含量都呈递减的趋势, 且主根部的含量明显减少。 我们以β -胡萝卜素C=C拉曼光谱强度表示其含量, 将图3光谱图中1 520 cm-1拉曼光谱强度列于表1中。
 | 图3 胡萝卜不同部位的拉曼光谱 (a): 根头和根茎; (b): 根体和主根Fig.3 Raman spectra of the different parts of carrot (a): Root tip and rhizome; (b): Root and tap root |
| 表1 胡萝卜不同部位C=C双键(1 520 cm-1)的拉曼强度 Table 1 The Raman intensity of C=C bond (1 520 cm-1) of the carrot in different parts |
图4和图5分别为青萝卜和白萝卜表皮的拉曼光谱图, 实验中只在表皮观测到了β -胡萝卜素的峰, 表皮层中径向取两点进行测量, 表皮外侧的拉曼强度高于表皮内侧, β -胡萝卜素含量纵向变化趋势与胡萝卜相同, 且青萝卜的拉曼光谱强度高于白萝卜。
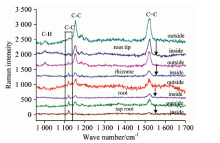 | 图4 绿萝卜不同部位的拉曼光谱 横向: 表皮→ 根芯; 纵向: 根头→ 主根Fig.4 Raman spectra of the different parts of green radish landscape: outside epidermis→ inside epidermis; portrait: root tip→ tap root |
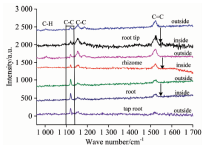 | 图5 白萝卜不同部位的拉曼光谱 横向: 表皮→ 根芯; 纵向: 根头→ 主根Fig.5 Raman spectra of the different parts of white radish landscape: outside epidermis→ inside epidermis; portrait: root tip→ tap root |
据萝卜幼苗发育成肉质直根的定位分析, 根头部对应着幼苗的上胚轴苗区, 其他部位对应下胚轴根区。 在幼叶阶段, 类胡萝卜素吸收、 传递光能到中心色素分子, 保护叶绿素不被光氧化破坏, 同样β -胡萝卜素的合成途径中基因的表达也受光的调控[8]。 实验表明三个品种萝卜根头部β -胡萝卜素的含量最高, 向主根呈递减趋势。 上胚轴在阳光照射下合成β -胡萝卜素, 而下胚轴不能接收到阳光, 只能通过上胚轴向下传递的激素(例如乙烯)诱导合成β -胡萝卜素的基因表达, 所以越靠近主根, 相关激素含量越低, β -胡萝卜素含量也较少。
青萝卜和白萝卜中的β -胡萝卜素含量少于胡萝卜中, 从拉曼光谱中很难测得C— C和C=C的和频峰和基频峰, 因此, 从图3, 图4和图5三种萝卜基频波段的拉曼光谱分析, 获得三种萝卜拉曼光谱中的特征峰散射强度随着测量部位的不同而不同, 并且从图4和图5中发现C— C特征峰随着测量部位(纵向和横向)的改变发生峰劈裂。 1 005~1 020 cm-1范围内的特征峰属于β -胡萝卜素分子碳氢键的平面摇摆振动峰, 因此随着测量部位的不同改变相对很小。 IC— H, IC— C和I C=C分别为位于1 005, 1 156和1 520 cm-1附近。 通过计算三种萝卜横向和纵向三个特征峰峰高的比值IC— C/IC— H和I C=C /IC— H, 得到三种萝卜的I C=C /IC— H随着测量部位的不同变化幅度几乎相同, 即胡萝卜的表皮和根芯的变化率分别为A1=0.213 3和A2=0.215 9, 青萝卜表皮外和里的变化率分别为B1=0.219 1和B2=0.211 4, 白萝卜表皮外和里分别为D1=0.223 9和D2=0.224 1, 而对于IC— C/IC— H随着测量部位不同的变化率相差很大: 白萝卜最大d1=0.369 0, d2=0.304 9, 胡萝卜的变化率最小a1=0.212 1, a2=0.232 4(如图6)。 在青萝卜和白萝卜中β -胡萝卜素的含量逐渐减少, 1 130~1 172 cm-1范围C— C的伸缩振动峰发生峰劈裂, 即在1 130和1 156 cm-1处出现两个振动峰, 经过计算和分析这两个峰都属于碳碳单键的伸缩振动峰[9], 且随着β -胡萝卜素含量的减少C— C振动峰整体的强度降低, 1 130 cm-1处的峰强度却有增加的趋势, 这使得1 156 cm-1处的峰降低幅度很大, 这与所计算IC— C/IC— H的结果一致, 不同品种的萝卜中β -胡萝卜素含量随测量部位的不同变化幅度截然不同。 因此, 当样品中β -胡萝卜含量较少时, 利用C=C振动峰峰强度同时分析样品不同部位的β -胡萝卜素含量分布变化会更准确。
用514.5 nm的激发光可以在体激发不同萝卜品种不同部位β -胡萝卜素的共振拉曼光谱, 样品中β -胡萝卜素的浓度与拉曼强度成正比, 计算三种萝卜的碳碳单键和双键分别与碳氢键振动强度比, 获得三种萝卜不同部位的碳碳双键与碳氢键振动强度比β 胡萝卜含量有相似的分布。 这是由于随着测量部位的改变, 青萝卜和白萝卜碳碳单键振动峰劈裂, 导致原峰和劈裂峰强度有相反的变化趋势。 因此, 当样品中β -胡萝卜含量较少时, 用碳碳双键拉曼强度研究其样品β -胡萝卜素不同部位浓度分布比用碳碳单键更精准。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|