作者简介: 佟丽莹, 女, 1993年生, 宁波大学理学院微电子科学与工程系硕士研究生 e-mail: vivien_tong@163.com
高品质贵金属纳米结构基底的制备是应用表面增强拉曼散射(SERS)技术进行高灵敏生物检测的关键。 采用改进的Langmuir-Blodgett方法, 通过在金纳米杆(Au NRs)溶胶注入乙醇, 使得Au NRs迁移至溶胶与甲苯的交界面, 并用聚甲基丙烯酸甲酯(PMMA)固定交界面处的Au NRs, 形成大面积分布、 均匀致密排列的二维畴状Au NRs/PMMA纳米结构薄膜基底。 然后, 采用等离子体清洗技术处理制备的基底, 使得金纳米杆(Au NRs)的表面裸露, 以增强基底的SERS特性。 实验表明, Au NRs/PMMA基底具有优良的SERS特性, 在785 nm波长的激光照射下, 增强因子可以达到5.49×106。 此外, 利用制备的Au NRs/PMMA基底, 开展前列腺癌症肿瘤标志物——前列腺特异性抗原(PSA)的高灵敏无标记定量检测研究。 在PSA的无标记检测过程中, 首先对PSA标准溶液和新生牛血清进行SERS光谱的直接检测, 得到PSA分别位于823, 1 080, 1 385, 1 586和1 640 cm-1处的主要的拉曼特征峰; 其次, 通过对PSA标准溶液、 临床男性血清样本及女性血清样本的SERS光谱进行测量和分析, 筛选出在PSA的SERS光谱中与血清中PSA含量相关的拉曼特征峰, 它们是分别位于649, 680以及1 640 cm-1处的拉曼特征峰。 进一步, 通过对与PSA同属糖蛋白的肿瘤标志物甲胎蛋白(AFP)以及与PSA同源的人腺体激肽释放酶2(hK2)进行SERS光谱检测和分析, 发现位于1 640 cm-1处的拉曼特征峰对于PSA具有高的特异性, 将其作为临床血清样本中PSA无标记定量检测的具有特异性的拉曼特征峰, 并以此为依据, 对不同PSA浓度的标准溶液进行检测, 得到位于1 640 cm-1处的拉曼特征峰强度与PSA样本溶液中PSA的浓度相关的剂量-响应曲线。 最后, 开展临床血清样本的应用检测。 结果表明, 基于Au NRs/PMMA基底的SERS检测结果与化学发光免疫分析(CLIA)方法的检测结果一致, 且具有比CLIA更高的检测灵敏度, 最低检测极限为0.06 ng·mL-1, 且无标记检测范围为0.1 mg·mL-1~0.1 ng·mL-1。 因此, 基于Au NRs/PMMA SERS基底的高灵敏肿瘤标志物无标记检测具有重要应用前景。
Preparation of high-quality noble nanostructure substrate is vital for the application of surface-enhanced Raman scattering (SERS) technology in ultrasensitive bioassay. In our work, based on the improved Langmuir-Blodgett method, the gold nanorods were extracted from colloid to the interface between the colloid and toluene with the help of ethanol, and fixed by polymethyl methacrylate (PMMA), then a uniform and dense array of two-dimensional domain-like nanostructure was formed in a large area. Next, the plasma clean technology was used to treat the fabricated substrate for enhancing its SERS performance due to the exposed surface of the Au NRs. The experimental results showed that the Au NRs/PMMA substrate exhibited the excellent SERS characteristic and its enhancement factor (EF) achieved 5.49×106 under irradiating of 785 nm laser. In addition, the highly sensitive label-free quantitative detection of tumor maker, prostate specific antigen (PSA), was developed by using Au NRs/PMMA substrate. In the experiments of label-free detection, the Raman characteristic peaks of the PSA were first acquired by comparing the SERS spectra of the PSA standard solution and new-born battle serum solution, and they were mainly located at 823, 1 080, 1 385, 1 586 and 1 640 cm-1. Following, the SERS spectra of PSA standard solution, clinical male serum samples and female serum samples were measured and analyzed to screen the Raman characteristic peaks of PSA associated only with serum PSA levels, and they were located at 649, 680 and 1 640 cm-1. Furthermore, the SERS spectra of α-fetoprotein (AFP) belonging to the glycoprotein same with PSA and human kallikrein 2 (hK2) homologous with PSA were separately measured as two controls, and the extremely specific Raman characteristic peaks of PSA located at 1640 cm-1 were determined and applied in the detection of clinic serum samples. Subsequently, the does-repose curve was obtained by the relationship of the intensities of the Raman peaks at 1640 cm-1 and the PSA concentrations in the standard solutions. Lastly, the PSA concentrations in the clinical serum samples were detected based on the SERS-based label-free detect proposal. It demonstrated that SERS-based label-free detection not only exhibits a well consistency of test data when compared with that of the chemiluminescent immunoassay (CLIA), but also higher sensitivity, and its limit of detection as low as 0.06 ng·mL-1 in the range of 0.1 mg·mL-1~0.1 ng·mL-1. Therefore, it reveals that the proposed protocol has a significant application potential for the quantitative detection of tumor marker.
由于老龄化程度的加剧以及环境和生活习惯的改变, 癌症的病发率和致死率在逐年增长, 严重威胁人类健康。 根据2017年2月国家癌症中心发布的数据, 我国2013年新发恶性肿瘤病例368.2万例, 死亡病例222.9万例, 形势十分严峻[1]。 随着生命科学和医疗技术的进步, 癌症已非不治之症, 通过早期诊断和治疗, 那些预后性好的癌症如前列腺癌和乳腺癌, 具有极高的生存率[2]。 然而, 由于大多数患者处于癌症早期时, 往往没有明显的临床症状, 影像学检查不明显, 当得到临床确诊时, 患者已处于癌症的中晚期, 治疗成功率低。 因此, 癌症的早期检测、 诊断和治疗成为提高癌症患者生存率的关键。 多年来, 经过人们的不懈努力, 在肿瘤诊断检测方面, 已经取得巨大的进展, 一批高技术手段已获得临床应用, 如酶联免疫测定(senzyme-linked immunosorbent assay, ELISA), 放射免疫测定(radioimmunossay, RIA), 化学发光免疫分析法(chemiluminescence enzyme immunoassay, CLIA)等, 但是这些检测过程需要昂贵的仪器, 操作复杂, 开展高通量的快速检测受到限制[3, 4, 5]。
表面增强拉曼散射(surface-enhanced Raman scattering, SERS)作为一种无损和超灵敏的光谱分析技术, 可以极大增强位于贵金属纳米结构表面或附近目标分子的拉曼信号, 已被广泛应用于环境监测, 化学分析和生物传感等领域[6, 7]。 贵金属纳米结构独特的SERS增强特性主要归因于局域表面等离子体共振(localized surface plasmon resonance, LSPR)引起的电磁场增强, 从而利用SERS基底开展肿瘤标志物检测具有极大的优势[8, 9, 10]。 目前, 基于SERS技术的肿瘤标志物检测主要分为两类: 间接检测和直接检测, 即有标记检测与无标记检测[11, 12]。 间接检测一般是通过化学键合作用或者生物的特异性结合将待测分子与拉曼分子标记的贵金属纳米粒子链接, 通过测量标记分子的SERS光谱强度间接表征待测物的含量。 虽然拉曼标记分子的SERS效应显著, 其呈现的特征拉曼峰的宽度窄、 强度大, 因而检测灵敏度高, 但是间接检测也有一些难以避免的缺点, 如探针容易团聚所造成的定量检测误差。 相对于间接检测而言, 无标记检测的优势在于无需借助拉曼标记分子, 仅通过高品质SERS基底直接获得肿瘤标志物的SERS即可进行成分和含量分析, 从而成为肿瘤标志物分子结构分析和定量检测的重要手段。 例如, 李绍新等将前列腺特异性抗原(prostate-specific antigen, PSA)溶液与银纳米粒子胶体按照1∶ 1的体积比配制后进行SERS检测, 并采用多元统计方法处理SERS数据, 成功地分析了健康人与前列腺癌患者血清中PSA的SERS特征[13]。 Chaloupková 等制备了二型谷氨酸羧肽酶抑制剂(Glutamate carboxypeptidase Ⅱ inhibitor, Anti-GCPⅡ )修饰的Fe3O4@Anti-GCPⅡ @Ag纳米粒子, 通过前列腺特异性膜抗原(Glutamate carboxypeptidase Ⅱ , GCPⅡ )与Anti-GCPⅡ 抗体特异性结合, 直接检测GCPⅡ 的SERS信号, 其检测极限低至0.48 ng· mL-1 [14]。 由于肿瘤标志物的拉曼信号非常微弱, 需要借助贵金属纳米结构获得较强的SERS, 才能得到有效的检测结果。 因此, 制备出性能良好的SERS基底是开展肿瘤标志物的无标记检测研究的关键。
本研究采用改进的Langmuir-Blodgett方法[15]和等离子体清洗技术制备出大面积的金纳米杆/聚甲基丙烯酸甲酯(Au NRs/PMMA)基底, 开展PSA的无标记检测研究, 并应用于临床血清样本的定量检测, 具有极高的灵敏度。
紫外可见光分光光度计(LAMBDA 950, PerkinElmer); 便携式拉曼光谱仪(BWS415, B& WTek Inc.); 场发射扫描电子显微镜(SU-70, Hitachi); 台式高速冷冻离心机(TGL-20M, 上海卢湘仪离心机仪器有限公司); 等离子清洗机(ZEPTO, Diener); 超声波清洗机(KS-120EI, 宁波海曙科生超声设备有限公司); 磁力搅拌器(ZNCL-GS, 河南爱博特科技发展有限公司)。
氯金酸(HAuCl4· 3H2O, ≥ 99.9%)、 硼氢化钠(NaBH4)、 硝酸银(AgNO3)、 对巯基苯甲酸(4-MBA)、 聚甲基丙烯酸甲酯(PMMA)购于Sigma Aldrich公司; 十六烷基三甲基溴化铵(CTAB)、 油酸钠(NaOl)购于阿拉丁试剂有限公司; 抗坏血酸(AA)购于天津博迪化工股份有限公司; 无水乙醇(C2H6O, 99.5%)购于国药集团化学试剂有限公司; 前列腺特异性抗原(PSA)标准溶液(0.1 mg· mL-1)、 甲胎蛋白(alpha fetoprotein, AFP)标准溶液(0.1 mg· mL-1)及抗原稀释液(新生牛血清)购于北京科跃中楷生物技术有限公司; 人腺体激肽释放酶2(human glandular kalli-krein-2, hK2)标准溶液(1 mg· mL-1)购于Abcam公司; 甲苯(C6H5CH3, ≥ 99.5%)购于杭州高晶精细化工有限公司; 盐酸(HCl, 36%)购于浙江中星化工试剂有限公司; 女性和男性血清样本采集自宁波大学医学院附属医院。
1.2.1 金纳米杆的制备
采用Joshua晶种法制备Gold nanorods, Au NRs[16], 具体步骤如下: (1)将HAuCl4溶液(0.5 mmol· L-1, 5 mL)和CTAB溶液(0.2 mol· L-1, 5 mL)振荡混合后, 迅速加入600 μ L浓度为0.1 mol· L-1冰浴的NaBH4, 静置2 h即得到金种溶液; (2)将各为2.5 mL的CTAB(0.1 mol· L-1)和NaOl(0.4 mmol· L-1)溶液搅拌混合并加热至50 ℃后冷却至室温; 再向混合溶液中加入180 μ L的AgNO3(4 mmol· L-1), 静置15 min后, 加入2.5 mL的HAuCl4(1 mmol· L-1)并搅拌90 min, 待溶液变为无色后, 加入21 μ L纯度为36%的HCl, 静置15 min后, 加入12 μ L的AA(0.1 mol· L-1), 并迅速加入4 μ L金种溶液; (3)将上述制备的混合溶液静置12 h后, 即得到长径比为3∶ 1的Au NRs。
1.2.2 Au NRs/PMMA基底的制备
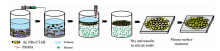
Au NRs/PMMA基底的制备流程如图1所示, 具体操作如下: 首先, 取14 mL的Au NRs溶液(0.348 nmol· L-1)置于离心机中以8 000 r· min-1的速度离心15 min, 去除上清液后再溶于14 mL的超纯水中, 超声振荡10 min后, 再重复一次离心过程以去除过多的CTAB, 得到单分散的Au NRs溶胶; 然后, 将Au NRs溶胶置于广口烧杯中, 加入10 mL的甲苯溶液, 得到上下分层的混合溶液; 再用机械注射泵向下层的Au NRs溶胶中缓慢加入无水乙醇, 随着乙醇注入量的增加, Au NRs逐渐上浮至混合溶液的分界面, 并排列成二维畴结构; 待下层溶液澄清后, 再加入7 mL的溶有PMMA(1.8 mg)的甲苯溶液, 静置12 h后使Au NRs的二维畴结构固定; 当甲苯彻底挥发后, 溶液液面上即形成Au NRs/PMMA薄膜; 随后, 取出Au NRs/PMMA薄膜并放置在硅片(3 cm× 3 cm)上, 经真空干燥箱在80 ℃下烘干8 h; 最后, 为增强Au NRs的SERS特性, 利用等离子体清洗机在功率为35 W和压强为30 Pa的条件下对Au NRs/PMMA薄膜刻蚀处理5 min使得Au NRs裸露在薄膜表面, 至此Au NRs/PMMA基底制备完毕。 后续实验中, 将基底切割使用。
吸收光谱测量: 采用紫外可见光分光光度计对1.2.2节中制备的单分散的Au NRs溶液和干燥后的Au NRs/PMMA薄膜进行紫外-可见光谱测量。
Au NRs/PMMA基底的SERS光谱测量: 首先用无水乙醇配制浓度为10 mmol· L-1的4-MBA拉曼分子溶液, 然后将制备的Au NRs/PMMA基底浸泡在4-MBA溶液中, 10 min后取出基底, 再用乙醇及去离子水分别冲洗3次, 以去除过量的4-MBA分子。 待基底自然干燥后, 进行拉曼光谱检测。 同时, 作为对照, 称取质量为7.3 mg的4-MBA粉末置于洁净的硅片表面, 同时利用洁净石英片将其按压密实, 随后进行4-MBA的拉曼光谱检测。 以上测量均在785 nm激光波长、 20 mW激光功率和10 s积分时间的实验条件下进行。
考虑到临床血清样本的基质环境, 为避免盐类缓冲液中的离子对无标记检测造成的影响, 因此标准溶液均采用新生牛血清进行稀释。 具体操作为: 用新生牛血清将PSA标准溶液以十倍比例稀释, 分别得到浓度从0.1 mg· mL-1至0.1 ng· mL-1的7个标准样本溶液。 再将切割制备的AuNRs/PMMA基底分别浸泡在配制的PSA标准样本溶液中, 20 min后取出基底并用去离子水清洗3次, 待室温下自然干燥后, 进行SERS光谱检测。 SERS光谱检测的实验条件与前述一致。
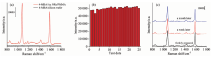
Au NRs和制备的Au NRs/PMMA薄膜的扫描电子显微镜(SEM)照片如图2所示。 由图2(a)可见, Au NRs的形貌一致、 尺寸均一, 其长径比为3∶ 1[长(75± 5)nm, 直径(25± 2)nm]; 图2(b)中, Au NRs/PMMA薄膜均匀完整, 其由Au NRs并肩排列形成致密的二维畴结构(见插图)。 分析表明, 由于以CTAB为表面活性剂合成的Au NRs的表面带有正电荷, 注入乙醇后, 乙醇电离的羟基中和Au NRs表面的部分正电荷, 使粒子表面的自由能降低, 粒子与界面的接触角近似为90° , 从而Au NRs汇聚于两相溶液的交界面处; 此时, 伴随着交界面处粒子数目的增加, 粒子间范德瓦尔斯力增大, 系统处于非平衡态; 最后, 范德瓦尔斯力与粒子间的静电斥力达到平衡, 则纳米粒子之间的距离相应减小并形成稳定的二维畴结构。 实际上, Au NRs溶液和Au NRs/PMMA薄膜的紫外-可见吸收光谱也反映了上述过程。 在图2(c)中, Au NRs溶液的吸收峰位于511和725 nm处, Au NRs/PMMA薄膜的吸收峰位于612和900 nm处。 对比两者的吸收光谱, 可以发现Au NRs/PMMA薄膜的吸收峰有明显的红移和展宽, 这是Au NRs粒子间强烈的表面等离激元耦合导致的, 也表明大部分AuNRs是以肩并肩方式排列的[17]。
 | 图2 (a) AuNRs和(b) AuNRs/PMMA基底的扫描电镜图; (c) AuNRs溶液和AuNRs/PMMA薄膜的紫外-可见吸收光谱Fig.2 SEM images of (a) AuNRs (b) AuNRs/PMMA substrate; (c) UV-Vis spectra of AuNRs colloid and AuNRs/PMMA film |
对所制备的AuNRs/PMMA基底的SERS特性进行表征, 测量得到在硅片上的4-MBA以及与基底链接的4-MBA的SERS光谱如图3(a)所示。 由图可见, 与Au NRs/PMMA基底链接的4-MBA分子的SERS特征峰强度远高于硅片上的4-MBA分子的拉曼特征峰强度, 这是由基底中密集排列的Au NRs产生的电磁增强引起的。
表征Au NRs/PMMA基底的SERS增强特性的SERS增强因子, 按照式(1)计算
式中, ISERS与Ibulk分别代表4-MBA分子的SERS特征峰和拉曼特征峰的积分强度; Nbulk与NSERS分别表示激光照射光斑内的硅片和基底上的4-MBA分子数。 计算图3(a)中4-MBA位于1 078 cm-1处拉曼峰的积分强度, 得到Ibulk=2.756× 103, ISERS=1.391× 106; 然后, 根据实验参数(光斑直径1.473 μ m、 激光穿透深度1.86 μ m和单个4-MBA分子所占的面积为3.32× 10-15)[18], 计算得到Nbulk=6.18× 109, NSERS=5.13× 106。 则由式(1)即得, AuNRs/PMMA基底的增强因子EF=5.49× 106。 此外, 在AuNRs/PMMA基底上随机取25个测试点, 测量得到4-MBA位于1 078 cm-1处的拉曼峰强度如图3(b)所示, 各点峰强的相对标准差为4.02%, 表明基底的均匀性良好。 同时, 由图3(c)给出的链接4-MBA的样品基底在间隔一周和一个月后测量的SERS光谱, 可以看出基底具有很好的时间稳定性。
2.2.1 Au NRs/PMMA基底的功能分析
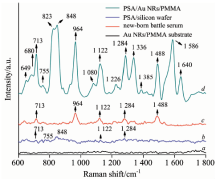
为了进行AuNRs/PMMA基底检测肿瘤标志物的功能分析, 对基底、 新生牛血清缓冲液以及浓度为0.1 mg· mL-1的PSA标准溶液的SERS光谱和拉曼光谱进行检测, 结果如图4所示。 在图4中, AuNRs/PMMA基底的SERS光谱仅为背景信号, 新生牛血清缓冲液SERS光谱的拉曼特征峰分别位于713, 964, 1 122, 1 284和1 488 cm-1; PSA标准溶液的拉曼光谱中仅出现几个分别位于713, 755, 848, 1 122和1 284 cm-1的强度较弱的拉曼特征峰, 而PSA标准溶液的SERS光谱中除了可以观察到上述拉曼特征峰以外, 还出现位于649, 680, 823, 964, 1 180, 1 226, 1 336, 1 448, 1 586以及1 640 cm-1处的拉曼特征峰。 对比图4中新生牛血清缓冲液和PSA标准溶液的SERS光谱可见, 新生牛血清缓冲液的SERS光谱的拉曼特征峰数目少、 强度低, 对PSA标准溶液的SERS光谱影响较小; 对比PSA标准溶液的SERS光谱和拉曼光谱可以看出, 在PSA标准溶液的SERS光谱中出现的拉曼特征峰, 不仅强度大而且数目多, 说明AuNRs/PMMA基底对PSA的拉曼信号有极大的增强特性, 可以利用AuNRs/PMMA基底进行PSA的无标记检测。 另一方面, 考虑到PSA标准溶液的SERS光谱与新生牛血清缓冲液的SERS光谱中有部分特征拉曼峰重合, 因此去除这些重合的拉曼特征峰以及光谱中强度低的拉曼特征峰后, 采用其他较强的拉曼特征峰更加适合用于进行后续的PSA检测。
2.2.2 肿瘤标志物无标记检测方案的设计
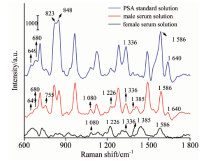
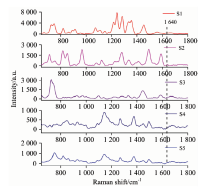
将肿瘤标志物PSA的无标记检测应用于临床定量分析, 除了要求检测高灵敏以外, 还必须保证检测结果的特异性。 为此, 对PSA标准溶液、 临床男性血清样本及女性血清样本的SERS光谱进行测量和分析, 以筛选PSA标准溶液的SERS光谱中与血清中PSA含量相关的拉曼特征峰。 如图5所示, 由于PSA一般主要存在于男性血清中, 则对比男性血清样本与PSA标准溶液的SERS光谱, 发现它们在649, 680, 755, 1 080, 1 226, 1 336, 1 385, 1 586和1 640 cm-1处有一致的拉曼特征峰, 而血清样本的光谱中位于755, 1 080和1 336 cm-1处的拉曼特征峰的强度比PSA标准溶液的高。 考虑到医院提供的男性血清样本的PSA浓度已知为38.28 ng· mL-1, 远低于PSA标准溶液中PSA的浓度(0.1 mg· mL-1), 这些位于755, 1 080和1 336 cm-1处的拉曼峰并非单纯来自男性血清样本的PSA。 另一方面, 与对照实验中女性血清样本的SERS光谱相比, 发现PSA标准溶液的SERS光谱中位于1 080, 1 226, 1 336, 1 385和1 586 cm-1处的拉曼特征峰与女性血清的SERS光谱一致, 也可能来自于其他成分, 缺乏特异性。 因此, 上述缺乏特异性的拉曼特征峰不能用于临床血清样本的定量检测。 最后确定, 在PSA标准溶液的SERS光谱中, 位于649, 680以及1 640 cm-1处的拉曼特征峰可以用于临床血清样本的定量检测。
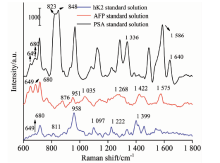
进一步对上述拟用于临床血清样本中PSA检测的拉曼特征峰进行特异性检验。 选择与PSA同属糖蛋白的肿瘤标志物甲胎蛋白(AFP)以及与PSA同源的人腺体激肽释放酶2(hK2)进行SERS光谱检测, 结果如图6所示。 图6可见, AFP标准溶液SERS光谱中位于649和680 cm-1处的拉曼特征峰与PSA标准溶液的拉曼特征峰重合, hK2标准溶液的SERS光谱中位于1 080, 1 284和1 336 cm-1处的拉曼特征峰与PSA标准溶液的拉曼特征峰重合。 因此, 排除上述实验中重合的拉曼特征峰, 则位于1 640 cm-1处的拉曼特征峰对于PSA具有高特异性, 将作为临床血清样本中PSA无标记定量检测的依据。
2.2.3 标准剂量响应曲线
首先, 根据2.2.2节设计的基于Au NRs/PMMA基底的PSA无标记检测方案, 对不同浓度的PSA标准样本溶液进行SERS光谱检测, 结果如图7(a)所示。 我们发现, 随着PSA标准样本溶液浓度的降低, SERS光谱中位于1 640 cm-1处的拉曼特征峰的强度下降。 然后, 将位于1 640 cm-1处的拉曼特征峰强度与PSA标准样本溶液的浓度相对应, 并进行数据拟合得到标准剂量响应曲线如图7(b)所示。 由图7(b)可得[19], PSA浓度的检测范围为0.1 mg· mL-1~0.1 ng· mL-1, 最低检测极限为60 pg· mL-1。
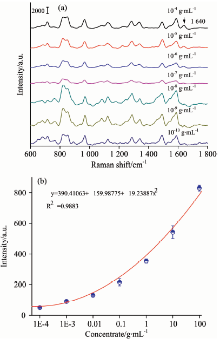 | 图7 (a)不同浓度的PSA标准样本溶液的SERS光谱; (b)PSA的标准剂量响应曲线2.3 临床血清样本的检测Fig.7 (a) SERS spectra of PSA standard solution with different concentrations; (b) the standard dose-responsecurve of PSA |
将肿瘤标志物无标记检测方案应用于临床男性血清样本中PSA的检测。 首先, 对临床采集的5份男性血清样本进行SERS光谱检测, 如图8所示。 然后, 根据标准剂量响应曲线图7(b), 由测量的位于1 640 cm-1处的拉曼特征峰强度, 得到相应的PSA浓度并列于表1中。 同时, 表1也列出了采用化学发光法(CLIA)检测的对应血清样本中PSA的含量。 从表1可见, 应用Au NRs/PMMA基底进行的PSA无标记检测与CLIA检测的结果基本一致, 相对偏差较小。
| 表1 血清样本的检测结果 Table 1 Detection results of the serum samples |
应用制备的具有均匀、 稳定和高灵敏SERS特性的AuNRs/PMMA基底, 实现了肿瘤标志物PSA的无标记检测。 实验中, 通过对PSA标准溶液及其抗原稀释剂的SERS光谱测量和分析, 得到表征PSA的拉曼特征峰; 通过对比男性血清、 女性血清、 AFP和hK2的标准溶液的SERS光谱, 确定出高特异性的PSA的拉曼特征峰并应用于临床血清样本的定量检测。 实验结果表明, 与CLIA方法相比, 以AuNRs/PMMASERS基底进行PSA的无标记检测, 具有更高的灵敏度, 最低检测限可以低至60 pg· mL-1。 因此, 基于AuNRs/PMMA基底的SERS特性开展肿瘤标志物的高灵敏度无标记检测, 对于癌症的早期诊断具有极大的应用潜力。
The authors have declared that no competing interests exist.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|